Электрофизические свойства пламени
Ионизация пламени приобрела в настоящее время важное прикладное значение [25], прежде всего при получении электрической энергии с помощью магнито-гидродинамического метода. При этом необходима максимальная ионизация пламени, для чего в исходную смесь реагентов вводят добавки, содержащие легкоионизируемыс щелочные металлы.
Воздействие электрического поля на пламя изучают с целью осуществления направленного химического синтеза. В работе А. С. Гордона (1959) измеряли выход ацетилена, этилена и оксида азота при наложении на пропан-воздушное пламя с добавкой щелочных металлов высоковольтного низкочастотного разряда. Было обнаружено, что даже электрическое поле малой напряженности, когда не возникает разряд, может влиять на кинетику горения, изменяя концентрационные градиенты либо, как полагают авторы, способствуя образованию новых активных частиц при электрон-молекулярных столкновениях.
Проведены эксперименты [41], показывающие, что воздействие электрического поля на плазму пламени позволяет регулировать вибрационное горение в ракетном двигателе. В то же время ионизация пламен ракетных двигателей играет отрицательную роль, так как приводит к преобразованию и поглощению радиосигналов, используемых для связи с космическими объектами и т.п.
В аналитических лабораториях широко применяется хроматографический детектор, основанный на аномальной ионизации продуктов сгорания углеводородов. По мнению А. О. Деккера, процессу образования сажи в углеводородном пламени существенно способствует положительный заряд частиц углерода в пламени.
Изучение равновесной ионизации в пламени в зависимости от различных добавок в исходную смесь реагентов позволяет получать термодинамические данные о ионах и нейтральных частицах, существующих при высоких температурах[1]. По ионизации получают информацию о структуре пламен [4].
Указанные выше приложения свидетельствуют о практической и научной важности задачи исследования электрофизических свойств пламен. Кратко рассмотрим основные процессы, определяющие их.
Электрофизические свойства пламен обусловлены наличием заряженных частиц в них: ионов и электронов. При высоких температурах пламен кинетическая энергия соударяющихся частиц (атомов между собой, молекул с атомами и т.д.) часто достаточна для возбуждения и даже ионизации сталкивающихся частиц. При этом имеют место и обратный процесс, т.е. рекомбинация образовавшихся при ионизации ионов и электронов с образованием нейтральных частиц, и процессы "прилипания" электронов к нейтральным атомам с образованием отрицательных ионов[2].
Равновесная ионизация (формула Саха)
Состояние продуктов сгорания, заключенных в полости, стенки которой имеют одинаковую постоянную температуру, можно описать всего несколькими параметрами: температурой, плотностью или концентрациями имеющихся частиц (атомов, молекул, ионов и т.п.). Предполагается, что продукты сгорания находятся при этом в состоянии полного термодинамического равновесия, и названные параметры являются термодинамическими переменными. В химической термодинамике доказывается, что если химическое уравнение реакции имеет вид
 (1.47)
(1.47)
то условие химического равновесия получается заменой химических символов реагирующих веществ на химические потенциалы:
 (1.48)
(1.48)
где А – исходные вещества; В – продукты реакции; v – стехиометрические коэффициенты; Q0 – тепловой эффект реакции; μ – химические потенциалы.
Для идеального газа химические потенциалы могут быть выражены через статистические суммы Σ:
 (1.49)
(1.49)
где N – число частиц; k – константа скорости реакции.
По определению, статистическая сумма
 (1.50)
(1.50)
где Ej – возможные значения энергии частицы; gj – статистический вес (число физически различных состояний с одинаковым значением энергии).
Подставляя выражение (1.50) в формулу (1.47), получаем после несложных преобразований и потенцирования
 (1.51)
(1.51)
где с – концентрации реагирующих веществ.
Для реакции ионизации все стехиометрические коэффициенты γ = 1, а тепловой эффект Q0 = -I, где I – энергия ионизации данного атома (се часто называют потенциалом ионизации и выражают в электронвольтах). Запишем химическое уравнение этой реакции:
 (1.52)
(1.52)
где а – атом; е- – электрон; i – ион. Тогда по закону действия масс
 (1.53)
(1.53)
где се-, сi и са – концентрации электронов, ионов и атомов соответственно.
Статистическая сумма Σ в общем случае может быть представлена как произведение поступательной, вращательной, колебательной и электронной статистических сумм. Рассмотрение равновесия ионизации молекул едва ли имеет смысл, так как к моменту наступления тепловой ионизации химические соединения обычно уже полностью диссоциированы. Поэтому для молекул и молекулярных ионов необходимо рассматривать равновесие диссоциации, а для атомов и атомных ионов – равновесие ионизации. Понимая в дальнейшем под равновесием ионизации только равновесие между атомами, атомными ионами и электронами, можно выразить каждую статистическую сумму следующим образом:
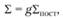 (1.54)
(1.54)
где g – полный статистический вес внутренних степеней свободы; Σпост – статистическая сумма для поступательных степеней свободы.
Поступательную сумму можно вычислить в квази классическом приближении, считая, что каждое состояние занимает объем h3 (где h = 2ph – постоянная Планка). Тогда, исходя из понятия числа состояний в фазовом объеме с учетом распределения Максвелла, имеем:
 (1.55)
(1.55)
где Г – фазовый объем, dГ = 4pdp2V; V – обычный объем; р – импульс частицы.
Интегрирование дает
 (1.56)
(1.56)
где т – масса частицы.
Статистические суммы Σпост для атома, иона и электрона отличаются только значением массы в формуле (1.56). Подставляя (1.56) в (1.53), получаем:
 (1.57)
(1.57)
где т – масса электрона; Мi – масса иона; Ма – масса атома.
Формула (1.57), определяющая концентрацию электронов (в случае термодинамического равновесия), называется формулой Саха.
Из формулы (1.57) следует, что равновесная концентрация электронов в продуктах сгорания определяется прежде всего температурой и потенциалами ионизации атомов. С увеличением температуры продуктов сгорания концепт- рация электронов увеличивается, чем ниже потенциал ионизации I атомов, тем больше концентрация электронов. Высокую концентрацию электронов в продуктах горения могут обеспечить атомы щелочных металлов, так как потенциалы ионизации у этих химических элементов наиболее низкие. Потенциалы ионизации атомов некоторых элементов представлены в табл. 1.7.
Таблица 1.7
Потенциалы ионизации атомов элементов
|
Атом |
I, эВ |
Атом |
I, эВ |
|
Cs |
3,893 |
Mg |
7,644 |
|
Rb |
4,176 |
В |
8,296 |
|
К |
4,339 |
Be |
9,320 |
|
Na |
5,138 |
S |
10,357 |
|
Ва |
5,210 |
P |
10,484 |
|
Li |
5,390 |
c |
11,256 |
|
Sr |
5,692 |
Cl |
13,010 |
|
AI |
5,984 |
N |
13,595 |
|
Ca |
6,111 |
О |
13,614 |
|
Ti |
6,820 |
N |
14,530 |
|
Zr |
6,840 |
F |
17,418 |
Формулу Саха легко обобщить на случай многоступенчатой ионизации:
 (1.58)
(1.58)
Однако энергия ионизации однозарядных ионов велика. Например, энергия ионизации однозарядного иона цезия равна 25,1 эВ. Поэтому при температурах горения двухзарядные (и вообще многозарядные) ионы практически не образуются.