Реакция водяного газа
Реакция водяного газа СО + + Н2O = СO2 + Н2 протекает с заметной скоростью в присутствии твердого катализатора, который соответствующим образом деформирует адсорбированные на нем молекулы газов. При некоторых условиях она осуществляется и как гомогенная. Согласно В. Н. Кондратьеву [21], такое взаимодействие СО и Н2O имеет место, например, в присутствии хотя бы следов кислорода. Механизм реакции между СО и Н2O в отсутствие твердого катализатора, по-видимому, весьма сходен с механизмом горения СО во влажных смесях с кислородом при давлениях, близких к нормальному. В обеих системах присутствуют одни и те же компоненты, исчезновение одного из которых прекращает оба процесса.
Из анализа экспериментального материала различных авторов (полученного при использовании твердых катализаторов) следует, что реакция конверсии оксида углерода – первого порядка по оксиду углерода; водород практически не влияет на скорость реакции до 673 К, выше 673 К начинает тормозить ее и тем сильнее, чем выше температура; диоксид углерода замедляет реакцию, но с повышением температуры эффект торможения уменьшается; скорость реакции мало зависит от концентрации водяных паров при избытке водяного пара против стехиометрического.
Η. М. Ройтер с сотрудниками предложили следующую схему конверсии СО в присутствии катализаторов. Молекулы Н2O сначала адсорбируются на активных участках поверхности катализатора, а затем взаимодействуют с ударяющимися о них частицами оксида углерода:
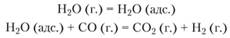
Л. А. Кулькова и Г. П. Темкин считают, что при взаимодействии паров воды с поверхностью катализаторов молекулы воды не просто адсорбируются, а разрушаются. При этом водород удаляется в газовую фазу, а кислород адсорбируется катализатором:
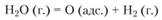
Поэтому оксид углерода окисляется в СO2 при соударении молекул СО с адсорбированными атомами кислорода, а не молекулами воды:
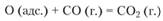
Зависимость констант равновесия от температуры
На рис. 1.23 и 1.24 представлена зависимость констант равновесия от температуры для некоторых реакций, протекающих при горении.
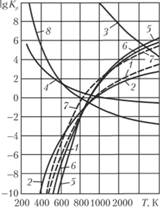
Рис. 1.23. Зависимость от температуры констант равновесия реакций:
1 – С + СO2=2СO;
2 – С + Н2O = СО + Н2;
3 – СО + 0,5О2 = СO2;
4 – СО + Н2O – СO2 + Н2;
5 – СН4 + СO2 – 2СО + 2Н2; 6-СН4+П2O-СO + 3Н2;
7 – СН4 + 2Н2O = СO2 + 4Н2; 8 – С + 2Н2=СН4
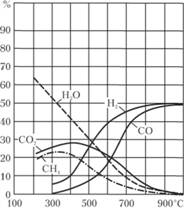
Рис. 1.24. Равновесный состав водяного газа при разных температурах с учетом образования метана
С повышением температуры константы равновесия реакций 3, 4, 8 уменьшаются, т.е. равновесие сдвигается влево. Константы равновесия остальных реакций с ростом температуры, наоборот, увеличиваются, т.е. равновесие сдвигается вправо[1]. В диапазоне 800-1100 К константы равновесия всех перечисленных реакций, за исключением реакции 3, достигают единицы, причем с возрастанием температуры это происходит в следующей последовательности: 8, 7, 6, 5, 2, 1 и 4. В табл. 1.17 в качестве примера приведены константы равновесия реакции водяного газа в зависимости от температуры [6].
Равновесный состав продуктов сгорания не зависит от давления, так как реакция водяного газа происходит без изменения числа молей. Поэтому константа равновесия этой реакции зависит только от температуры.
Таблица 1.17
Константы равновесия реакции водяного газа в зависимости от температуры
|
т, к |
600 |
800 |
1000 |
1200 |
1400 |
1600 |
1800 |
|
Кр |
0.04 |
0,24 |
0,71 |
1,40 |
2,19 |
3,06 |
3,80 |
|
т, к |
2000 |
2200 |
2400 |
2600 |
2800 |
3000 |
|
Кр |
4,55 |
5,21 |
5,78 |
6,22 |
6,59 |
6,90 |
Равновесный состав водяного газа при Р = 0,1 МПа, составленный с учетом образования метана, показывает, что при температурах до 900°С реакцию образования метана необходимо принимать во внимание. При этом, однако, не следует заранее полагать, что образование метана успевает протекать полностью до состояния равновесия.