Разложение неорганических окислителей
Экспериментальные исследования показывают, что термическое разложение твердых неорганических окислителей в первом приближении можно рассматривать как мономолекулярную реакцию, скорость которой подчиняется уравнению Аррениуса. Предэкспоненциальный множитель и энергия активации, по-видимому, зависят от температуры. Поэтому к экстраполяции от более низких температур, при которых измерения проводить значительно удобнее, до температур, возникающих во время горения, нужно относиться с осторожностью. В качестве примера рассмотрим процесс термического разложения перхлората аммония.
Согласно Л. Л. Биркемшоу и В. Н. Ньюману разложение начинается вблизи активных центров поверхности, число которых возрастает со временем. Затем процесс разложения распространяется по полусфере от этих центров во внутрь и по поверхности кристалла, пока реакционные зоны не сольются. После этого зона реакции постепенно перемещается по направлению к центру кристалла. Линейная скорость распространения контактной реакционной зоны зависит от температуры по экспоненциальному закону[1].
Очевидно, что скорость разложения перхлората аммония в значительной степени будет зависеть от количества загрязняющих примесей и от характера поверхности кристалла, так как эти факторы влияют на скорость образования активных центров. Кроме того, скорость разложения будет зависеть от размера кристаллических частиц и от глубины реакции, поскольку эти факторы определяют площадь контактной реакционной зоны. Такой сложный характер процесса разложения типичен для твердых веществ. Поэтому к результатам кинетических расчетов процессов в твердой фазе на основании законов, выведенных главным образом для реакций, протекающих в газовой фазе и растворах, надо относиться с большой осторожностью.
Термическое разложение перхлората аммония начинается при температуре около 200°С [33]. При температурах ниже 300°С происходит реакция разложения
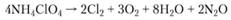
а при температуре выше 300°С – реакция
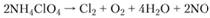
Оксид азота реагирует с хлором, образуя хлористый ни- трозил. Согласно данным газового анализа продуктов разложения, уравнение реакции, протекающей при температуре выше 300°С, имеет вид
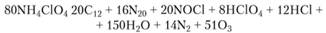
При 240°С ромбическая кристаллическая структура перхлората аммония превращается в кубическую, что влияет на процесс разложения. При температуре ниже 240°С энергия активации реакции разложения равна 124 кДж/моль, а при температуре выше 240°С – 79 кДж/моль. В интервале температур 400-440°С энергия активации равна 307,3 кДж/моль. Поскольку при этих температурах сублимация протекает активнее, чем разложение твердой фазы, более высокие значения энергии активации до некоторой степени обусловлены разложением в паровой фазе. При дифференциальном термическом анализе можно наблюдать экзоэффекты при 270-275°С (разложение) и выше 400°С, когда скорость возгонки становится больше скорости разложения в твердой фазе.
За последнее время проведены исследования, уточняющие процесс начального разложения кристаллов перхлората аммония и состав образующихся при этом продуктов. Многие исследователи считают, что низкотемпературное разложение перхлората аммония начинается со стадии диссоциации соли на аммиак и хлорную кислоту. Скорость разложения перхлората аммония обусловлена распадом НСlO4 в решетке соли, что приводит к появлению центров реакции, содержащих хлорную кислоту и продукты ее разложения. В этих центрах происходит превращение перхлората аммония и образование дополнительного количества НСlO4. Эта кислота вызывает образование новых центров реакции на близлежащих дефектах.
Центры реакции возникают на глубине ~3 мкм в местах кристалла с повышенной плотностью дислокаций, а развитие процесса разложения сопровождается размножением дислокаций вблизи растущей зоны разложения.
Исследованию роли дислокаций при термолизе NH4ClO4 посвящен ряд работ[2]. Однако до сих пор не выяснен вопрос, почему в процессе образования центров реакций активна лишь одна тысячная доля дислокаций, присутствующих в кристалле. Вероятно, это обусловлено неблагоприятным стереохимическим расположением дислокаций. Развитие центров реакции можно описать следующим образом. Реакция протекает как на стационарных дислокациях (индукционный период), так и на движущихся (период ускорения развития реакционных центров). Рост центров происходит там, где создаются условия, благоприятные для движения и размножения дислокаций под действием механических напряжений за счет накопления продуктов реакции. Можно предположить, что одной из причин остановки роста зародышей является торможение реакции при накоплении продуктов в зародыше под большим давлением (реакция в замкнутом объеме). Движение дислокаций может облегчить перенос продуктов из зоны реакции.
Особенности начальных стадий низкотемпературного разложения перхлората аммония исследованы также в работе К. Р. Киши (1958). Методом потенциометрического титрования и с помощью спектрофотометрии в УФ-области авторы определяли ОГЛАВЛЕНИЕ хлора, хлоридионов, суммы оксихлоранионов и хлорной кислоты. Было показано, что на ранних стадиях разложения в конденсированной фазе отсутствуют аналитически определяемые количества оксидов хлора, а основными продуктами термолиза являются С12, НС1 и НСlO4. Сопоставление данных по кинетике накопления продуктов термолиза в конденсированной фазе с кинетикой потери массы показывает, что даже при степени разложения п = 0,25 доля продуктов распада в конденсированной фазе составляет -20%, а на ранних стадиях она еще больше. В начале индукционного периода (при 190°С в течение 6000 с) процесс идет столь медленно, что продукты термолиза обнаружить не удается, но затем начинается быстрый рост содержания Сl2, НС1 и НСlO4 в конденсированной фазе. По мнению авторов, особенно важно для понимания механизма разложения, что хлорная кислота в индукционном периоде не накапливается, а образование ее происходит одновременно с остальными продуктами термолиза. Максимальная концентрация хлорной кислоты в конденсированной фазе достигает 0,1-0,2% (по отношению к исходному NII4ClO4) и наблюдается на стадии максимального ускорения процесса термолиза (п = 0,07-0,1); затем (до п -0,15) она не меняется, а потом плавно падает. Отношение скорости образования Cl2 + HС1 к скорости образования HClO4 на начальных стадиях постоянно, из чего следует, что С12 и HCl не являются продуктами распада хлорной кислоты, а образуются из перхлората аммония независимым путем.
Исследователи предполагают, что на ранних стадиях распада продукты термолиза перхлората аммония могут образовываться по следующей схеме:
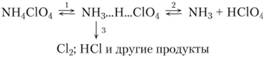
Причем лимитирующей стадией термолиза перхлората аммония является реакция 1, а не 2.