Процессы ионизации и рекомбинации
Перечислим основные процессы ионизации и обратные им процессы рекомбинации в пламенах с участием свободных электронов.
1. Ионизация электронами и рекомбинация трех частиц:

2. Фотоионизация и фоторекомбинация:

3. Термоэмиссия электронов и поглощение электронов конденсированными частицами:

4. Ионизация ударом тяжелых частиц и рекомбинация трех частиц:

5. Химическая ионизация.
Р. Белл с соавторами (1970) установили, что в пламени газовой смеси СО + О2 + N2 при нормальном атмосферном давлении и температуре 2500 К первичная ионизация происходит не вследствие электронного удара, а путем химической ионизации. С помощью различных добавок в пламя показано, что ионизация происходит следующим образом:
Д. Е. Дженсен указывал, что в углеводородных пламенах ионизация, возможно, происходит по реакции
Изучение процессов химической ионизации непосредственно в пламени представляет большие трудности, поэтому ее часто изучают в модельных условиях: за фронтом слабой ударной волны, где концентрации частиц и температура постоянны в сравнительно большом объеме и интервале времени (Д. Е. Дженсен). Однако и в этих случаях процессы ионизации могут быть сильно усложнены.
Б. А. Иванов в 1969 г. установил, что основные процессы образования отрицательных ионов следующие:
1.  – радиационный захват.
– радиационный захват.
2.  – захват с тройным столкновением.
– захват с тройным столкновением.
3. 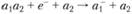 – захват с диссоциацией.
– захват с диссоциацией.
4.  – захват с диссоциацией на положительный и отрицательный ионы.
– захват с диссоциацией на положительный и отрицательный ионы.
5.  – переход электрона при столкновении атомов или молекул.
– переход электрона при столкновении атомов или молекул.
6.  – переход двух электронов к положительному иону при столкновениях его с атомом или молекулой.
– переход двух электронов к положительному иону при столкновениях его с атомом или молекулой.
7.  – поверхностная ионизация.
– поверхностная ионизация.
8. а* → а- – захват двух электронов положительным ионом на поверхность.


Основные процессы разрушения отрицательных ионов.
1.  – фотоотрыв.
– фотоотрыв.
2.  – отрыв при столкновении с возбужденным атомом.
– отрыв при столкновении с возбужденным атомом.
3.  – отрыв при столкновении с электроном.
– отрыв при столкновении с электроном.
4.  – отрыв при столкновении с атомом или молекулой.
– отрыв при столкновении с атомом или молекулой.
5.  – отрыв с образованием молекул.
– отрыв с образованием молекул.
6. 7, 8. – рекомбинации.
– рекомбинации.
9.  – отрыв на поверхности.
– отрыв на поверхности.
Хемиионизация в пламенах
Существование заряженных частиц в пламени впервые обнаружил А. Вольта. Он установил, что тела, несущие электростатический заряд, могут разряжаться при соприкосновении с пламенем. Это явление в дальнейшем изучали, однако причины аномально высокой ионизации в некоторых пламенах все еще окончательно не выяснены.
Концентрация ионов наибольшая в зоне реакции и быстро падает с окончанием химической реакции. Очевидно, своим происхождением ионы обязаны скорее химическим процессам в зоне реакции, чем термическим соударениям. Однако ионы образуются в значительном избытке по сравнению с количеством, ожидаемым из химического равновесия. По-видимому, они получаются в результате протекания некоторого неравновесного процесса, обычно называемого хемиионизацией.
Многие простые молекулы или атомы, которые могут присутствовать в зоне реакции, включая различные свободные радикалы (например, атомы углерода, радикалы С2 и др.), имеют потенциал ионизации выше 10 эВ[1]. Следовательно, эти частицы не могут ионизироваться в пламени в заметной степени, ибо даже в самых экзотермических элементарных реакциях, которые можно себе представить, выделяющаяся энергия не превышает 4 эВ. Объяснение ионизации было предложено Р. Штерном в 1937 г. Он считал, что работа выхода электрона у сравнительно малой совокупности атомов углерода (ядер конденсированных частиц) почти такая же, как и у более крупных частиц углерода (-4 эВ). Следовательно, ионизация обусловлена, по-видимому, ядрами конденсированных частиц, образующихся из углеводородных молекул.
По мнению Б. Льюиса и Г. Эльбе[2], экспериментальные факты хорошо согласуются с такой трактовкой. Так, хемиионизация обнаружена в углеводородных пламенах, но не наблюдается в пламенах, которые не образуют конденсированных частиц углерода, таких как пламена водорода, оксида углерода, сероводорода и сероуглерода[3]. При одинаковой скорости горения концентрация ионов гораздо выше в богатых углеводородами пламенах, чем в бедных. Это становится понятным, если учесть, что концентрация конденсированных частиц углерода значительно ниже в бедных углеводородами пламенах, чем в богатых. Как и следовало ожидать, концентрация ионов в пламенах метана значительно ниже, чем в пламенах высших углеводородов.
Однако ряд исследователей, основываясь на результатах масс-спектроскопических исследований пламен, выдвинули гипотезу, согласно которой неравновесная ионизация возникает в результате протекания в зоне реакции углеводородных пламен специфических химических реакций, приводящих к образованию ионов и электронов. В рамках их представлений предложено несколько схем первичных реакции ионизации, рассмотренных, например, в работе [25].
Хемиионизация может быть отнесена к реакциям типа

Обнаружена корреляция между степенью ионизации в углеводородном пламени и количеством углеродных атомов в молекуле горючего[4].
Первичные ионы пламени претерпевают сложный путь ионно-молекулярных превращений. Предложена Вперед схема реакций в начальной стадии горения ацетилена:

Считается, что окисление ионов пламени осуществляется по следующей схеме:

Все эти реакции экзотермические, так что, в принципе, ионы углеводородного пламени в конце концов должны превращаться в Н3O. Ионы Н3O+ могут образовываться также в экзотермической реакции

Наиболее вероятный путь образования первичных отрицательных ионов в углеводородном пламени – диссоциативное прилипание электрона к С2Н2O по реакции

К образованию других отрицательных ионов в пламени С2H2 приводят и следующие реакции:

Точные значения констант скоростей этих реакций неизвестны.
Рассмотрим теперь ионизацию в пламенах, содержащих легкоионизируемые добавки. С помощью таких добавок можно сильно увеличить концентрацию электронов и ионов в пламени.
При малых добавках щелочных металлов [10-4% (мол.)] в пламенах концентрация ионов может примерно на порядок превышать равновесную. Этот результат объясняется протеканием быстрых реакций перезарядки:

Поскольку рекомбинация атомных ионов с электроном является более медленным процессом по сравнению с рекомбинацией молекулярных ионов, стационарная концентрация ионов увеличивается.
Интересно влияние добавок галогенов на ионизацию в пламени щелочных металлов. Оказалось, что малая добавка хлора [0,1% (мол.)] приводит к увеличению концентрации электронов в зоне пламени. На первый взгляд, это удивительно, так как хлор должен понижать концентрацию электронов за счет связывания атомов щелочных металлов в хлориды и прилипания электронов к атому хлора. Увеличение ионизации объясняется протеканием трех процессов

которые приводят к быстрому установлению равновесия:

Это равновесие в отсутствие хлора устанавливается значительно медленнее. Уже добавка хлора до -1% (мол.) приводит к уменьшению концентрации электронов.