Перхлораты металлов
За исключением LiClO4, ни один из перхлоратов щелочных и щелочноземельных металлов не имеет определенной температуры плавления. Они либо разлагаются без плавления, либо плавятся, образуя эвтектическую смесь перхлората и его продуктов разложения. Температуры начата быстрого разложения перхлоратов лития, натрия, калия, рубидия и цезия составляют соответственно 472, 561, 588, 595 и 571°С.
В результате разложения перхлоратов щелочных металлов и перхлората бария образуются хлориды. Разложение перхлората кальция приводит к образованию хлорида и следов оксида. Перхлорат магния постепенно разлагается с образованием оксида.
По данным ряда исследователей, разложение перхлоратов щелочных металлов протекает в две стадии, например:

Значение энергии активации разложения КС14 при низких температурах – 126 кДж/моль. Это значение, по-видимому, лучше всего соответствует скорости горения. Энергия активации реакции между перхлоратом калия и сажей равна 167,5 кДж/моль. Эта реакция протекает спокойно в интервале температур 320-385°С, значительно более низких но сравнению с температурами разложения чистого КСlO4. В процессе исследования разложения КСlO4 в интервале температур 556-582°С было установлено, что происходят две реакции первого порядка. Сначала происходит разложение в твердой фазе, а после расплавления – в жидкой фазе. Выражения для констант скорости имеют вид:
для твердой фазы
 (1.76)
(1.76)
для жидкой фазы
 (1.77)
(1.77)
По всей вероятности, это наиболее надежные данные для указанного интервала температур. Скорость разложения кислорода при постоянном давлении определяется реакцией, идущей в прямом направлении:

выражения для констант скорости реакции имеют вид: для твердой фазы
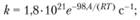 (1.78)
(1.78)
для жидкой фазы
 (1.79)
(1.79)
По данным [9, с. 126-134], константы скорости реакции разложения в твердой фазе равны при температуре 495°С. Константы скорости реакции разложения в жидкой фазе равны при 543°С.
Разложение КСlO4 начинается при температуре около 500°С, и эта реакция в интервале температур 536-617°С является мономолекулярной. Предлагается следующее выражение для константы скорости реакции:
 (1.80)
(1.80)
Нитрат аммония. Нитрат аммония существует в пяти кристаллических состояниях. 1(омимо температуры плавления (169,(ГС) можно выделить температуры превращения приблизительно при -18; 32,1; 84,2 н 125,2°С [33]. Превращение при 32,1°С сопровождается заметным уменьшением плотности. При низких температурах процесс разложения NH4NO3 носит эндотермический характер (что соответствует фазовым переходам) и протекает по следующей обратимой реакции:
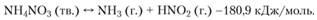
При более высоких температурах (243-361°С) происходит экзотермическая необратимая реакция разложения NH4NO3 с образованием N2O и Н2O: 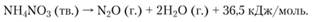
Эта реакция является основной, хотя образуются небольшие количества N2 и HNO3, причем азотная кислота в определенных условиях может катализировать разложение нитрата аммония. Исследования, проведенные с использованием меченых атомов, позволили предложить следующий механизм разложения нитрата аммония с образованием оксида диазота:
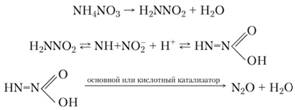
При еще более высоких температурах помимо указанных продуктов благодаря разложению в паровой фазе образуется некоторое количество NO2, NO и N2. Суммарной реакцией разложения является сильно экзотермическая реакция

Возможна также реакция разложения [1]

Константа скорости мономолекулярного разложения нитрата аммония:
 (1.81)
(1.81)
Катализаторы, в частности соединения хрома, существенно ускоряют разложение нитрата аммония [33].
Нитрат аммония воспламеняется; процесс горения может сопровождаться детонацией. Детонация чистого нитрата аммония происходит при температуре 277-344°С и давлении 18-21 МПа. Добавление небольших количеств органических веществ облегчает детонацию (она происходит при температуре 114-350°С и давлении 14-18 МПа). Дальнейшее добавление органических веществ еще больше облегчает детонацию (она происходит при температуре 134-153°С и давлении 1,8-2,1 МПа).