Ионный обмен в растворах сточных вод
Ионообменная очистка применяется для извлечения и утилизации из сточных вод тяжелых металлов (цинка, меди, хрома, никеля, свинца, ртути, кадмия, ванадия, марганца), а также соединений мышьяка, фосфора, цианистых соединений и радиоактивных веществ. Метод позволяет очищать сточную воду до предельно допустимых концентраций с последующим ее использованием в технологических процессах или в системах оборотного водоснабжения.
Гетерогенный ионный обмен, или ионообменная сорбция, - процесс обмена между ионами, находящимися в растворе, и ионами, присутствующими на поверхности твердой фазы - ионита.
Иониты практически не растворимы в воде. Те из них, которые способны поглощать из растворов электролитов положительные ионы, являются катионитами, поглощать отрицательные ионы - анионитами. Катиониты обладают кислотными свойствами, а аниониты - основными свойствами. Если иониты обменивают и катионы, и анионы, их называют амфотерными.
Иониты. Иониты подразделяются на природные и искусственные, или синтетические. По своей природе они бывают неорганические (минеральные) и органические.
Различают следующие виды ионитов:
сильнокислотные катиониты, содержащие сульфогруппы SO3H и сильноосновные анионы, содержащие четвертичные аммониевые основания;
слабо кислотные катиониты, содержащие карбоксильные СООН и фенольные группы, диссоциирующие при pH > 7, а также слабоосновные аниониты, содержащие первичные NH2 и вторичные NH аминогруппы, диссоциирующие при pH < 7;
иониты смешанного типа, проявляющие свойства смеси сильных и слабых кислот или оснований.
К неорганическим природным ионитам относятся цеолиты, глинистые минералы, полевые шпаты, различные слюды. Их катионообменные свойства обусловлены ОГЛАВЛЕНИЕм алюмосиликатов типа Na2O Аl2O3 nSiO2·Н2O. Ионообменными свойствами обладают также фторапатит [Са5(РO4)3]F и гидроксида-патит. К неорганическим синтетическим ионитам относятся силикагели, пермутиты, труднорастворимые оксиды и гидроксиды некоторых металлов (алюминия, хрома, циркония). Катионообменные свойства, например силикагеля, обусловлены обменом ионов водорода гидроксидных групп на катионы металлов, проявляющиеся в щелочной среде. Катионообменными свойствами обладают и пермутиты, получаемые сплавлением соединений, содержащих алюминий и кремний.
Органические природные иониты - это гуминовые кислоты почв и углей. Они проявляют слабокислотные свойства. Для усиления кислотных свойств и обменной емкости угли измельчают и сульфируют в избытке олеума. Сульфоугли являются дешевыми полиэлектролитами, содержащими сильно- и слабокислотные группы. К недостаткам таких ионитов относятся их малая химическая стойкость и низкая механическая прочность зерен, а также небольшая обменная емкость, особенно в нейтральных средах.
Ведущая роль принадлежит синтетическим органическим ионитам - ионообменным смолам с развитой поверхностью, представляющим собой высокомолекулярные соединения, углеводородные радикалы которых образуют пространственную сетку с фиксированными на ней ионообменными функциональными группами. Пространственная углеводородная сетка (каркас) называется матрицей, а обменивающиеся ионы - противоионами. Каждый противоион соединен с противоположно заряженными ионами, называемыми фиксированными, или анкерными ионами. При сокращенном написании ионита матрицу обозначают в общем виде, а активную группу указывают полностью. Например, сульфокатиониты записывают как RSO3H. Здесь R - матрица, Н - противоион, SO3 - анкерный ион.
Иониты, содержащие одинаковые активные группы, называются монофункциональными, а иониты, которые содержат функциональные группы различной химической природы, - полифункциональными.
Они могут обладать смешанными сильно- и слабоосновными свойствами.
Катиониты в качестве противоионов могут содержать не ионы водорода, а ионы металлов, т.е. находиться в солевой форме. Точно так же и аниониты могут быть в солевой форме, если в качестве противоионов они содержат не ионы гидроксида, а ионы кислот.
Свойства ионитов. Важнейшим свойством ионитов является их поглотительная способность, так называемая обменная емкость, которая определяется числом эквивалентов ионов, поглощаемых единицей массы или объема ионита. Различают полную, статическую и рабочую (динамическую) обменные емкости.
Полная емкость ионита - количество находящихся в сточной воде грамм-эквивалентов ионов, которое может поглотить 1 м3 ионита до полного насыщения.
Статическая емкость - это обменная емкость ионита при равновесии в данных рабочих условиях. Статическая обменная емкость обычно меньше полной емкости.
Рабочая (динамическая) емкость ионита - количество находящихся в воде грамм-эквивалентов ионов, которое может поглотить 1 м3 ионита до начала проскока в фильтрат поглощаемых ионов. Динамическая емкость соответствен но меньше статической емкости.
При нагревании ионитов в воде и на воздухе возможно разрушение их зерен, отщепление активных групп, что приводит к уменьшению их емкости. Для каждой смолы имеется температурный предел, выше которого ее использовать нельзя. Термическая устойчивость анионитов ниже, чем катионитов.
Величина pH сточной воды, при которой происходит обмен ионами, зависит от константы диссоциации ионообменных групп смолы. Сильнокислотные катиониты позволяют проводить процесс в любых средах, а слабо кислотные - в щелочных и нейтральных средах.
Иониты в контакте с водой не растворяются, но поглощают некоторое количество воды, при этом происходит их набухание вследствие осмотических явлений; объем ионитов обычно увеличивается в 1,2...2 раза. Степень набухания зависит от строения смолы, природы противоионов, состава раствора. Набухание ионитов влияет на скорость и полноту обмена ионов, а также на селективность ионита. Оно прекращается после того, как разность осмотических давлений до и после обмена уравновесится силами растяжения и сжатия ионита.
Селективность ионного обмена зависит от величины давления набухания в порах смолы и от размера пор ионита. При малом размере пор большие ионы не могут достичь внутренних активных групп. В целях повышения селективности ионитов к определенным металлам в состав смолы вводят вещества, способные образовывать с ионами этих металлов внутрикомплексные соединения (хелаты).
Основы процесса ионного обмена. Характерной особенностью ионитов является их обратимость, т.е. возможность проведения реакции в обратном направлении, что и лежит в основе их регенерации. Ионный обмен происходит в эквивалентных отношениях, реакции протекают вследствие разности химических потенциалов обменивающихся ионов до установления ионообменного равновесия. Реакция ионного обмена протекает следующим образом:
при контакте с катионитом

при контакте с анионитом
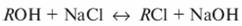
Если катиониты находятся в Н- или Na-форме, обмен катионов будет проходить по реакциям:
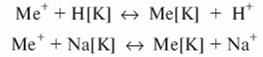
где Ме+ - катион, находящийся в сточной воде; [К] - сложный комплекс катионита.
Сильнокислотные катиониты позволяют осуществлять процесс ионного обмена при любых значениях pH, а слабокислотные - при pH >7.
Поскольку в сточных водах, как правило, содержится несколько катионов, большое значение имеет селективность их поглощения. Для каждого вида катионита установлены ряды катионов по энергии их вытеснения.
Функциональную зависимость противоионного состава ионита от противоионного состава внешнего раствора при постоянных температуре и давлении называют изотермой ионного обмена.
Процесс переноса вещества может быть представлен в виде нескольких стадий:
перенос ионов A из ядра потока жидкости к внешней поверхности пограничной жидкой пленки, окружающей зерно ионита; диффузия ионов через пограничный слой; переход иона через границу раздела фаз в зерно смолы; диффузия ионов A внутри зерна смолы к ионообменным функциональным группам;
химическая реакция двойного обмена ионов A и В;
диффузия ионов B внутри зерна ионита к границе раздела фаз;
переход ионов В через границу раздела фаз на внутреннюю поверхность пленки жидкости;
диффузия ионов В через пленку;
диффузия ионов В в ядро потока жидкости.
Скорость ионного обмена определяется самой медленной из этих стадий - диффузией в пленке жидкости либо диффузией в зерне ионита. Химическая реакция ионного обмена происходит быстро и не определяет суммарную скорость процесса.
Коэффициенты диффузии различных ионов в смоле имеют порядок 10-6...10-9 с м2/с, а в воде 10-4...10-5 с м2/с. Коэффициент диффузии снижается при увеличении размера гидратированных ионов в растворе и росте заряда обменивающихся противоионов смолы.
Регенерация ионитов. Катиониты регенерируют 2...8%-ми растворами кислот. Регенерационные растворы - элюаты содержат катионы. Затем после рыхления и промывки катиониты заряжают, пропуская через них раствор поваренной соли.
Отработанные аниониты регенерируют 2...6%-ми растворами щелочи. Аниониты при этом переходят в ОН-форму.
Элюаты содержат в сконцентрированном виде все извлеченные из сточных вод анионы. Элюаты, представляющие собой растворы кислот и щелочей, нейтрализуют или обрабатывают с целью рекуперации ценных продуктов. Нейтрализацию проводят смешением кислых и щелочных элюатов, а также дополнительным введением кислоты или щелочи.
Степень регенерации ионитов α (%) определяют по формуле
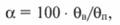 (11.25)
(11.25)
где θв - восстановленная обменная емкость; θn - полная обменная емкость.
Процесс регенерации ионитов состоит из трех стадий: взрыхления ионита, собственно регенерации и отмывки ионита от продуктов регенерации и избытка регенерирующего вещества. Объем промывных вод обычно составляет 75... 100% объема регенерационных растворов.