Загальна формула ароматичних вуглеводнів — CnH2n-6.
Вивчаючи конденсовані залишки світильного газу, який одержували з кам’яного вугілля, М. Фарадей у 1825 р. виділив вуглеводень з температурою кипіння 80 °С і визначив співвідношення Карбону й Гідрогену в ньому як 1:1. У 1834 р. Е. Мітчерлі шляхом нагрівання солей бензойної кислоти одержав подібний вуглеводень і дав йому назву бензин. Згодом Ю. Лібіх запропонував називати цю речовину бензеном.
Молекулярна формула бензену — C6H6.
Бензен мав своєрідний запах і виявляв дивні хімічні властивості. Незважаючи на свою «ненасиченість», бензен важко вступав у реакції приєднання, але легко давав реакції заміщення атомів Гідрогену. Тому бензен та його похідні виокремили в спеціальний клас, який назвали «ароматичні вуглеводні», або «арени».
Поширена структурна формула бензену, запропонована в 1865 р. німецьким ученим А. Кекулє, являє собою цикл із подвійними й одинарними зв’язками між атомами Карбону, що чергуються:
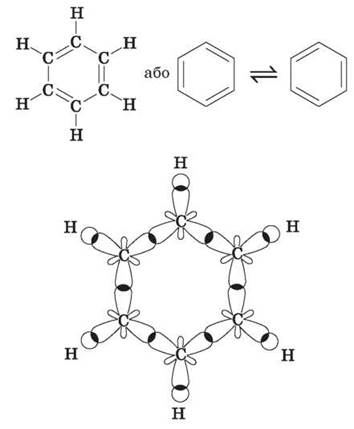
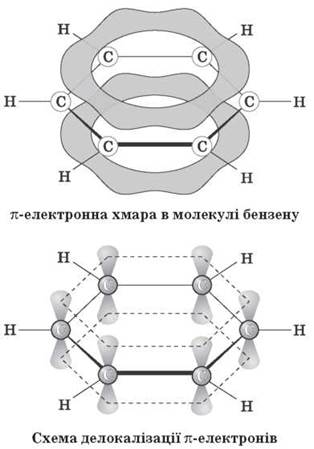
Однак фізичними, хімічними, а також квантово-механічними дослідженнями встановлено, що в молекулі бензену немає звичайних подвійних і одинарних карбон-карбонових зв’язків. Усі ці зв’язки в ньому рівноцінні, еквівалентні, тобто є ніби проміжними «полуторними» зв’язками, характерними виключно для бензольного ароматичного ядра. Крім того, виявилося, що в молекулі бензену всі атоми Карбону й Гідрогену перебувають в одній площині, причому атоми Карбону розташовані у вершинах правильного шестикутника з однаковою довжиною зв’язку між ними, яка дорівнює 0,139 нм, і всі валентні кути становлять 120°. Таке розташування карбонового скелета пов’язане з тим, що всі атоми Карбону в бензольному кільці перебувають у стані sp2-гібридизації. Це означає, що в кожного атома Карбону одна s- і дві р-орбіталі гібридизовані, а одна р-орбіталь — негібридна. Три гібридні орбіталі перекриваються: дві з них — з такими самими орбіталями двох суміжних атомів Карбону, а третя — із s-орбіталлю атома Гідрогену. Подібні перекривання відповідних орбіталей спостерігаються в усіх атомів Карбону бензольного кільця, у результаті чого утворюються дванадцять -зв’язків, розташованих в одній площині.
Четверта негібридна гантелеподібна р-орбіталь атомів Карбону розташована перпендикулярно площині напрямку -зв’язків. Вона складається з двох однакових частинок, одна з яких розташована вище, а друга — нижче від згаданої площини. Кожна р-орбіталь зайнята одним електроном. р-орбіталь одного атома Карбону перекривається з р-орбіталлю сусіднього атома Карбону, що приводить, як і у випадку етилену, до спарювання електронів і утворення додаткового п-зв’язку. Однак у випадку бензену перекривання не обмежується лише двома орбіталями, як в етилену: р-орбіталь кожного атома Карбону однаково перекривається з р-орбіталями двох суміжних атомів Карбону. У результаті утворюються дві безперервні електронні хмарини у вигляді торів, одна з яких розташована вище, а друга — нижче від площини атомів (тор — це просторова фігура, що має форму бублика або рятувального кола). Інакше кажучи, шість р-електронів, взаємодіючи між собою, утворюють єдину п-електронну хмарину, що зображується кружечком усередині шестичленного циклу:
З теоретичної точки зору, ароматичними сполуками можуть називатися лише такі циклічні сполуки, що мають плоску будову й містять у замкнутій системі сполучення (4n + 2) р-електронів, де n — ціле число.
Прикладом ароматичних систем із десятьма й чотирнадцятьма р-електронами є представники багатоядерних ароматичних сполук — нафталін 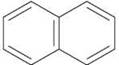 і антрацен
і антрацен 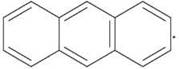
Отже, сучасні дослідження будови молекули бензену показали, що молекула являє собою правильний плоский шестикутник. Усі зв’язки C - C однакові, а їхня довжина не відповідає ні одинарному, ні подвійному зв’язкам. Кути між зв’язками дорівнюють 120°.
Атоми Карбону в молекулі бензену перебувають у стані sp2-гібридизації, кожен атом утворює три -зв’язки й надає одну р-орбіталь для утворення сполученої системи із шести п-електронів.
Розглядаємо схему будови молекули бензену.
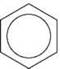
Тому структурну формулу бензену зображують так:
