Загальна характеристика бази практики
1.1. Історичні передумови створення НЦРМ
Науковий центр радіаційної медицини (НЦРМ), створений у зв’язку з аварією на Чорнобильській атомній електростанції, почав функціонувати з 1 жовтня 1986 року (перший директор – акад. А.Ю. Романенко). Спочатку він був підпорядкований АМН СРСР i мав назву «Всесоюзний науковий центр радіаційної медицини», з 11 листопада 1991 року - переданий в систему Міністерства охорони здоров’я України з назвою «Український науковий центр радіаційної медицини». Відповідно до спільного наказу МОЗ та Академії наук України №11/10 від 17 січня 1992 року Український науковий центр радіаційної медицини був переданий у подвійне підпорядкування, а зі створенням в 1993 р. Академії медичних наук України НЦРМ увійшов до складу її установ. На сьогоднішній день посаду генерального директора займає чл.-кор. АМН України Володимир Григорович Бебешко.
1.2. Сфера наукової діяльності НЦРМ
НЦРМ є головною установою в Україні з медичних проблем Чорнобильської катастрофи, радіаційної медицини, радіобіології та з питань радіаційної гігієни, радіаційної епідеміології. Він є центром, який співпрацює з ВООЗ в мережі медичної готовності та допомоги при радіаційних аваріях. Є навчальною базою для студентів Національного медичного університету (радіаційна медицина), Національного авіаційного університету (екологія людини) і Військово-медичної академії (гематологія).
Провідні вчені центру є членами та експертами міжнародних організацій: Міжнародної комісії радіаційного захисту, ВООЗ, Міжнародного агенства з атомної енергетики (МАГАТЕ), членами Національного комітету радіаційного захисту України, експертами ВАК України, членами іноземних академій наук, наукових товариств радіопатологів, гематологів та ін. Загальне, організаційне, наукове та методичне керівництво діяльністю Центру здійснює Президія АМН України.
НЦРМ АМН України має значний науковий, кадровий та матеріально-технічний потенціал. До складу НЦРМ входять три інститути: Інститут радіаційної гігієни та епідеміології, Інститут експериментальної радіології, Інститут клінічної радіології; а також клініка.
В штаті Центру – близько 1400 працівників, у тому числі лікарів 41 спеціальності, з них 17 кандидатів медичних наук, 77 – вищої категорії, 44 – першої та 21 – другої категорії; 165 – науковці. Науковий потенціал НЦРМ складають 32 докторів наук, з них 1 – дійсний член і 1 член-кореспондент АМН України та 15 професорів, 68 кандидатів наук. В Центрі працює 4 заслужених лікаря України, 6 лауреатів державних премій України. Серед науковців – лауреати державних, академічних та міжнародних премій.
Замовниками науково-дослідних робіт виступають АМН, МНС України та ін. Серед фундаментальних науково-дослідних робіт найбільш важливим напрямком було вивчення механізмів реалізації негативних наслідків Чорнобильської катастрофи.
Виконані експериментальні дослідження дозволили встановити, що низькі рівні іонізуючого випромінювання, які впливають на організм протягом тривалого часу, призводять до порушення функцій клітинних мембран, зрушення стабільності геному, що є причиною порушення ліпідного обміну, функцій імунної, ендокринної та нервової системи. Ці ефекти суттєво посилюються при поєднанні впливу психогенного стресу та інших негативних факторів (зокрема неіонізуюче випромінювання, важкі метали, токсичні речовини). Розроблені методи тестування для визначення радіозахисних властивостей різних речовин і медичних препаратів, що дозволяють проводити відбір найбільш ефективних серед них для впровадження в практику у вигляді харчових добавок для людей і тварин, які перебувають на забруднених радіонуклідами територіях України.
У прикладних розробках було показано, що провідне значення в розладах здоров’я усіх категорій постраждалих внаслідок аварії на ЧАЕС останнім часом мали непухлинні форми соматичних патологій, вони є основними причинами втрати працездатності та смертності.
1.3. Структурні підрозділи НЦРМ
На базі НЦРМ функціонують спеціалізовані ради з захисту докторських та кандидатських дисертацій за фахом «радіобіологія» (медичні та біологічні науки), „генетика”; проблемна комісія «Проблеми радіаційної медицини» МОЗ та АМН України.
Основні напрями наукової діяльності: вивчення та оцінка радіаційних і нерадіаційних чинників Чорнобильської катастрофи, а також інших джерел іонізуючого опромінення, що можуть впливати на стан здоров’я населення; наукове обґрунтування i розробка контрзаходів з подолання медичних наслідків Чорнобильської катастрофи; розробка та впровадження в Україні сучасних молекулярно-генетичних методів діагностики найбільш тяжких онкологічних та онкогематологічних захворювань; впровадження в Україні методів трансплантації кісткового мозку та стовбурових клітин у відділеннях Центру та на клінічній базі – Київському міському центрі трансплантації кісткового мозку; розробка методів та засобів профілактики, діагностики, лікування i реабілітації ліквідаторів, евакуйованих дітей та дорослих, дітей, опромінених внутрішньоутробно, мешканців забруднених територій – всіх контингентів, які постраждали внаслідок Чорнобильської катастрофи.
В клініці НЦРМ надається висококваліфікована спеціалізована консультативно-діагностична та лікувально-профілактична допомога населенню, яке постраждало внаслідок аварії на ЧАЕС. Лікувально-діагностична робота проводиться у тісному співробітництві науковців і практиків.
Клініка НЦРМ у своєму складі має госпітальну базу на 534 ліжка (10 спеціалізованих відділень для дорослого населення та 4 – для дитячого), а також дві поліклініки радіаційного реєстру та консультативної допомоги: для дорослих (600 відвідувань на день) та дітей (350 відвідувань на день).
В клініці функціонує 40 структурних підрозділів: 8 клінічних лабораторій, 10 амбулаторно-поліклінічних та 22 допоміжних відділень.
За 21 рік існування в умовах стаціонару медичну допомогу отримали 104228 пацієнтів, близько 94 % з них виписано з загальним покращенням стану здоров’я.
В поліклініці обстеження пройшли – 174205 пацієнтів (дорослих – 124183 та 50445 дітей).
Впроваджено 301 нових методів діагностики та лікування.
НЦРМ проводить щорічне спостереження за станом здоров'я 4,5 тисяч дітей Народицького району Житомирської обл. (4,5 тис. в 1987 р., та близько 2 тис. у 2005 р.)
Найпотужніший в Україні Київський центр трансплантації кісткового мозку працює на базі НЦРМ з 2001 року. Підрозділи НЦРМ надають весь комплекс лабораторно-діагностичного спроводу: типування донорів, визначення вмісту стовбурових клітин, молекулярно-біологічна діагностика мутацій, контроль за станом реципієнтів і т.д. Лабораторна служба сертифікована не тільки в Україні (УкрЦСМ), але й на міжнародному, коли в 2003 р. центр трансплантації кісткового мозку прийняли до Європейського товариства по трансплантації кісткового мозку (ЕВМТ).
Виконано 147 трансплантацій кісткового мозку та стовбурових клітин хворим на множинну мієлому, хворобу Ходжкіна, нефробластому, рак яєчка, гострі лейкемії та інші злоякісні захворювання.
В зв’язку з обмеженістю фінансування Київською міською державною адміністрацією потужності з трансплантації використовуються лише на 30% при тому, що потреба постраждалих на інших верств становить понад 100 трансплантацій на рік.
НЦРМ проводить широке наукове міжнародне співробітництво з питань, пов’язаних з впливом наслідків аварії на Чорнобильській АЕС. Наукові дослідження здійснюються у рамках програм ВООЗ, МАГАТЕ, Комісії Європейських Співтовариств, співпраці з науково-дослідними установами США, Японії, Німеччини, Італії, Франції та інших країн [1].
Мiнiстерство освiти і науки, молоді та спорту України
Національний авіаційний університет
Інститут Екологічної Безпеки
кафедра біотехнології
Індивідуальне завдання
з технологічної практики
на тему:
«Методи збагачення та очищення гемопоетичних стовбурових клітин»
студента 4 курсу 405 групи
спеціальності 6.051401«Біотехнологія»
Панаса Ігоря Данковича
База практики: Науковий центр радіаційної медицини АМН України
Керівник практики:
від університету ас. Нестер Т.І.
від бази практики д.б.н., проф. Мінченко Ж.М.
Київ 2011
ЗМІСТ
| ВСТУП.................................................................................................................. 1. Особливості одержання ГСК із різних джерел та використання їх у аутологічних трансплантаціях............ 2. Виділення стовбурових клітин за допомогою процедури аферезу.................................................................................... 3. Виділення стовбурових клітин за допомогою системи магнетично-активованого клітинного сортування MACS........................................................................................ ВИСНОВКИ......................................................................................................... СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ..................................................... |
ВСТУП
Збагачення та очистка гемопоетичних стовбурових клітин (ГСК) являються одними із найважливіших етапів під час проведення аутологічних трансплантацій. Трансплантації стовбурових клітин, основним чином, необхідні для відновлення стану імунної системи на основі стимуляції своїх потенціальних можливостей, що є запорукою мінімізації ризику реалізації інших захворювань, патогенетичним субстратом яких є імунний гомеостаз. У випадках онкогематологічних захворювань, застосування аутологічних або гістосумісних алотрансплантатів часто є єдиним шансом на життя.
Отримані очищені фракції гемопоетичних стовбурових клітин вважаються лікувальними препаратами біологічного походження. Такі препарати мають ряд переваг перед синтетичними аналогами, що пояснюється високим ступенем спорідненості до організму людини.
З того часу, коли вперше було проведено трансплантації гемопоетичних стовбурових клітин Ж.Мате і Е.Томасом (1965-1968 рр.), за що останній у 1990 році отримав Нобелевську премію, трансплантація ГСК із допоміжного метода лікування гемопоетичної недостатності, метода другого етапу, стала основним методом лікування багатьох раніше невиліковних захворювань. Розрахунки, які були проведені на конгресі Європейської спільноти трансплантації кісткового мозку ще у 2002 році показали, що трансплантації у розвинутих країнах Європи проводять з частотою 1 на 40 – 50 тис. населення, при цьому майже половина усіх процедур відбувається у підлітків і дітей за рахунок більш розширених показань, ніж у дорослих. Сьогоденне поширене застосування трансплантації кісткового мозку (ТКМ) та стовбурових клітин периферичної крові (ТСКПК) при лікуванні гематологічних, онкологічних, спадкових та імунологічних захворювань, що загрожують життю пацієнта, є кульмінацією більш ніж чотирьох декад випробувань великої кількості дослідників різних країн світу.
1. Особливості одержання ГСК із різних джерел та використання їх у аутологічних трансплантаціях
Незважаючи на те, що гемопоетичні стовбурові клітини (ГСК) є складовою більшості відомих біологічних субстратів, для клінічного застосування можна використовувати лише клітини кісткового мозку, периферичної крові (ПК), плацентарної (пуповинної) крові та мезенхимальні клітини.
Вимогами до кожного субстрату є отримання такої кількості клітин, яка може забезпечити в досить короткий термін (протягом 2 – 4 тижнів) повне і стійке відновлення гемопоезу і функцій імунітету. При цьому клітини повинні мати певні морфофункціональні та імуногенетичні властивості, незалежно від того, з яких джерел вони були отримані.
Експериментально встановлений факт циркуляції стовбурових кровотворних клітин у периферичній крові дозволив розглядати цю тканину як самостійне джерело кровотворних клітин. Периферична кровдорослої людини містить лише невелику кількість стовбурових клітин (близько 0,1%), однак, при інтенсивній стимуляції ростовими факторами їх вміст підвищується до 1-2%. При обробці 2-4 об’ємів циркулюючої крові можна зібрати достатню для трансплантації кількість ГСК.
Найбільша кількість розробок щодо вивчення альтернативних джерел стовбурових CD34+ клітин відноситься до пуповинної крові (ПП).
Використання пуповинної крові як джерела стовбурових клітин має ряд суттєвих переваг перед традиційними джерелами. Перш за все, встановлено, що кордова кров містить високий рівень гемопоетичних стовбурових клітин у порівнянні з вмістом їх у кістковому мозку [2-4].
Процедура збору пуповинної крові є технічно простою, вона безболісна, не потребує анестезії для матері або дитини. Ризик передачі інфекційних захворювань від донора до реципієнта невеликий за рахунок зниженої можливості контамінації неонатального матеріалу вірусами, а також достатнього часу для проведення перевірки матеріалу. Безперечною перевагою пуповинної крові є її доступність. Вона збирається під час пологів і може бути використана в будь-який момент, що потребує значно менших затрат часу для пошуку необхідного HLA-сумісного трансплантата. Можливість довгострокового зберігання біоматеріалу обумовлює перспективність розробки банків пуповинної крові для подальшого застосування у трансплантації.
Колекція пуповинної крові проводиться одразу після народження дитини шляхом пункції вени пуповини після того, як вона була перерізана. Це можна зробити, коли плацента ще знаходиться в матці або після її відокремлення. Об’єм пуповинної крові залежить від часу перерізування пуповини, від маси тіла новонародженого, терміну вагітності, довжини пуповини і може сягати 200 мл. Вгохmеуег та співавтори показали також, що кріообробка пуповинної крові не спричиняє суттєвих втрат ГСК і розрахували, що у дітей можна виконувати алогенні трансплантації ГСК із використанням пуповинної крові. В 1988 році за їх ініціативою в Парижі була виконана перша трансплантація з використанням пуповинної крові. За зведеними даними координаційних центрів трансплантації гемопоетичних клітин периферичної крові за період до 2000 року було проведено близько 1200 трансплантацій пуповинної крові. [5]
Обрання основного джерела ГСК для проведення конкретної трансплантації залежить від характеру основного захворювання та його стадії, клінічного протоколу, наявності клінічних протипоказань, надання переваги певному виду донорства. Для обрання донора має також значення вага донора і реципієнта. Наприклад, ексфузія стовбурових гемопоетичних клітин периферичної крові має переваги перед пуповинною кров’ю для реципієнта, який має велику вагу. Коли дитина мала, то певні переваги має трансплантація клітин КК.
Загальна тенденція останніх років це перехід на трансплантацію ГСК периферичної крові, особливо це торкається аутологічних трансплантацій. При алогенних трансплантаціях, відповідно до міжнародних реєстрів кістковий мозок і периферична кров використовується приблизно у різних пропорціях .
Не менш перспективним є використання кордової крові (КК), як джерела стовбурових гемопоетичних клітин, як для аутологічних, так і для алогенних трансплантацій [6].За зведеними даними координаційних центрів по трансплантації ГСК КК на протязі 2006 року було проведено близько 1400 трансплантацій.
Необхідно додати, що в наш час активно ведеться пошук оптимальних методів виділення клітин-попередників, а також розробки культуральних систем для підтримки і накопичення клітин-попередників кордової крові в довгостроковій культурі in vitro з збереженням високої функціональної активності цих популяцій клітин. Вирішення цих питань буде сприяти спрощенню використання кордової крові як біотрансплантанта, надаючи їй великі переваги над іншими джерелами.
Істотні відмінності між джерелами гемопоетичної тканини - ПК і КК, зумовлюють необхідність розвитку ефективних методів підготовки і сепарації ГСК у кожному окремому випадку.
2. Виділення стовбурових клітин за допомогою процедури аферезу
Отримання стовбурових клітин може відбуватися як із кісткового мозку, так і з периферичної системи кровообігу. Для отримання клітин з периферичної кровоносної системи людини часто застосовують процедуру аферезу.
Аферез (від гр. – відбирання) – це метод отримання окремих фракцій крові шляхом її сепарації на спеціальній центрифузі. Принцип роботи аферезної системи базується різниці густини клітин та швидкості їх осадження за рахунок різних розмірів. Дана методика передбачає використання особливої центрифуги (рис.1), яка дозволяє в процесі своєї безперервної роботи відбирати необхідні шари плазми і клітинної маси.
Розрізняють декілька різновидів аферезу:
- плазмаферез – виділення плазми крові та повернення еритроцитів;
- тромбоферез – виділення тромбоцитів з невеликою кількістю плазми та повернення крові з еритроцитами пацієнту;
- цитаферез (лейкоферез) – виділення клітинних компонентів крові з метою їх модифікації та повернення пацієнту.
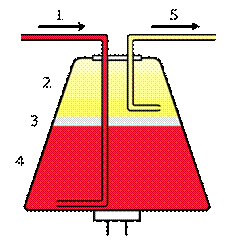
Рис. 1. Принципова схема аферезного апарату безперервного току:
1. Вхід цільної крові від донора/пацієнта; 2. Шар плазми крові;
3. Шар лейкоцитів; 4. Шар еритроцитарної маси;
5. Відбір необхідної фракції.
Для одержання гемопоетичних стовбурових клітин, проведення аферезу супроводжується підключенням пацієнта до аферезного апарату, який відбирає його венозну кров та виділяє з її складу лекоцитарну фракцію (лейкоконцентрат). Об’єм крові, з якого вилучили цільову фракцію повертається в кровоносну систему донора. Задля накопичення достатньої кількості трансплантату часто призначають повторні сеанси аферезу.
Для ефективної аутотрансплантації кровотворних кліитин необхідно більше 2106 CD34+ клітин на кг ваги пацієнта. Перед виділенням СКПК необхідно мобілізувати їх із кісткового мозку, що досягаються стимуляцією гранулоцит-колонієутворюючим фактором (G-CSF). Дана процедура дозволяє зібрати мононуклеари периферичної крові із вмістом стовбурових клітин (CD34+) до 0,1 – 1%. Об’єм крові, що проходить через сепаратор значно залежить від пацієнта та процедур стимуляції та сепарації. Зазвичай використовують методику великого об’єму лейкоферезу із обробкою від 4 до 6 об’ємів циркулюючої крові, що відповідає 10 – 15 л та 2 – 6 год. Після аферезу клітини можуть бути розділені на більш чисті фракції за допомогою методів магнітної сепарації або проточного флуоресцентного сортування.

Рис. 2. Аферезна система Сobe-Spectra (Gambro BCT).
Аферезні системи Сobe-Spectra (Gambro BCT) (рис. 2) спеціалізовані для виділення окремих фракцій клітин. Збагачення стовбурових клітин із периферичної крові проводиться в два етапи у повністю автоматизованому режимі: перший – відділення еритроцитів та лейкоцитів від плазми з тромбоцитами і накопичення мононуклеарів в окремій зоні камери, другий – продавлювання мононуклеарів плазмою в контейнер-збірник [7].
Перевагою аферезу є те, що ця процедура – нетравматична і безпечна, навіть для дуже маленьких дітей .
3. Виділення стовбурових клітин за допомогою системи магнетично-активованого клітинного сортування MACS
Технологія MACS дозволяє швидко та легко виділяти необхідні типи клітин за допомогою спеціального комплексу, що складається із колоїдної суспензії нетоксичних біодеградуючих суперпарамагнітних часток, приєднаних до високоафінних моноклональних антитіл MACS MicroBeads; колонок MACS Columns, в яких відбувається розділення клітин за допомогою магнітного сепаратора MACS Separators.
Суть методу полягає у розділенні суміші клітин на фракції у магнітному полі за допомогою використання імуномагнітної мітки, специфічної для цільових клітин. Для позитивної селекції клітин, що несуть на своїй поверхні антиген CD34, до клітинної суміші додається маркер – анти-CD34 антитіло, що з’єднано з магнітною часткою. Антитіло з’єднується з антигеном надаючи, таким чином, CD34 клітині магнітного маркеру. При здійсненні процедури сепарації клітинна суміш проходить крізь колонку, розміщену у високоградієнтному магнітному полі сепаратора (рис. 3). Мічені клітини затримуються в цій колонці, немічені – проходять крізь неї без затримки, що сприяє сепарації клітинної суміші. Демагнітизація колонки вивільняє клітини окремою цільвої фракції.

Рис.3. Клітинний сепаратор MidiMACS
При проведенні CD34 позитивної селекції для здійснення аутологічної трансплантації СГК метод дозволяє досягти чистоти фракції CD34 клітин до 95,7% зі збереженням загальної кількості CD34 клітин у 69,5% від вихідного [8].
Магнетично-активоване сортування клітин складається із наступних стадій:
 1. Магнітне маркування. Клітини, які потребують подальшого виділення з’єднуються із антиген-специфічними частинками MACS MicroBeads (рис. 4 а).
1. Магнітне маркування. Клітини, які потребують подальшого виділення з’єднуються із антиген-специфічними частинками MACS MicroBeads (рис. 4 а).
2. Магнітна сепарація. Клітини розділяються на колонці, розміщеній в постійному магнітному полі сепаратора, таким чином, що мічені клітини залишаються на колонці. Решта клітин вільно проходить через колонку сепаратора (рис. 4 б).
3. Елюція магнето-активованої фракції клітин. Колонка демагнетизується та промивається відповідним буферним розчином. Елюат містить цільову фракцію клітин (рис. 4 в).
Рис. 4. Принципова схема магнетично-активованого сортування клітин.
Висновки
1. Обрання способу збагачення ГСК для проведення конкретної трансплантації основним чином залежить від джерела їх отримання та його кількості. Універсального методу на сьогоднішній день не існує, тому така ситуація вимагає ґрунтовного аналізу умов трансплантації (характеру основного захворювання та його стадії, клінічного протоколу, наявності клінічних протипоказань, надання переваги певному виду донорства) та переваг і недоліків кожного методу.
2. У разі обрання периферичної крові як джерела ГСК рекомендується застосовувати комбіновану стратегію отримання цільової фракції. Етапом попереднього концентрування доцільно обрати метод лейкоферезу (цитоферезу), а заключною стадією рекомендовано обрати метод магнетично-активованого сортування клітин за допомогою системи MACS.
3. У разі обрання кордової крові як основного джерела ГСК, беручи до уваги невеликі об’єми вихідного матеріалу (близько 200 мл), рекомендується застосовувати обрати метод магнетично-активованого сортування клітин за допомогою системи MACS.
4. Для одержання ГСК із кісткового мозку рекомендовано проводити попереднє очищення методом центрифугування в градієнті щільності та подальшу селекцію за допомогою магнетично-активованого сортування.
Список використаної літератури
1. Національна академія медичних наук України: Державна установа «Науковий центр радіаційної медицини».[Електронний ресурс].Режим доступу:
http://www.amnu.gov.ua/Default.asp?T=1&MID=1&JID=128&NID=165
2. Абдулкадыров К.М., Романенко Н.А. Плацентарная кровь: альтернативный источник кроветворних стволових клеток для трасплантаций. Создание банков пуповинной крови// Тер. Архив.-2001-Т.73, №7.-С.76-78
3. Ikuta K. Cord blod stem cell transplantation and cord blod bank // Nippon Rinsho.-1998.-Vol. 56, № 2.- P.521-530.
4. Получение и клиническое применение периферических гемопоетических стволовых клеток из пуповинной крови/ К.М. Абдулкадыров, Н.А.Романенко, Н.Н. Старков// Вопросы онкологии.-2000.-Т.46.-№5.-С.513-518.
5. Apperley J. F, Gluckman E, Gratwohl A. Blood and Marrow Transplantation – EBMT, 2000.- 256 p.
6. Mc Cullough J. Clay M.E. at al. Proposet policies and procedures for the establishment of a cord blood bank// blood Cells. 1994; 20: 609-629.
7. Выделение стволовых клеток из периферической крови путем афереза. [Електронний ресурс].Режим доступу:
http://www.ld.ru/catalog/rts/stemcells/apheresis.html
8. MACS Separators for magnetic cell separation. [Електронний ресурс].Режим доступу:
http://www.miltenyibiotec.com/download/flyer_en/905/MACS_Separators_flyer.pdf