Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксил-ионы.
Квантово-механическая модель Бора атома Н. Квантовые числа. Понятие об электронной орбитали.
В настоящий момент существуют две модели атома: модель Бора (классическая) и квантово-механическая. Первая модель не подходит для описания атомов со сложной структурой. Вторая модель описывает любую структуру атома.
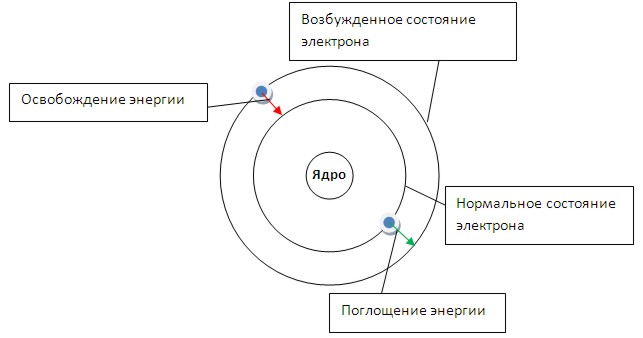
Электроны в атоме движутся по определенным (стационарным) электронным орбитам вокруг ядра атома. Каждая такая орбита для электрона получила название энергетический уровень. При переходе электрона с одной орбиты на другую электроны выделяют или поглощают энергию.
Энергия электрона зависит от радиуса его орбиты. Минимальная энергия у электрона, который находится на ближайшей к ядру орбите. При поглощении кванта энергии электрон переходит на орбиту с более высокой энергией (возбужденное состояние). И наоборот, при переходе с высокого энергетического уровня на более низкий - электрон отдает (излучает) квант энергии. Пример строения атома водорода по Бору.
Понятие об электронной орбитали и квантовые числа
Электронные облака – области пребывания электрона вокруг ядра атома.
Электронная орбиталь – область пространства вокруг ядра атома с наибольшей вероятностью пребывания электрона (наибольшая плотность- 90%).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
| Квантовое число | Символ | Описание | Значения |
| Главное | n | Энергетический уровень орбитали | Положительные целые числа: 1, 2, 3... |
| Орбитальное | l | Форма орбитали | Целые числа от 0 до n-1 |
| Квантовое | m | Ориентация | Целые числа от -l до +l |
| Спиновое | ms | Спин электрона | +½ и -½ |
Главное квантовое число n
Описывает:среднее расстояние от орбитали до ядра;энергетическое состояние электрона в атоме.
Чем больше значение n, тем выше энергия электрона и больше размер электронного облака.
| Значение l определяет форму орбитали, а n - ее размер |
Кислоты, основания, соли в свете ТЭД. Ступенчатая диссоциация.
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Например:
HCl = H++ Cl-; CH3COOH = H++ CH3COO-
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO3, - одноосновные кислоты – образуется один катион водорода; H2S,H2SO4– двухосновные, а H3PO4– трехосновные, так как образуются соответственно два и три катиона водорода.
Двух- и многоосновные кислоты диссоциируют ступенчато (постепенно). Например:
H3PO4=H++H2PO4-(первая ступень)
H2PO4-=H++HPO42-(вторая ступень)
HPO42-=H++PO43-(третья ступень)
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксил-ионы.
Например:
KOH=K++OH-;NH4OH=NH4++OH-
Основания, растворимые в воде, называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов:
LiOH, NaOH, KOH, RbOHи т.д.
Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NH4OH– однокислотное основание, Ca(OH)2– двухкислотное основание, Fe(OH)3– трехкислотное основание и т.д. Двух- и многокислотные основания диссоциируют ступенчато:
Ca(OH)2 =Ca(OH)++OH- (первая ступень)
Ca(OH)+=Ca2++OH-(вторая ступень)
Солями называются электролиты, при диссоциации которых образуются катионы металлов (а также катиона аммония NH4+) и анионы кислотных остатков.
Например:
(NH4)2SO4= 2NH4++ SO42-; Na3PO4 = 3Na++ PO43-
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато.
KHSO4= K++ HSO4-
HSO4-= H++ SO42-
Mg(OH)Cl = Mg(OH)++ Cl-
Mg(OH)+= Mg2++ OH-