Кислотно-основные свойства аминокислот
Стереохимия аминокислот.
Природные аминокислоты являютcя 2-аминокарбоновыми кислотами (или -аминокислотами). У -aминoкиcлoт при атоме C-2 (C) имеются четыре различных зaмecтитeля: каpбокcильнaя группа, аминогруппа, атом водорода и боковая цепь R. Таким образом, все -аминокислоты, кроме глицина, имеют асимметрический (хиральный) -углеродный атом и cущeствуют в виде двух энантиомеров(L- и D-aминoкиcлoт). Пpотeиногенныe аминoкиcлoты oтноcятcя к L-ряду.D-Аминoкиcлоты вcтpeчaютcя в бaктepиях, например в сocтaвe муреинов, и в пептидных антибиотиках:
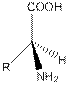
| 
|

| 
|
| L-аминокислота | D-аминокислота |
Кислотно-основные свойства аминокислот
Все аминокислоты являются амфотерными соединениями. Они содержат по крайней мере две противоположные по свойствам группы: кислотную (карбоксильную) и основную (аминогруппу). Обе группы являются слабоионизируемыми и в растворе существуют в двух формах, заряженной и незаряженной, между которыми устанавливается протонное равновесие:

Суммарный заряд аминокислоты зависит от рН среды. В растворе аминокислоты ВСЕГДА заряжены. Незаряженные формы используются для удобства при написании формул.
Значение pH, при котором суммарный заряд аминокислоты равен нулю и поэтому она не перемещается в электрическом поле, называется ее изоэлектрической точкой (pI). Этот показатель зависит от характера функциональных групп, входящих в состав аминокислоты:

| ||||||

| ||||||

| ||||||

| ||||||

| ||||||

| ||||||
| ГЕНЕТИЧЕСКИ КОДИРУЕМЫЕ АМИНОКИСЛОТЫ | ||||||
| Строение R | Название | pKa | ||||

| 
| ионогенных групп | ||||
| С гидрофобным неполярным радикалом (нейтральные) | ||||||

| Глицин | Gly | 2,3 | 9,6 | - | |

| Аланин | Ala | 2,3 | 9,7 | - | |

| ВалинНЗ | Val | 2,3 | 9,6 | - | |

| ЛейцинНЗ | Leu | 2,4 | 9,6 | - | |

| ИзолейцинНЗ | Ile | 2,4 | 9,7 | - | |

| МетионинНЗ | Met | 2,3 | 9,2 | - | |

| ФенилаланинНЗ | Phe | 1,8 | 9,1 | - | |

| ТриптофанНЗ | Trp | 2,4 | 9,4 | - | |

| Пролин | Pro | 2,0 | 10,6 | - | |
| С гидрофильным полярным незаряженным радикалом (нейтральные) | ||||||

| Серин | Ser | 2,2 | 9,2 | - | |

| ТреонинНЗ | Thr | 2,6 | 10,4 | - | |

| Аспарагин | Asn | 2,0 | 8,8 | - | |

| Глутамин | Gln | 2,2 | 9,1 | - | |
| С гидрофильным отрицательно заряженным радикалом (кислые) | ||||||

| Аспарагиновая кислота | Asp | 2,1 | 9,8 | 3,9 | |

| Глутаминовая кислота | Glu | 2,2 | 9,7 | 4,3 | |

| ТирозинУЗ | Tyr | 2,2 | 9,1 | 10,1 | |

| ЦистеинУЗ | Cys | 1,7 | 10,8 | 8,3 | |
| С гидрофильным положительно заряженным радикалом (основные) | ||||||

| ЛизинНЗ | Lys | 2,2 | 9,0 | 10,45 | |

| АргининЧЗ | Arg | 2,2 | 9,0 | 12,5 | |

| ГистидинЧЗ | His | 1,8 | 9,2 | 6,0 | |
| НЗ – незаменимые, УЗ – условно заменимые, ЧЗ – частично заменимые | ||||||
ПЕПТИДЫ, БЕЛКИ
Пептиды и белки – высокомолекулярные соединения, построенные из остатков -аминокислот. Условно пептидами считают соединения, содержащие до 100, а белками – свыше 100 аминокислотных остатков. Среди пептидов, в свою очередь, различают олигопептиды (до 10 остатков аминокислот) и полипептиды (от 10 до 100 остатков).
Белки и пептиды, хотя и являются родственными соединениями, выполняют различные функции в организме.
| Биологические функции белков: ü структурообразующие белки ü транспортные белки ü защитные белки иммунной системы ü регуляторные белки (гормоны) ü белки-катализаторы (ферменты) ü двигательные белки (мышцы) ü запасные белки (у растений) | Биологические функции пептидов: ü нейропептиды ü пептидные гормоны ü пептидные токсины ü пептидные антибиотики |