Сырьевая база азотной промышленности
Технология азота
Газообразный азот представляет собой одно из самых устойчивых химических веществ. Энергия связи в молекуле азота составляет 945 кДж/моль. В атмосфере азот находится в свободном состоянии в огромных количествах. Подсчитано, что над 1га поверхности Земли имеется почти 80 тыс. т азота. Элементный азот в клубеньках некоторых растений вступает в реакции с образованием аминокислот и белков. Эти реакции катализируют ферменты, а необходимую энергию обеспечивает фотосинтез.
Некоторое количество азота переходит в биологически усваиваемую форму в результате грозовых разрядов по реакции
N2+02 2NO.
Большинство организмов легче усваивают соединения азота со степенью окисления -3. Это -аминокислоты и их полимеры — белки, которые играют важнейшую роль в биохимии. Однако скорость перевода в состояние окисления -3 в естественных процессах слишком мала для поддержания требуемого количества связанного азота при современных темпах его потребления.
В среднем половина необходимого для жизни азота возвращается через атмосферу за 108 лет. Для кислорода этот период составляет 3000 лет, для углерода — 100 лет. Эти цифры убедительно показывают необходимость синтеза азотсодержащих соединений для использования их живыми организмами.
Потребителями азотных соединений издавна являлись фармация, военное дело, промышленность, а с начала XIX в. и сельское хозяйство.
Источников связанного азота в природе, имеющих промышленное значение, очень мало. Крупные месторождения – в Чили и ЮАР.
Решением проблемы связанного азота явилась реакция синтеза аммиака, промышленное осуществление которой позволило создать мощную сырьевую базу для получения самых разнообразных азотсодержащих соединений. Меньшее количество азота связывается в дуговом и цианамидном методах.
Дуговой метод – взаимодействие азота с кислородом при высокой температуре по действием электрической дуги с образованием NO, который затем окисляется до NO2. В дальнейшем NO2 поглощается водой с образованием азотной кислоты. Недостатки – малый выход NO и громадный расход электроэнергии.
Цианамидный метод – взаимодействие тонкоизмельченного карбида кальция с азотом при температуре около 1000ºС по уравнению
CaC2 + N2 CaCN2 + C + 301,5 кДж
Сырьевая база азотной промышленности
Сырьем для получения продуктов в азотной промышленности являются атмосферный воздух и различные виды топлива. Одной из составных частей воздуха является азот, который используется в процессах получения аммиака, цианамида кальция и других продуктов азотной технологии. В некоторых схемах синтеза аммиака не требуется выделять азот из воздуха в чистом виде: воздух дозируют в газовую смесь для достижения стехиометрического соотношения N2: Н2 = 1 : 3. В других схемах используют и чистый жидкий азот для тонкой очистки синтез-газа от вредных примесей, и газообразный, вводя его в строго корректируемом соотношении в конвертированный газ. В последнем случае воздух подвергают разделению методом глубокого охлаждения.
Поскольку ресурсы атмосферного азота огромны, сырьевая база азотной промышленности в основном определяется вторым видом сырья — топливом, применяемым для получения водорода или водород-содержащего газа. До 50-х годов XX в. заводы нашей страны использовали в качестве сырья в основном твердое топливо, в настоящее время примерно 90% аммиака получают из природного газа. В значительно меньшей степени используют попутные газы, коксовый газ, а также жидкое топливо — нафту.
Вместе с тем дальнейшее развитие экономики, рост ее энерговооруженности требуют увеличения добычи горючих ископаемых, в первую очередь нефти и газа. По мере истощения мировых запасов газа и нефти, а также изменения цен на эти виды сырья все большее значение будет приобретать каменный уголь, запасы которого значительно превышают запасы нефти.
В настоящее время водород для синтеза аммиака получают 4-мя способами:
1) конверсия метана природного газа или его гомологов с последующей конверсией CO:
CH4 + H2O CO + 3H2
CH4 + 0,5O2 CO + 2H2
CO + H2O CO2 + H2
2) конверсия CO, полученного газификацией твердого или жидкого топлива
CO + H2O CO2 + H2
3) разделение коксового газа последовательным сжижением всех его компонентов кроме водорода;
4) электролиз воды или раствора хлорида натрия.
Каталитический процесс производства аммиака предъявляет строгие требования к чистоте поступающего на катализаторы газа, поэтому водород и кислород должны быть максимально очищены от серосодержащих и кислородсодержащих соединений. Катализаторы конверсии метана и СО также чувствительны к примесям серосодержащих соединений.
Теоретические основы процесса.Синтез аммиака из элементов идет без образования побочных продуктов по уравнению
N2 + 3H2 2NH3, Н < 0.
Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (Н298 = -91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (Н725= 112,86 кДж/моль). Согласно принципу Ле-Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае тоже отрицательно [S 298= -198,13 кДж/(моль • К)] и не благоприятствует протеканию реакции. Для смещения равновесия в сторону образования аммиака следует повышать давление.
Итак, качественная и количественная оценки условий термодинамического равновесия позволяют сделать вывод, что максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низких температурах. Однако даже при очень высоких температурах (выше 1000 °С) процесс синтеза в гомогенной газовой фазе практически неосуществим.
Синтез аммиака протекает с заметной скоростью только в присутствии катализатора, причем катализаторами данной реакции служат твердые вещества. Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм, который может быть описан следующими стадиями:
1) диффузия молекул азота и водорода к поверхности катализатора;
2) хемосорбция молекул реагентов (адсорбатов) на поверхности катализатора;
3) поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействие между ними;
4) десорбция продукта;
5) диффузия продукта реакции (аммиака) от поверхности катализатора в газовую фазу.
Исследование кинетики и механизма реакции синтеза позволило сделать вывод, что лимитирующей стадией процесса является хемосорбция азота.
В качестве катализаторов синтеза аммиака испытывались многие соединения, однако в промышленности наибольшее применение нашли железные катализаторы, получаемы сплавлением оксидов железа с промоторами (Al2O3, TiO2, оксиды щелочных и щелочно-земельных металлов и др.) и последующим восстановлением оксидов железа водородом. Катализаторы синтеза аммиака необратимо отравляются сернистыми соединениями и хлором и обратимо – кислородсодержащими соединениями.
Поскольку реакция синтеза аммиака обратима, полного превращения азота и водорода в аммиак за время их однократного прохождения через аппарат не происходит. Условия равновесия и кинетика процесса на железных катализаторах обусловливают возможность превращения в аммиак только 20-40 % исходной смеси. Более полное использование реагентов достигается за счет многократной циркуляции через колонну синтеза. Чтобы выделить аммиак из азотоводородной смеси, ее охлаждают до температуры сжижения аммиака.
Технологические процессы синтеза аммиака можно разделить на 3 группы: низкого (10-16 МПа), среднего (20-50 МПа) и высокого (80-100 МПа) давлений.
Раньше процесс низкого давления проводили при 10 МПа и 400 ºС. При этом получали 8-13 % аммиака. В настоящее время схемы синтеза аммиака при низком давлении являются перспективными в плане снижения энергозатрат.
Установки высокого давления широко применялись в 30-40-е годы 20-го века. Давление – 90-100 МПа, что позволяло получить высокую степень превращения смеси в аммиак (40 %). Сейчас такие системы уже не строятся.
Наибольшее распространение получили установки среднего давления. В современных агрегатах процесс ведут при температурах 420-500 ºС, давлении 25-32 МПа на плавленых железных катализаторах.
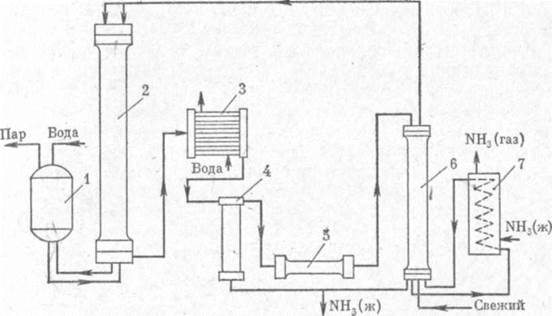 |
Рис. 1. Схема установки для синтеза аммиака под средним давлением:
1 — паровой котел; 2 — колонна синтеза; 3 — водяной холодильник; 4 — сепаратор; 5 — турбоцнркуляцнонный компрессор; 6' — конденсационная колонна; 7 — испаритель.