Адениновые нуклеотиды и креатинфосфат
Тема 15.
Лекция 22. Биохимия нервной ткани
Химический состав нервной ткани. Энергетический обмен в нервной ткани.
Биохимия возникновения и проведение нервного импульса. Медиаторы: ацетилхолин, катехоламины, серотонин, гамма-аминомасляная кислота, глутаминовая кислота, глицин, гистамин.
Нарушение обмена биогенных аминов при психических заболеваниях. Физиологически активные пептиды мозга: эндорфины и энкефалины.
| Краткое содержание | Конспект | |||||||||||||||||
| 1. Химический состав нервной ткани. Энергетический обмен в нервной ткани | ||||||||||||||||||
Нервная ткань состоит из трех клеточных элементов: нейронов (нервные клетки); нейроглии – системы клеток, непосредственно окружающих нервные клетки в головном и спинном мозге; мезенхимных элементов, включающих микроглию – глиальные макрофаги (клетки Ортеги).
Основная масса головного мозга представлена первыми двумя типами клеточных элементов. Нейроны сосредоточены в сером веществе (60–65% от вещества головного мозга), тогда как белое вещество ЦНС и периферические нервы состоят главным образом из элементов нейроглии и их производного – миелина.
Нервные волокна, образующиеся из аксонов нервных клеток, по своему строению могут быть разделены на 2 типа: миелиновые (мякотные) и безмиелиновые (бедные миелином).
По химическому составу миелиновое вещество является сложным белково-липидным комплексом. На долю липидов приходится до 80% плотного осадка; 90% всех липидов миелина представлено холестерином, фосфолипидами и цереброзидами.
Химический состав серого и белого вещества головного мозга человека (в процентах от массы сырой ткани)
|
Белки
На долю белков приходится примерно 40% от сухой массы головного мозга. В настоящее время обнаруживается около 100 различных растворимых белковых фракций. В нервной ткани содержатся как простые, так и сложные белки. Простые белки – это альбумины (нейроальбумины), глобулины (нейроглобулины), катионные белки (гистоны и др.) и опорные белки (нейросклеропротеины). Количество нейроглобулинов в головноммозге относительно велико – в среднем 5% по отношению ко всем растворимым белкам. Нейроальбумины являются основным белковым компонентом фосфопротеинов нервной ткани, на их долю приходится основная масса растворимых белков (89–90%).
Нейросклеропротеиныможно охарактеризовать как структурно-опорные белки. Основные представители этих белков – нейроколлагены, нейроэластины, нейростромины и др. Они составляют примерно 8–10% от общего количества простых белков нервной ткани и локализованы в основном в белом веществе головного мозга и в периферической нервной системе.
Сложные белки нервной ткани представлены нуклеопротеинами, липопротеинами, протеолипидами, фосфопротеинами, гликопротеинами и т.д. В мозговой ткани содержатся в значительном количестве еще более сложные надмолекулярные образования, такие, как липонуклеопротеины, липогликопротеины и, возможно, липогликонуклеопротеиновые комплексы.
В нервной ткани обнаружен ряд специфических белков, в частности белок S-100 и белок 14-3-2. Белок S-100, или белок Мура, называют также кислым белком, так как он содержит большое количество остатков глутаминовой и аспарагиновой кислот. Этот белок сосредоточен в основном в нейроглии (85-90%), в нейронах его не более 10-15% от общего количества белка в головном мозге. Установлено, что концентрация белка S-100 возрастает при обучении (тренировках) животных. Белок 14-3-2 также относится к кислым белкам. В отличие от белка S-100 он локализован в основном в нейронах.
Ферменты
В мозговой ткани содержится большое количество ферментов, катализирующих обмен углеводов, липидов и белков. До сих пор в кристаллическом виде из ЦНС млекопитающих выделены лишь некоторые ферменты, в частности ацетилхолинэстераза и креатинкиназа. Значительное количество ферментов в мозговой ткани находится в нескольких молекулярных формах (изоферменты): ЛДГ, альдолаза, креатинкиназа, гексокиназа, малатдегидрогеназа, глутаматдегидрогеназа, холинэстераза, кислая фосфатаза, моноаминоксидаза и др.
Липиды
В группу липидов головного мозга входят фосфоглицериды, холестерин, сфингомиелины, цереброзиды, ганглиозиды и очень небольшое количество нейтрального жира.
Углеводы
В мозговой ткани имеются гликоген и глюкоза, но по сравнению с другими тканями ткань мозга бедна углеводами. Общее содержание глюкозы в головном мозге разных животных составляет в среднем 1–4 мкмоль на 1 г ткани, а гликогена – 2,5–4,5 мкмоль на 1 г ткани.
В мозговой ткани имеются также промежуточные продукты обмена углеводов: гексозо- и триозофосфаты, молочная, пировиноградная и другие кислоты.
Адениновые нуклеотиды и креатинфосфат
В мозговой ткани на долю адениновых нуклеотидов приходится около 84% от всех свободных нуклеотидов. Большую часть оставшихся нуклеотидов составляют производные гуанина. В целом количество высокоэргических соединений в нервной ткани невелико.
Минеральные вещества
Ионы Na+, K+, Cu2+, Fe3+, Ca2+, Mg2+ и Мn2+ распределены в головном мозге относительно равномерно в сером и белом веществе.
Дыхание
На долю головного мозга приходится 2–3% от массы тела. В то же время потребление кислорода головным мозгом в состоянии физического покоя достигает 20–25% от общего потребления его всем организмом, а у детей в возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемого всем организмом.
О размерах потребления головным мозгом из крови различных веществ, в том числе кислорода, можно судить по артериовенозной разнице. Установлено, что во время прохождения через мозг кровь теряет около 8 об.% кислорода. В 1 мин на 100 г мозговой ткани приходится 53–54 мл крови.
Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а весь головной мозг (1500 г) – 55,5 мл кислорода. Газообмен мозга значительно выше, чем газообмен других тканей, в частности он превышает газообмен мышечной ткани почти в 20 раз. Интенсивность дыхания белого вещества в 2 раза ниже, чем серого.
Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. За 1 мин тканью мозга окисляется 75 мг глюкозы. Следовательно, количество глюкозы, имеющееся в ткани головного мозга, могло бы быть достаточным лишь на 10 мин жизни человека. Наряду с аэробным метаболизмом углеводов мозговая ткань способна к довольно интенсивному анаэробному гликолизу.
Интенсивность обновления богатых энергией фосфорных соединений в головном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой ткани характеризуется значительным постоянством. В случае прекращения доступа кислорода мозг может «просуществовать» немногим более минуты за счет резерва лабильных фосфатов. Прекращение доступа кислорода даже на 10–15 с нарушает энергетику нервных клеток, что в целостном организме выражается наступлением обморочного состояния.
Установлено, что при инсулиновой коме содержание глюкозы в крови может снижаться до 1 ммоль/л, потребление кислорода мозгом в этих условиях не более 1,9 мл/100 г в 1 мин. В норме концентрация глюкозы в крови 3,3–5,0 ммоль/л, а мозг потребляет 3,4–3,7 мл кислорода на 100 г массы в 1 мин. При инсулиновой коме нарушаются процессы окислительного фосфорилирования в мозговой ткани, снижается концентрация АТФ и происходит изменение функций мозга.
Возбуждение и наркоз быстро сказываются на обмене лабильных фосфатов. В состоянии наркоза наблюдается угнетение дыхания; содержание АТФ и креатинфосфата повышено, а уровень неорганического фосфата снижен. Следовательно, сокращается потребление мозгом соединений, богатых энергией.
Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и трипептидом глутатионом приходится более 50% -аминоазота головного мозга. В мозге содержится ряд свободных аминокислот, которые лишь в незначительных количествах обнаруживаются в других тканях млекопитающих. Это -аминомасляная кислота, N-ацетиласпарагиновая кислота и цистатионин.
Одна из функций дикарбоновых аминокислот в головном мозге – связывание аммиака, освобождающегося при возбуждении нервных клеток.
Образование глутаминовой кислоты из -кетоглутаровой и аммиака является важным механизмом нейтрализации аммиака в ткани мозга, где путь устранения аммиака за счет синтеза мочевины не играет существенной роли. Кроме того, глутаминовая кислота в нервной ткани может декарбоксилироваться с образованием ГАМК.
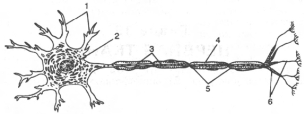 1 - дендриты; 2 - тело нейрона; 3 - аксон; 4 - миелиновая оболочка;
5 - перехваты узла; 6 - окончания.
Молекулярная организация миелиновой оболочки (по X. Хидену).
1 - дендриты; 2 - тело нейрона; 3 - аксон; 4 - миелиновая оболочка;
5 - перехваты узла; 6 - окончания.
Молекулярная организация миелиновой оболочки (по X. Хидену).
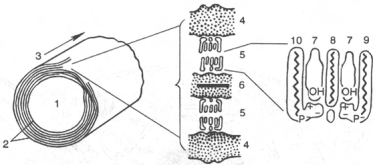 1 - аксон; 2 - миелин; 3 - ось волокна; 4 - белок (наружные слои); 5 - липиды;
6 - белок (внутренний слой); 7 - холестерин; 8 - цереброзид; 9 - сфингомиелин; 10 - фосфатидилсерин.
Липидный состав нервной ткани
1 - аксон; 2 - миелин; 3 - ось волокна; 4 - белок (наружные слои); 5 - липиды;
6 - белок (внутренний слой); 7 - холестерин; 8 - цереброзид; 9 - сфингомиелин; 10 - фосфатидилсерин.
Липидный состав нервной ткани
| Серое вещество | Белое вещество | Миелин | |
| Общее содержание липидов, % от сухой массы | 32,7 | 54,9 | |
| В процентах от общих липидов | |||
| Холестерин | 22,0 | 27,5 | 27,7 |
| Цереброзиды | 5,4 | 19,8 | 22,7 |
| Ганглиозиды | 1,7 | 5,4 | 3,8 |
| Фосфатидилэтаноламины | 22,7 | 14,9 | 15,6 |
| Фосфатидилхолины | 26,7 | 12,8 | 11,2 |
| Фосфатидилсерины | 8,7 | 7,9 | 4,8 |
| Фосфатидилинозитолы | 2,7 | 0,9 | 0,6 |
| Плазмалогены | 8,8 | 11,2 | 12,3 |
| Сфингомиелины | 6,9 | 7,7 | 7,9 |
Содержание основных минеральных компонентов в ткан головного мозга и в плазме крови человека
| Компонент | Мозговая ткань, ммоль/кг | Плазма крови, ммоль/л |
| Na+ | ||
| К+ | ||
| Са2+ | 2,5 | |
| Cl– | ||
| НСO3- |
 Синапсможно представить себе как узкое пространство (щель), ограниченное с одной стороны пресинаптической, а с другой – постсинаптической мембраной.
Пресинаптическая мембрана состоит из внутреннего слоя, принадлежащего цитоплазме нервного окончания, и наружного слоя, образованного нейроглией. Мембрана в некоторых местах утолщена и уплотнена, в других истончена и имеет отверстия для сообщения цитоплазмы аксона с синаптическим пространством. Постсинаптическая мембрана менее плотная, не имеет отверстий. Подобным образом построены и нервно-мышечные синапсы, но они имеют более сложное строение мембранного комплекса.
В общих чертах картину участия ацетилхолина в осуществлении передачи нервного импульса возбуждения можно представить следующим образом. В синаптических нервных окончаниях имеются пузырьки (везикулы) диаметром 30–80 нм, которые содержат нейромедиаторы. Эти пузырьки покрыты оболочкой, которая образована белком клатрином (мол. масса 180000). В холинергических синапсах каждый пузырек диаметром 80 нм содержит ~ 40000 молекул ацетилхолина. При возбуждении высвобождение медиатора происходит «квантами», т.е. путем полного опорожнения каждого отдельного пузырька. В нормальных условиях под влиянием сильного импульса выделяется примерно 100–00 квантов медиатора –количество, достаточное для инициирования потенциала действия в постсинаптическом нейроне. Происходит это, по-видимому, следующим образом. Деполяризация мембраны синаптических окончаний вызывает быстрый ток ионов Са2+ в клетку. Временное увеличение внутриклеточной концентрации ионов Са2+ стимулирует слияние мембраны синаптических пузырьков с плазматической мембраной и таким образом запускает процесс высвобождения их содержимого. Для выброса содержимого одного пузырька требуется примерно 4 иона Са2+. Выделенный в синаптическую щель ацетилхолин вступает во взаимодействие с белком-хеморецептором, входящим в состав постсинаптической мембраны. В результате изменяется проницаемость мембраны – резко увеличивается ее пропускная способность для ионов Na+. Взаимодействие между рецептором и медиатором запускает ряд реакций, заставляющих постсинаптическую нервную клетку или эффекторную клетку выполнять свою специфическую функцию. После выделения медиатора должна наступить фаза его быстрой инактивации, или удаления, чтобы подготовить синапс к восприятию нового импульса. В холинергических синапсах это происходит двумя путями.
Первый путь заключается в том, что ацетилхолин подвергается ферментативному гидролизу. Второй путь – это энергозависимый активный транспорт ацетилхолина в нейрон, где он накапливается для последующего повторного использования.
Гидролитический распад ацетилхолина на уксусную кислоту и холин катализируется ферментом, который получил название «ацетилхолинэстераза».
В большинстве отделов головного мозга гидролиз ацетилхолина осуществляется ацетилхолинэстеразой (истинная холинэстераза, которая гидролизует ацетилхолин быстрее, чем иные эфиры холина). В нервной ткани существуют и другие эстеразы, которые способны гидролизовать ацетилхолин, но значительно медленнее, чем, например, бутирилхолин. Эти эстеразы называются холинэстеразой (или псевдохолинэстеразой). К числу холинергических систем относятся моторные нейроны, образующие нервно-мышечные соединения, все преганглионарные нейроны автономной нервной системы и постганглионарные нейроны парасимпатической нервной системы. Большое количество холинергических симпатических областей обнаружено также в головном мозге. В зависимости от чувствительности к той или иной группе химических соединений холинергические нейроны делятся на мускариновые (активируемые мускарином) и никотиновые (активируемые никотином). Мускариновые рецепторы ацетилхолина, имеющиеся во многих нейронах автономной нервной системы, специфически блокируются атропином. Никотиновые синапсы присутствуют в ганглиях и скелетных мышцах. Их ингибиторами являются кураре и активный компонент этого яда D-тубокурарин.
Необходимо подчеркнуть, что в адренорецепторах существует два вида рецепторов для норадреналина: - и -адренергические рецепторы. Эти рецепторы можно отличить друг от друга по специфическим реакциям, которые они вызывают, а также по тем специфическим агентам, которые способны блокировать данные реакции.
-Адренергические рецепторы включают эфферентную клетку с помощью аденозин-3',5'-монофосфата, или цАМФ – универсального «второго посредника» между гормонами и различными функциями клеток, на которые воздействуют гормоны (см. главу 8).
Установлено, что как только -адренергический рецептор, расположенный на наружной поверхности мембраны эффекторной клетки, начинает взаимодействовать с норадреналином, на внутренней поверхности клеточной мембраны активируется фермент аденилатциклаза. Затем в клетке аденилатциклаза превращает АТФ в цАМФ; последний в свою очередь способен оказывать влияние на метаболизм клетки. Этот сложный ряд последовательных реакций может быть заблокирован пропранололом – веществом, препятствующим связыванию норадреналина с -адренергическим рецептором.
Известно, что в метаболизме катехоламиновых медиаторов особая роль принадлежит ферменту моноаминоксидазе (МАО). Этот фермент удаляет аминогруппу (—NH2) у норадреналина, серотонина, дофамина и адреналина, тем самым инактивируя указанные медиаторы. Было показано, что, помимо ферментативного превращения, существует и другой механизм быстрой инактивации, точнее удаления, медиаторов. Оказалось, что норадреналин быстро исчезает из синаптической щели в результате вторичного поглощения симпатическими нервами; вновь оказавшись в нервном волокне, медиатор, естественно, не может воздействовать на постсинаптические клетки.
Адренергическая и холинергическая системы головного мозга тесно взаимодействуют с другими системами мозга, в частности использующими серотонин в качестве медиатора. В основном серотонинсодержащие нейроны сосредоточены в ядрах мозгового ствола. Нейромедиаторная роль серотонина осуществляется в результате взаимодействиясеротонина со специфическими серотонинергическими рецепторами. Исследования, проведенные с ингибитором синтеза серотонина n-хлорфенилаланином, а также с другими ингибиторами, дают основания считать, что серотонин влияет на процессы сна. Выявлено также, что торможение кортикостероидами секреторной активности гипофиза оказывается менее эффективным у тех животных, мозг которых беднее серотонином.
В терапевтической практике применяется большое количество лекарственных средств, которые действуют через систему медиаторов. Многие лекарственные препараты, успешно применяемые при лечении гипертонии, влияют на накопление и выделение адренергических медиаторов. Например, резерпин – понижающее артериальное давление средство специфически тормозит процесс переноса катехоламинов в специальные гранулы нейронов и тем самым делает эти амины доступными действию эндогенной МАО.
Гипотензивные лекарственные препараты, такие, как -метилдофа, под действием содержащихся в нервной клетке (аксоне) ферментов превращаются в вещества, напоминающие по своему строению норадреналин. Эти «ложные» медиаторы накапливаются и выделяются вместе с естественными медиаторами, «разбавляя» их и тем самым снижая их эффект.
Многие антидепрессанты (вещества, снимающие депрессию) увеличивают содержание катехоламинов в синаптической щели, т.е. количество медиаторов для стимулирования рецептора возрастает. К таким веществам, в частности, относятся имипрамин (блокирует поглощение норадреналина нервными волокнами), амфетамин (одновременно способствует выделению норадреналина и блокирует его поглощение), ингибиторы МАО (подавляют метаболизм катехоламинов) и др. В связи с этим возникла катехоламиновая гипотеза депрессивных состояний, согласно которой психическая депрессия связана с недостатком катехоламинов в мозге.
Серотонин
Серотонин образуется из 5-гидрокситриптофана:
Синапсможно представить себе как узкое пространство (щель), ограниченное с одной стороны пресинаптической, а с другой – постсинаптической мембраной.
Пресинаптическая мембрана состоит из внутреннего слоя, принадлежащего цитоплазме нервного окончания, и наружного слоя, образованного нейроглией. Мембрана в некоторых местах утолщена и уплотнена, в других истончена и имеет отверстия для сообщения цитоплазмы аксона с синаптическим пространством. Постсинаптическая мембрана менее плотная, не имеет отверстий. Подобным образом построены и нервно-мышечные синапсы, но они имеют более сложное строение мембранного комплекса.
В общих чертах картину участия ацетилхолина в осуществлении передачи нервного импульса возбуждения можно представить следующим образом. В синаптических нервных окончаниях имеются пузырьки (везикулы) диаметром 30–80 нм, которые содержат нейромедиаторы. Эти пузырьки покрыты оболочкой, которая образована белком клатрином (мол. масса 180000). В холинергических синапсах каждый пузырек диаметром 80 нм содержит ~ 40000 молекул ацетилхолина. При возбуждении высвобождение медиатора происходит «квантами», т.е. путем полного опорожнения каждого отдельного пузырька. В нормальных условиях под влиянием сильного импульса выделяется примерно 100–00 квантов медиатора –количество, достаточное для инициирования потенциала действия в постсинаптическом нейроне. Происходит это, по-видимому, следующим образом. Деполяризация мембраны синаптических окончаний вызывает быстрый ток ионов Са2+ в клетку. Временное увеличение внутриклеточной концентрации ионов Са2+ стимулирует слияние мембраны синаптических пузырьков с плазматической мембраной и таким образом запускает процесс высвобождения их содержимого. Для выброса содержимого одного пузырька требуется примерно 4 иона Са2+. Выделенный в синаптическую щель ацетилхолин вступает во взаимодействие с белком-хеморецептором, входящим в состав постсинаптической мембраны. В результате изменяется проницаемость мембраны – резко увеличивается ее пропускная способность для ионов Na+. Взаимодействие между рецептором и медиатором запускает ряд реакций, заставляющих постсинаптическую нервную клетку или эффекторную клетку выполнять свою специфическую функцию. После выделения медиатора должна наступить фаза его быстрой инактивации, или удаления, чтобы подготовить синапс к восприятию нового импульса. В холинергических синапсах это происходит двумя путями.
Первый путь заключается в том, что ацетилхолин подвергается ферментативному гидролизу. Второй путь – это энергозависимый активный транспорт ацетилхолина в нейрон, где он накапливается для последующего повторного использования.
Гидролитический распад ацетилхолина на уксусную кислоту и холин катализируется ферментом, который получил название «ацетилхолинэстераза».
В большинстве отделов головного мозга гидролиз ацетилхолина осуществляется ацетилхолинэстеразой (истинная холинэстераза, которая гидролизует ацетилхолин быстрее, чем иные эфиры холина). В нервной ткани существуют и другие эстеразы, которые способны гидролизовать ацетилхолин, но значительно медленнее, чем, например, бутирилхолин. Эти эстеразы называются холинэстеразой (или псевдохолинэстеразой). К числу холинергических систем относятся моторные нейроны, образующие нервно-мышечные соединения, все преганглионарные нейроны автономной нервной системы и постганглионарные нейроны парасимпатической нервной системы. Большое количество холинергических симпатических областей обнаружено также в головном мозге. В зависимости от чувствительности к той или иной группе химических соединений холинергические нейроны делятся на мускариновые (активируемые мускарином) и никотиновые (активируемые никотином). Мускариновые рецепторы ацетилхолина, имеющиеся во многих нейронах автономной нервной системы, специфически блокируются атропином. Никотиновые синапсы присутствуют в ганглиях и скелетных мышцах. Их ингибиторами являются кураре и активный компонент этого яда D-тубокурарин.
Необходимо подчеркнуть, что в адренорецепторах существует два вида рецепторов для норадреналина: - и -адренергические рецепторы. Эти рецепторы можно отличить друг от друга по специфическим реакциям, которые они вызывают, а также по тем специфическим агентам, которые способны блокировать данные реакции.
-Адренергические рецепторы включают эфферентную клетку с помощью аденозин-3',5'-монофосфата, или цАМФ – универсального «второго посредника» между гормонами и различными функциями клеток, на которые воздействуют гормоны (см. главу 8).
Установлено, что как только -адренергический рецептор, расположенный на наружной поверхности мембраны эффекторной клетки, начинает взаимодействовать с норадреналином, на внутренней поверхности клеточной мембраны активируется фермент аденилатциклаза. Затем в клетке аденилатциклаза превращает АТФ в цАМФ; последний в свою очередь способен оказывать влияние на метаболизм клетки. Этот сложный ряд последовательных реакций может быть заблокирован пропранололом – веществом, препятствующим связыванию норадреналина с -адренергическим рецептором.
Известно, что в метаболизме катехоламиновых медиаторов особая роль принадлежит ферменту моноаминоксидазе (МАО). Этот фермент удаляет аминогруппу (—NH2) у норадреналина, серотонина, дофамина и адреналина, тем самым инактивируя указанные медиаторы. Было показано, что, помимо ферментативного превращения, существует и другой механизм быстрой инактивации, точнее удаления, медиаторов. Оказалось, что норадреналин быстро исчезает из синаптической щели в результате вторичного поглощения симпатическими нервами; вновь оказавшись в нервном волокне, медиатор, естественно, не может воздействовать на постсинаптические клетки.
Адренергическая и холинергическая системы головного мозга тесно взаимодействуют с другими системами мозга, в частности использующими серотонин в качестве медиатора. В основном серотонинсодержащие нейроны сосредоточены в ядрах мозгового ствола. Нейромедиаторная роль серотонина осуществляется в результате взаимодействиясеротонина со специфическими серотонинергическими рецепторами. Исследования, проведенные с ингибитором синтеза серотонина n-хлорфенилаланином, а также с другими ингибиторами, дают основания считать, что серотонин влияет на процессы сна. Выявлено также, что торможение кортикостероидами секреторной активности гипофиза оказывается менее эффективным у тех животных, мозг которых беднее серотонином.
В терапевтической практике применяется большое количество лекарственных средств, которые действуют через систему медиаторов. Многие лекарственные препараты, успешно применяемые при лечении гипертонии, влияют на накопление и выделение адренергических медиаторов. Например, резерпин – понижающее артериальное давление средство специфически тормозит процесс переноса катехоламинов в специальные гранулы нейронов и тем самым делает эти амины доступными действию эндогенной МАО.
Гипотензивные лекарственные препараты, такие, как -метилдофа, под действием содержащихся в нервной клетке (аксоне) ферментов превращаются в вещества, напоминающие по своему строению норадреналин. Эти «ложные» медиаторы накапливаются и выделяются вместе с естественными медиаторами, «разбавляя» их и тем самым снижая их эффект.
Многие антидепрессанты (вещества, снимающие депрессию) увеличивают содержание катехоламинов в синаптической щели, т.е. количество медиаторов для стимулирования рецептора возрастает. К таким веществам, в частности, относятся имипрамин (блокирует поглощение норадреналина нервными волокнами), амфетамин (одновременно способствует выделению норадреналина и блокирует его поглощение), ингибиторы МАО (подавляют метаболизм катехоламинов) и др. В связи с этим возникла катехоламиновая гипотеза депрессивных состояний, согласно которой психическая депрессия связана с недостатком катехоламинов в мозге.
Серотонин
Серотонин образуется из 5-гидрокситриптофана:
 Серотонин образуется в сером веществе коры головного мозга, в гипоталамусе. Серотонин играет роль медиатора в нервной системе и местного регулятора функций периферических органов и тканей. Он является нейромедиатором проводящих путей. Серотонин может превращаться в гормон мелатонин.
Серотонин стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессивным действием.
-Аминомасляная кислота (ГАМК)
ГАМК образуется их глутаминовой кислоты под действием глутаматдекарбоксилазы:
Серотонин образуется в сером веществе коры головного мозга, в гипоталамусе. Серотонин играет роль медиатора в нервной системе и местного регулятора функций периферических органов и тканей. Он является нейромедиатором проводящих путей. Серотонин может превращаться в гормон мелатонин.
Серотонин стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует артериальное давление, температуру тела, дыхание, обладает антидепрессивным действием.
-Аминомасляная кислота (ГАМК)
ГАМК образуется их глутаминовой кислоты под действием глутаматдекарбоксилазы:
 Синтез протекает в тормозных синапсах нервной системы, являясь их медиатором Наибольшие количества ГАМК содержатся в подкорковых образованиях головного мозга (в чёрной субстанции, бледном шаре, гипоталамусе).
Важным нейромедиатором, выполняющим тормозные функции, является -аминомасляная кислота (ГАМК), количество которой в головном мозге во много раз больше, чем других нейромедиаторов. Так, в гипоталамусе суммарное содержание ацетилхолина, норадреналина, дофамина и серотонина не превышает 10 мкг/г, в то время как ГАМК в этом отделе головного мозга более 600 мкг/г. ГАМК увеличивает проницаемость постсинаптических мембран для ионов К+ и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия; таким образом, ГАМК – это тормозной нейромедиатор. ГАМК образуется при декарбоксилировании глутамата в реакции, катализируемой глутаматдекарбоксилазой.
Глицин, глутамат
Аминокислоты глицин и глутамат – важнейшие нейромедиаторы.
Глутамат выполняет функции: 1) один из основных возбуждающих медиаторов в коре, гиппокампе, полосатом теле и гипоталамусе; 2) участвует в регуляции процессов памяти; 3) составная часть ряда малых и средних регуляторных пептидов мозга (глутатион). В виде пироглутамата (циклическая форма) входит в целый ряд нейропептидов (люлиберин, тиролиберин, нейротензин, бомбезин и др.); 4) велика его энергетическая роль, т.к. глутамат служит поставщиком -кетоглутарата – компонента цитратного цикла; 5) участвует в обезвреживании аммиака с образованием глутамина, который в больших количествах поступает через мембраны в нейроны, где присутствует фермент глутаминаза. Под действием этого ферменета вновь образуется глутамат, который используется для синтеза ГАМК. Учитывая, что биомембраны менее проницаемы для глутамата, чем для глутамина, его можно расценивать как глиально-нейрональный переносчик глутамата (а, значит, и ГАМК).
Глицин
Глицин – важнейший (после ГАМК) тормозный нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга. Вычокий уровень глицина в плазме крови и моче обычно свидетельствует о нарушении функции мозга.
Катехоламины
Катехоламины синтезируются из фенилаланина и тирозина:
Синтез протекает в тормозных синапсах нервной системы, являясь их медиатором Наибольшие количества ГАМК содержатся в подкорковых образованиях головного мозга (в чёрной субстанции, бледном шаре, гипоталамусе).
Важным нейромедиатором, выполняющим тормозные функции, является -аминомасляная кислота (ГАМК), количество которой в головном мозге во много раз больше, чем других нейромедиаторов. Так, в гипоталамусе суммарное содержание ацетилхолина, норадреналина, дофамина и серотонина не превышает 10 мкг/г, в то время как ГАМК в этом отделе головного мозга более 600 мкг/г. ГАМК увеличивает проницаемость постсинаптических мембран для ионов К+ и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия; таким образом, ГАМК – это тормозной нейромедиатор. ГАМК образуется при декарбоксилировании глутамата в реакции, катализируемой глутаматдекарбоксилазой.
Глицин, глутамат
Аминокислоты глицин и глутамат – важнейшие нейромедиаторы.
Глутамат выполняет функции: 1) один из основных возбуждающих медиаторов в коре, гиппокампе, полосатом теле и гипоталамусе; 2) участвует в регуляции процессов памяти; 3) составная часть ряда малых и средних регуляторных пептидов мозга (глутатион). В виде пироглутамата (циклическая форма) входит в целый ряд нейропептидов (люлиберин, тиролиберин, нейротензин, бомбезин и др.); 4) велика его энергетическая роль, т.к. глутамат служит поставщиком -кетоглутарата – компонента цитратного цикла; 5) участвует в обезвреживании аммиака с образованием глутамина, который в больших количествах поступает через мембраны в нейроны, где присутствует фермент глутаминаза. Под действием этого ферменета вновь образуется глутамат, который используется для синтеза ГАМК. Учитывая, что биомембраны менее проницаемы для глутамата, чем для глутамина, его можно расценивать как глиально-нейрональный переносчик глутамата (а, значит, и ГАМК).
Глицин
Глицин – важнейший (после ГАМК) тормозный нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга. Вычокий уровень глицина в плазме крови и моче обычно свидетельствует о нарушении функции мозга.
Катехоламины
Катехоламины синтезируются из фенилаланина и тирозина:
 (ДОФА – 3,4-диоксифенилаланин).
Дофамин образуется в синапсах ЦНС (гипоталамус, лимбическая система и др.), симпатических ганглиях, где играет роль медиатора в дофаминэргических синапсах.
Норадреналин и адреналин синтезируются в адренэргических синапсах головного мозга и в окончаниях синаптических нервов вегетативной нервной системы.
Предшественники и биологическая роль некоторых биогенных аминов
(ДОФА – 3,4-диоксифенилаланин).
Дофамин образуется в синапсах ЦНС (гипоталамус, лимбическая система и др.), симпатических ганглиях, где играет роль медиатора в дофаминэргических синапсах.
Норадреналин и адреналин синтезируются в адренэргических синапсах головного мозга и в окончаниях синаптических нервов вегетативной нервной системы.
Предшественники и биологическая роль некоторых биогенных аминов

 1 - синаптические пузырьки; 2 - лизосома; 3 - микрофибриллы (нейрофибриллы); 4 - аксон; 5 - митохондрии; 6 - пресинаптическое утолщение мембраны; 7 - постсинаптическое утолщение мембраны; 8 - синаптическая щель (около 20 нм).
Н4БП - фенилаланингидроксилаза
НООССН2СН2СН2NH2 – ГАМК
1 – Тирозингидроксилаза;
2 – ДОФА-декарбоксилаза;
3 – Дофамингидроксилаза;
4 – Фенилэтаноламин-N-метилтрансфераза.
1 - синаптические пузырьки; 2 - лизосома; 3 - микрофибриллы (нейрофибриллы); 4 - аксон; 5 - митохондрии; 6 - пресинаптическое утолщение мембраны; 7 - постсинаптическое утолщение мембраны; 8 - синаптическая щель (около 20 нм).
Н4БП - фенилаланингидроксилаза
НООССН2СН2СН2NH2 – ГАМК
1 – Тирозингидроксилаза;
2 – ДОФА-декарбоксилаза;
3 – Дофамингидроксилаза;
4 – Фенилэтаноламин-N-метилтрансфераза.