Хромофорная теория теория кислотно-основных индикаторов
Согласно ей окраска кислотно-основных индикаторов зависит от наличия хромофоров (особые атомные группы)
По хромофорной теории изменение окраски индикаторов происходит в результате изомерных превращений (внутримолекулярная обстановка, изменение строения молекулы)
Обратная изомерия – таутомерия, изомеры – таутомеры.
Ионно-хромофорная теория кислотно-основных индикаторов
Согласно этой теории:
* изменение окраски индикатора происходит в результате изменения их строения
* изменение строения происходит в зависимости от pH, т.к. 1 из таутомерных форм является слабым электролитом
Интервал перехода кислотно-основных индикаторов
название – интервал – Кислотная форма - Основная форма
Фенолфталеин - 8.2 – 10.0 – Бесцветная - Красная
Феноловый красный - 6.4 – 8.0 - Желтая - Красная
Лакмус - 5.0 – 8.0 - Красная - Синяя
Метиловый красный - 4.2 – 6.2 - Красная - Желтая
Метиловый оранжевый - 3.1 – 4.4 - Розовая - Желтая
Графическое изображение процесса титрования или кривые титрования, скачок титрования, точка эквивалентности и точка нейтрализации.
Кривая титрования – это график зависимости pH титруемого раствора (ось ординат) от объема добавленного титранта (ось абсцисс).
Скачок титрования - резкое изменение рН вблизи точки эквивалентности.
ТЭ – момент окончания реакции (определяется по изменению окраски индикатора или раствора, или по изменению какого-либо химико-физического свойства вещества, поэтому конечная т. титрования как правило не совпадает с рассчитываемой ТЭ)
точка нейтрализации
Окислительно-восстановительное титрование или редоксиметрия. Окисл-Восст потенциал. Уравнение Нернста. Направление окисл-восст процесса
Редоксиметрия – основана на применении окислительно-восстановительных реакций.
Разделяется (по названию химических соединений, содержащихся в стандартных растворах) на ряд методов: иодометрия, перманганатометрия, хроматометрия, броматометрия, и др.
Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться).
Направление ОВ-процесса идет всегда от большего потенциала к меньшему, Зависимость величины потенциала выражается уравн-ием Нернста:
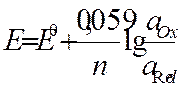
где: E — электродный потенциал, E0 — стандартный электродный потенциал, n — число моль электронов, участвующих в процессе, {a{Ox}} и \ {a{Red}} — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Зависимость окисл-восст потенциала от pH-среды. Примеры
Очень часто превращение окисленной формы в восстановленную сопровождается изменением состава иона и происходит с участием H+ или OH-
В общем виде можно записать:
В кислой среде:
* Xn +2H =>Xn-1 +H2O
* Xn +H2O => Xn+1 + 2H
В щелочной среде:
* Xn + 2OH => Xn+1 + H2O
* Xn +H2O => Xn-1 + 2OH
В нейтральной среде:
* Xn + H2O => Xn-1 + 2OH
* Xn + H2O => Xn-1 + 2H