Изоформы лактатдегидрогеназы
Причины, приводящие к увеличению количества ферментов в крови
Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения.
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе.
Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей.
Изоферменты.
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Сердце.
Гликогенфосфорилаза.Среди ферментных и изоферментных маркеров в диагностике инфаркта миокарда клинические биохимики определяют активность ГФ и ее изофермента ГФ-ВВ. ГФ - цитозольный фермент, который катализирует в клетке отщепление глюкозы от гликогена.
В тканях человека присутствуют три изофермента ГФ: ГФ-LL в печени, ГФ-ММ в миоцитах и ГФ-ВВ в ткани мозга. В миокарде человека присутствуют изоферменты ГФ-ВВ и ГФ-ММ, в миоцитах скелетной мускулатуры - только ГФ-ММ. ГФ-ВВ - наиболее чувствительный тест для диагностики инфаркта миокарда в первые 3-4 ч после приступа стенокардии. По диагностической чувствительности в первые часы определение активности ГФ можно сопоставить только с определением в крови массы КК-МВ. У большинства больных уровень ГФ-ВВ достоверно увеличивался уже через 4 ч после приступа стенокардии и при неосложненном инфаркте миокарда возвращался к норме в течение 48 ч.
Лактатдегидрогеназа- олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle -мышца) и Н (от англ, heart- сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы лактатдегидрогеназы.
Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты).

Существенным шагом вперед является исследование изоэнзимов ЛДГ. Известно пять изоэнзимов ЛДГ. Они пронумерованы в соответствии со скоростью их миграции при электрофорезе. Первым назван самый быстрый, а пятым - самый медленный изоэнзим. Для каждого органа характерно определенное соотношение изоэнзимов ЛДГ - так называемый изоэнзимный профиль, или спектр, ЛДГ. Хотя практически каждый орган содержит все пять изоэнзимов, их профиль достаточно специфичен и стабилен. Например, в сердце содержится в основном ЛДГ1, в легких - ЛДГ2 и ЛДГ3, в печени - ЛДГ4 и ЛДГ5.
При остром инфаркте миокарда в сыворотке в первую очередь повышается активность ЛДГ, что является не только более ранним, специфичным, но и более чувствительным тестом острого некроза миокарда, так как нередко определяется у тех больных, у которых общая активность ЛДГ не превышает верхней границы нормы.
Исследование изоэнзимного профиля ЛДГ в сыворотке крови не только существенно увеличивает информационную ценность этого теста при дифференциальной диагностике между инфарктом миокарда и другими формами коронарной недостаточности, но и позволяет уточнить диагноз острого инфаркта миокарда на фоне аритмий и перикардита, после электроимпульсной терапии и при наличии других осложнений.
- Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ.
-

. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа).
- Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты.
- При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей.
Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рисунке В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани. Многие прочие заболевания, при которых повышается общая активность ЛДГ, также могут быть успешно отдифференцированы от острого инфаркта миокарда ибо характеризуются увеличением активности за счет медленных изомеазитов. Если же в дальнейшем на таком фоне развивается инфаркт миокарда, это может быть определено по увеличению фракции ЛДГ1, даже если общая ее активность не изменяется.
Особый интерес представляют результаты изучения изоэнзимного спектра КФК. Увеличение активности КФК в крови является доказательством повреждения миокарда.
Исследование ферментативной активности крови -перспективный метод прижизненной количественной оценки величины некроза миокарда. Для этой цели используют определение ферментативной активности КФК. Общее количество фермента, поступающее в кровоток из области некроза, может быть определено при исследовании его активности в серии проб крови на основании разработанной модели с учетом скорости выхода фермента из некротизированного миокарда в общий кровоток, скорости исчезновения его из крови, доли миокардиального фермента, инактивирующегося на месте, и объема, в котором распределяется высвободившийся из некротизированного миокарда фермент.
Изоформы креатинкиназы.
Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
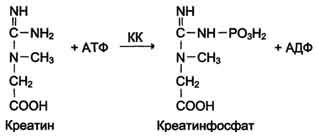
Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle -мышца) и В (от англ, brain -мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис.). Молекула креатинкиназы состоит из двух частей, которые могут быть представлены одной из двух субъединиц: М, от английского muscle – "мышца", и B, brain – "мозг". Таким образом, в организме человека креатинкиназа есть в виде трёх изомеров: ММ,МВ, ВВ. ММ-изомер содержится в скелетной мускулатуре и миокарде, МВ – в основном в миокарде, ВВ – в тканях головного мозга, в небольшом количестве в любых клетках организма.
В крови здорового человека креатинкиназа присутствует в небольших количествах, в основном в виде ММ-изомера. Активность креатинкиназы зависит от возраста, пола, расы, мышечной массы и физической активности.
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
