Система атомов или ионов, определенным образом расположенных в пространстве, называется кристаллической решеткой
Таким образом, кристаллические вещества характеризуются правильным, повторяющимся в пространстве расположением их атомов или ионов. Наличие этого повторяющегося расположения частиц позволяет описывать строение всего кристалла, выделяя в нем небольшую типичную часть. И эта типичная часть кристаллической решетки называется элементарной ячейкой.
Довольно грубым примером элементарной ячейки из повседневной жизни может быть повторяющийся рисунок на обоях и тканях, рисунок паркета или линолеума. Значит элементарная ячейка – это единое расположение точек или предметов в пространстве, которое повторяется бесконечное число раз.
Таким образом, кусок кристаллического вещества представляет собой скопление элементарных ячеек (рис.2).
В кристаллах приходится иметь дело с трехмерными решетками и элементарными ячейками. Рисунок трехмерной решетки (рис.3):
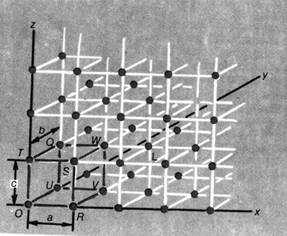
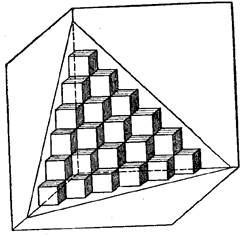
Рис. 3. Рис. 2. Образование грани кристалла из
кубических элементарных ячеек.
Обычно элементарную ячейку выбирают так, чтобы она включала начало отсчета координат – т.О. Элементарная ячейка представляет собой бесконечно повторяющийся набор точек в пространстве, поэтому ее можно описать, указывая координаты этих точек. В кристаллах для описания расположения точек элементарной ячейки используют оси, но не x,y,z, а а,b,c. На представленном рисунке элементарная ячейка описывается 8 точками: O, R, S, T, U, V, W, Q. Точка S имеет координаты (1,0,1), а т. L – 2,1,1. Углы между осями рассматриваемой решетки составляют 90о; в таком случае указывается, что α=β=γ=90о, а если при этом а=b=c, то расположение точек представляет собой простую кубическую систему. При этом каждая точка кубической ячейки принадлежит одновременно 8 ячейкам; а каждая грань принадлежит одновременно 2 ячейкам. Эти точки – вершины куба- называют узлами ячейки или кристаллической решетки. В реальных кристаллах в узлах решетки находятся атомы или ионы.
Кристаллические решетки.
В разнообразных кристаллических веществах, существующих в природе и получаемых синтетическим путем, встречается множество типов решеток и элементарных ячеек. Все они подразделены на 7 больших систем, называемых сингониями. Они представлены на рис. 4:

Рис. 4. Кристаллы различных сингоний.
Одним из свойств кристаллической решетки является симметрия – это наличие или отсутствие соответствия между частями элементарной ячейки или самого кристалла по отношению к некоторой линии, проходящей через кристалл, или точке. Наиболее высокой степенью симметрии обладает кубическая решетка, поскольку размеры элементарной ячейки вдоль всех осей одинаковы, а углы между осями составляют 90о. Например, ось, проходящая через центры противоположных граней куба, называется осью симметрии 4-го порядка, потому что при повороте куба вокруг этой оси на 360о возникает 4 идентичных положения. Аналогичные оси можно провести через 2 другие пары противоположных граней, и, следовательно, у куба имеется 3 оси симметрии 4-го порядка.

Рис. 5.
Еще у куба имеется ось симметрии 3-го порядка – она соединяет 2 противоположные вершины куба и имеет 3 порядок. Всего в кубе имеется 4 пары противоположных вершин, значит, 4 оси симметрии 3-го порядка.
Наконец, проводя прямую через середины двух противоположных ребер куба, мы получим ось симметрии 2-го порядка. А т.к. в кубе всего 6 таких пар, то он имеет 6 осей симметрии 2-го порядка. Таким образом, всего в кубе имеется 13 осей симметрии.

Рис. 6.
Другой важной характеристикой кристаллической структуры является число ближайших соседей каждого атома – координационное число. Например, в простой кубической решетке у каждого атома должно быть 6 ближайших соседей (рисунок).

На кратчайшем расстоянии от частицы А расположены 6 частиц, т.е. координационное число равно 6. При этом только 3 частицы принадлежат той же элементарной ячейке, что и рассматриваемая частица А.
Рис. 7.
Типы кристаллических решеток.
Различия в структуре кристаллов (кристаллических решеток) обусловлены типом сил взаимодействия между частицами кристалла. В кристаллах металлов о таких силах говорят как о металлической связи, в кристаллах различных солей осуществляется ионная связь; другие кристаллические вещества существуют в результате ковалентной связи между образующими их частицами. Поэтому типы кристаллов классифицируются по виду связи между частицами, составляющими кристалл.
Самые слабые силы взаимодействия между частицами существуют в молекулярных кристаллах, к числу которых относятся, например, кристаллы СО2, серы, бензола, йода, нафталина. Эти вещества состоят из молекул, слабо взаимодействующих друг с другом. А поскольку силы межмолекулярного взаимодействия невелики, для молекулярных кристаллов характерны низкие температуры плавления и сублимации, мягкость или хрупкость, а также необычайно высокое давление паров над их поверхностью. Наличие запаха у таких веществ как камфора, нафталин, йод, свидетельствует о том, что их молекулы легко испаряются с поверхности твердого вещества.
Электропроводность молекулярных кристаллов очень мала, т.к. в их молекулах существует ковалентная связь, и способность электронов перемещаться между молекулами оказывается чрезвычайно малой. На структуру
некоторых молекулярных кристаллов и их физические
 свойства оказывает сильное влияние водородная связь между молекулами. Например, за счет образования этой связи между дипольными молекулами воды лед имеет температуру плавления 0оС, в то время как сероводород, в котором почти не возникает водородных связей, плавится при –82,9оС.
свойства оказывает сильное влияние водородная связь между молекулами. Например, за счет образования этой связи между дипольными молекулами воды лед имеет температуру плавления 0оС, в то время как сероводород, в котором почти не возникает водородных связей, плавится при –82,9оС.
Рис. 8.Структура кристалла льда
В ионных кристаллах между частицами осуществляется ионная связь за счет сил кулоновского (электрического) взаимодействия. В качестве примера можно привести многие известные соли, например, хлориды натрия и калия или цезия. Поскольку электрическое поле, создаваемое каждым ионом, не имеет конкретной направленности в пространстве, в ионных кристаллах катионы со всех сторон окружены анионами, и, наоборот, анионы со всех сторон окружены катионами. В большинстве простых солей вокруг каждого иона располагается по 6 или 8 ионов противоположного знака (пример – решетка CsCl).


Рис. 9. Структуры кристаллов NaCl и CsCl.
Силы, соединяющие частицы ионного кристалла в единое целое, очень велики, поэтому многие свойства таких кристаллов значительно отличаются от свойств молекулярных кристаллов. Как правило, вещества ионного типа имеют высокие температуры плавления и кипения и характеризуются чрезвычайно низким давлением паров; они растворяются только в наиболее полярных растворителях. Ионные кристаллы относятся к диэлектрикам, потому что образующие их ионы не могут свободно мигрировать в сторону от своих равновесных положений в узлах кристаллической решетки.
Ковалентные кристаллы (атомные решетки) – кристаллические структуры, частицы которых соединяются друг с другом в результате обобществления электронных пар. В таких кристаллах между атомами осуществляется ковалентная неполярная связь, однако, в отличие от молекул с ковалентной связью в кристаллах существует протяженный трехмерный каркас ковалентных связей

 между соседними атомами. Наиболее известным представителем ковалентных кристаллов является алмаз (рисунок). В кристаллической структуре алмаза каждый атом углерода ковалентно связан с 4 соседними атомами углерода, располагающимися вокруг него в тетраэдрической конфигурации. Длина всех связей между атомами углерода одинаковая и равна 1,54 Å. Ориентация 4-х возникающих в этом случае связей ничем не отличается от существующей в молекулах с простыми
между соседними атомами. Наиболее известным представителем ковалентных кристаллов является алмаз (рисунок). В кристаллической структуре алмаза каждый атом углерода ковалентно связан с 4 соседними атомами углерода, располагающимися вокруг него в тетраэдрической конфигурации. Длина всех связей между атомами углерода одинаковая и равна 1,54 Å. Ориентация 4-х возникающих в этом случае связей ничем не отличается от существующей в молекулах с простыми
углерод-углеродными связями. Поскольку протяженность системы этих связей в алмазе очень велика, этот кристалл и подобные ему кристаллические ковалентно связанные вещества иногда называют гигантскими молекулами.
Другим примером ковалентного кристалла, который также можно отнести к гигантским молекулам, является кварц SiO2. В кристалле кварца каждый атом кремния ковалентно связан с 4 окружающими его атомами кислорода. Каждый из атомов кислорода в свою очередь связан с атомами кремния, и таким образом через весь кристалл простирается непрерывный каркас связей Si-O-Si. Подобное расположение атомов существует в многочисленных силикатных минералах, в которых структурные группы SiO44– соединяются друг с другом, образуя одномерные цепи, двумерные слои или трехмерный каркас.
Металлические кристаллы – кристаллы, в которых атомы металлов образуют плотно упакованные структуры. Взаимодействие, удерживающее атомы металлов в едином кристалле называется металлической связью. Она возникает между атомами металлов в результате их сближения и перекрывания внешних атомных
Решетка:
Кубическая плотноупакованная
Гексагональная плотноупакованная
|
Орбиталей. Эта связь не является ковалентной неполярной, так как электроны не фиксируются между двумя атомами, а переходят в состояние проводимости и могут мигрировать между всеми атомами данного кристалла и даже куска металла. Эти мигрирующие электроны (обобщенные электроны, свободные электроны, электронный газ) – электроны проводимости – и осуществляют ненаправленную связь между атомами в кристаллической решетке металлов. Металлическая связь представляет собой результат перекрывания делокализованных орбиталей сближающихся атомов в кристаллической решетке металлов. (Локализация – сосредоточение чего-либо в малом объеме пространства, а делокализация – обратный процесс, т.е. рассосредоточение, распределение). В электрическом поле обобщенные электроны получают направленное движение – электрический ток. Такое состояние электронов называют состоянием проводимости.
Отсутствие в кристалле металла направленных связей объясняет тот факт, что металлы всегда кристаллизуются с максимальным координационным числом (КЧ), что приводит к плотнейшей упаковке атомов в кристалле и кубической объемноцентрированной кристаллической решетке.
Чаще всего у металлов встречаются структуры трех следующих типов (рис. 9):
1) кубическая плотноупакованная, 2) гексагональная плотноупакованная, 3) объемно-центрированная кубическая. Особенность кристаллической структуры металлов – высокие координационные числа (8-12), что свидетельствует о большой плотности упаковки атомов в кристаллических ячейках. Как показывает ниже приведенная диаграмма, между кристаллическим строением металлов и их положением в периодической таблице существует четкая взаимосвязь (на диаграмме указаны наиболее распространенные при обычных условиях структуры металлов). Например, все щелочные металлы обладают объемно-центрированной кубической структурой; такую же структуру имеют большинство переходных металлов IV, V и VI групп. Металлы VIII и IБ групп обычно имеют кубическую плотно упакованную структуру. Многие металлы могут существовать в нескольких модификациях, отличающихся типом структуры.

 Например, железо, помимо кубической плотноупакованной структуры (немагнитное γ-Fe, КЧ=12, устойчиво при температуре выше 9060С), может обладать объемно-центрированной кубической структурой (магнитное α-Fe, КЧ=8, устойчиво ниже 7680С). Наличием этих двух кристаллических форм железа объясняется странная картина, которую можно наблюдать в кузнице. Когда раскаленную железную подкову (или другую деталь) вынимают из горна и дают ей остыть на воздухе, ее ярко красное свечение постепенно тускнеет, но внезапно снова сильно вспыхивает, после чего уже окончательно угасает. При остывании железо проходит через точку перехода при 910оС, в которой γ-Fe превращается в α-Fe. Этот переход является экзотермическим, и выделяющееся тепло и обусловливает возобновление свечения.
Например, железо, помимо кубической плотноупакованной структуры (немагнитное γ-Fe, КЧ=12, устойчиво при температуре выше 9060С), может обладать объемно-центрированной кубической структурой (магнитное α-Fe, КЧ=8, устойчиво ниже 7680С). Наличием этих двух кристаллических форм железа объясняется странная картина, которую можно наблюдать в кузнице. Когда раскаленную железную подкову (или другую деталь) вынимают из горна и дают ей остыть на воздухе, ее ярко красное свечение постепенно тускнеет, но внезапно снова сильно вспыхивает, после чего уже окончательно угасает. При остывании железо проходит через точку перехода при 910оС, в которой γ-Fe превращается в α-Fe. Этот переход является экзотермическим, и выделяющееся тепло и обусловливает возобновление свечения.
 Существуют 2 типа плотноупакованных структур: кубическая и гексагональная. Оба типа характеризуются одинаковым расположением атомов в пределах одной кристаллической плоскости (слоя) (рисунок), однако они отличаются способом чередования таких плоскостей.
Существуют 2 типа плотноупакованных структур: кубическая и гексагональная. Оба типа характеризуются одинаковым расположением атомов в пределах одной кристаллической плоскости (слоя) (рисунок), однако они отличаются способом чередования таких плоскостей.  В гексагональной плотной упаковке (рисунок) атомы располагаются в плотноупакованных слоях, чередующихся друг с другом по типу АВАВ… . В кубической атомные слои чередуются по-другому: лишь 4-й по счету слой содержит
В гексагональной плотной упаковке (рисунок) атомы располагаются в плотноупакованных слоях, чередующихся друг с другом по типу АВАВ… . В кубической атомные слои чередуются по-другому: лишь 4-й по счету слой содержит
|
чередование слоев типа АСВАСВ… .
Вследствие этого отличаются и элементарные ячейки указанных типов кристаллов. В кубической плотноупакованной структуре имеется 4 набора эквивалентных параллельных плоскостей, которые образуются 4-мя диагональными плоскостями. Одна из них показана на рисунке 9. В гексагональной плотноупакованной структуре имеется всего 1 набор эквивалентных плоскостей – горизонтальные плоскости (рис.9). Это объясняет тот факт, что хотя длина связи и плотность у металлов кристаллических структур могут быть близкими, их пластичность и ковкость связаны с конкретным типом кристаллической структуры. Например, хорошая ковкость таких металлов как серебро или медь, золото, обусловлена тем, что в их кубических плотноупакованных кристаллах слои атомов способны скользить друг относительно друга вдоль так называемых плоскостей скольжения. Плоскости скольжения имеются в наибольшем количестве в кристаллах с кубической плотноупакованной структурой. А хром, ванадий и молибден, имеющие кубическую объемно-центрированную или гексагональную структуру, обладают значительно меньшей пластичностью и ковкостью. Вместе с тем щелочные металлы с кубической объемно-центрированной структурой имеют небольшую плотность и настолько мягки, что их можно резать обычным ножом. Эти свойства обусловлены значительно большим межатомным расстоянием в объемно-центрированной структуре, наличием у щелочных металлов относительно небольшого числа валентных электронов. И поэтому межатомные связи в их кристаллах довольно слабы.
Наличие в металле небольшого количества примесей, например, как в сплавах, означает появление в их кристаллической решетке атомов другого размера. Такие неоднородности могут очень сильно искажать плоскости скольжения и препятствовать скольжению одних атомных плоскостей относительно других. Наиболее ярким примером такого влияния служить сплав меди с бериллием (менее 1% бериллия). Этот сплав обладает такой твердостью и упругостью, что из него получаются прекрасные пружины; однако известно, что медь – довольно мягкий и пластичный (неупругий) металл.
Аморфные вещества.
Большинство веществ при охлаждении ниже температуры плавления переходят в кристаллическую форму. Но некоторые вещества – стекло, органические полимеры, особенно при быстром охлаждении, - не способны достичь той степени упорядоченности, характерной для кристаллических веществ. Из-за того, что их молекулы обладают большими размерами, причудливой формой и малой подвижностью, эти вещества образуют структуры, которые иногда называют переохлажденными жидкостями или стеклами. В таких структурах ближайшие соседи занимают почти правильное положение в решетке, но следующие соседи гораздо больше отклоняются от правильного положения в решетке, и поэтому за пределами одной элементарной ячейки не удается установить достаточной степени упорядоченности. Подобные твердые вещества называют аморфными (бесформенными). На следующем рисунке сопоставляются структуры аморфного и кристаллического веществ.
 Самое известное аморфное вещество – стекло. Стекло способно к медленному течению: старые оконные стекла, прослужившие около сотни лет, оказываются в своей нижней части чуть толще, чем в верхней. При отжиге стекла его структурные частицы получают возможность изменять свою ориентацию в пространстве, и в результате внутри стекла возникают области кристалличности.
Самое известное аморфное вещество – стекло. Стекло способно к медленному течению: старые оконные стекла, прослужившие около сотни лет, оказываются в своей нижней части чуть толще, чем в верхней. При отжиге стекла его структурные частицы получают возможность изменять свою ориентацию в пространстве, и в результате внутри стекла возникают области кристалличности.
Отличительное свойство аморфных веществ – отсутствие у них определенной температуры плавления. Они просто размягчаются в довольно широком температурном диапазоне. Размягчение объясняется резким уменьшением сил при нагревании, которые удерживают вещество в твердом состоянии.
 Еще одним примером аморфного вещества является сера. Аморфную серу получают охлаждением до комнатной температуры расплава серы. В кристаллической сере содержатся кольцевые молекулы S8, которые в аморфном состоянии раскрываются и соединяются друг с другом, образуя длинные спиральные цепи. Если аморфная сера находится в течение нескольких дней при комнатной температуре, она превращается в кристаллы ромбической структуры, состоящие из молекул S8.
Еще одним примером аморфного вещества является сера. Аморфную серу получают охлаждением до комнатной температуры расплава серы. В кристаллической сере содержатся кольцевые молекулы S8, которые в аморфном состоянии раскрываются и соединяются друг с другом, образуя длинные спиральные цепи. Если аморфная сера находится в течение нескольких дней при комнатной температуре, она превращается в кристаллы ромбической структуры, состоящие из молекул S8.
 Металлические стекла – аморфные модификации металлов – также известны давно, но получать их очень сложно. Для этого расплав металла надо охлаждать с очень большой скоростью – за сотые доли секунды! Только в таких условиях кристаллическая структура металлов не успевает сформироваться.
Металлические стекла – аморфные модификации металлов – также известны давно, но получать их очень сложно. Для этого расплав металла надо охлаждать с очень большой скоростью – за сотые доли секунды! Только в таких условиях кристаллическая структура металлов не успевает сформироваться.
Аморфные металлы обладают рядом физических отличий от обычных кристаллических собратьев как по магнитным свойствам, так и по механическим, особенно по прочности. Связано это с тем, что в аморфных структурах нет типичных для кристаллов дефектов и внутренних напряжений, способных снизить прочность материала.
Группа физиков из университета им. Карнеги Меллона разработала компьютерную программу, с помощью которой можно моделировать разнообразные аморфные металлические материалы и условия их получения. Например, было установлено, что добавление в расплав стали небольших количеств иттрия позволит создать стальное стекло без сверхскоростного охлаждения. Также с помощью данной программы был создан аморфный алюминий. Поскольку в аморфном состоянии упаковка атомов менее плотная, чем в кристаллическом, то аморфные металлы будут обладать меньшей плотностью, чем кристаллические. Это открывает перспективу для получения легких и прочных металлических материалов.
Литература:
1. В.В. Фролов. Химия: Учеб. пособ. для вузов. М.: Высш. Школа. 1979. 559с.
2. У. Слейбо, Т. Персонс. Общая химия. М.: Изд. «Мир». 1979. 550 с.