Закон збереження маси речовини
Міністерство освіти і науки, молоді та спорту
України
Сумський державний університет
Машинобудівний коледж
ОПОРНІ КОНСПЕКТИ
З дисципліни
„Хімія”
для студентів ІІ курсу всіх форм навчання спеціальностей:
5.05050302 „Технологія обробки матеріалів на верстатах і автоматичних лініях”,
5.05050311 „Хімічне і нафтове машинобудування”,
5.05040201 „Ливарне виробництво чорних і кольорових металів і сплавів”
Р.
Опорні конспекти розроблені викладачами дисципліни „Хімія” Пальмовою І.О. та Хроленко І.А.
Розглянуто і затверджено цикловою комісією природничо-математичних дисциплін
Протокол № від „ ” _________ 2011р.
ЗМІСТ
РОЗДІЛ 1. ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ. ХІМІЧНИЙ ЗВ'ЯЗОК........................................................................ 5
1.1. Основні закони хімії......................................................................................................................... 5
1.2. Будова атома.................................................................................................................................... 7
1.3. Будова речовин............................................................................................................................... 10
1.4. Періодичний закон і періодична система Д.І. Менделєєва....................................................... 12
1.5. Хімічний зв'язок............................................................................................................................ 14
1.6. Міжмолекулярна взаємодія. Типи кристалічних ґраток............................................................ 17
РОЗДІЛ 2. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ ПРОЦЕСІВ................................................................................ 18
2.1. Реакції йонного обміну.................................................................................................................. 18
2.2. Окисно-відновні реакції................................................................................................................ 19
2.3. Енергетика хімічних реакцій....................................................................................................... 22
2.4. Хімічна кінетика............................................................................................................................ 23
2.5. Хімічна рівновага........................................................................................................................... 26
РОЗДІЛ 3. ДИСПЕРСНІ СИСТЕМИ. РОЗЧИНИ. КОМПЛДЕКСНІ РЕЧОВИНИ................................................................. 29
3.1. Дисперсні системи........................................................................................................................ 29
3.2. Розчини і розчинність................................................................................................................... 33
3.3. Розчини електролітів. Електролітична дисоціація...................................................................... 36
3.4. Гідроліз солей.................................................................................................................................. 38
3.5. Комплексні сполуки....................................................................................................................... 40
РОЗДІЛ 4. ОСНОВИ ЕЛЕКТРОХІМІЇ...................................................................................................................... 43
4.1. Електрохімічні процеси. Електродні потенціали і електрорушійна сила............................... 43
4.2. Електроліз........................................................................................................................................ 46
4.3. Корозія металів.............................................................................................................................. 48
РОЗДІЛ 5. МЕТАЛИ ТА МАТЕРІАЛИ..................................................................................................................... 52
5.1. Метали та їх сплави........................................................................................................................ 52
5.2. Одержання металів......................................................................................................................... 55
5.3. Магній і берилій............................................................................................................................. 57
5.4. Алюміній і титан............................................................................................................................ 59
5.5. Ванадій, хром і марганець............................................................................................................. 62
5.6. Залізо, кобальт, нікель і мідь.......................................................................................................... 64
5.7. Цинк, галій, олово і свинець......................................................................................................... 66
5.8. Інструментальні і абразивні матеріали......................................................................................... 69
Рівні засвоєння навчального матеріалу:
− перший рівень – початковий – відповідь студента при відтворенні навчального матеріалу – елементарна, фрагментарна, зумовлюється початковими уявленнями про предмет вивчення;
− другий рівень – середній – студент відтворює основний навчальний матеріал, здатний розв’язувати завдання за зразком, володіє елементарними вміннями навчальної діяльності (*);
− третій рівень – достатній – студент знає істотні ознаки понять, явищ, закономірностей зв’язків між ними, а також самостійно застосовує знання в стандартних ситуаціях, володіє розумовими операціями (аналізом, абстрагуванням, узагальненням тощо), уміє робити висновки, виправляти допущені помилки; відповідь повна, правильна, логічна, обґрунтована, хоча їй бракує власних суджень (**);
− четвертий рівень – високий – знання студента є глибокими, міцними, узагальненими, системними; студент уміє застосовувати знання творчо, його навчальна діяльність має дослідницький характер, позначена вмінням самостійно оцінювати різноманітні життєві ситуації, явища, факти, виявляє і відстоює особисту позицію (***).
РОЗДІЛ 1. ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ. ХІМІЧНИЙ ЗВ'ЯЗОК.
Тема 1.1. Основні закони хімії
План
Закон збереження маси речовини
- Закон сталості складу
- Закон кратних відношень
- Закон об’ємних відношень газів
- Закон Авогадро та наслідки з закону
- Закон еквівалентів **
1. До основних законів хімії належать:
- закон збереження маси речовини (Ломоносов М.В., 1748р., Лавуазьє 1789р.)
- закон сталості складу (Ж. Пруст, 1797р.)
- закон кратних відношень (Дальтон, 1803р.)
- закон об’ємних відношень (Гей-Люссак, 1802р.)
- закон Авогадро (1811р.)
- закон еквівалентів
Закон збереження маси речовини:
Маса речовин, що вступила в реакцію, дорівнює масі речовин, що утворилися в результаті реакції.
Маса реагентів = масі продуктів реакції
Цей закон використовується при розставлянні коефіцієнтів в рівняннях реакцій, при розв’язуванні задач за рівняннями хімічних реакцій
2. Закон сталості складу:
Речовини з молекулярною структурою мають сталий якісний і кількісний склад незалежно від способу їх добування.
Цей закон дає можливість складати хімічні формули речовин та проводити за ними розрахунки.
3. Закон кратних відношень:
Якщо два елементи утворюють один з одним кілька хімічних сполук, то маси одного з елементів, які припадають у цих сполуках на ту саму масу другого, відносяться між собою як невеликі цілі числа.
Приклад: СО і СО2 містять на 12 г Карбону 16 і 32г Оксигену відповідно, тобто маси Оксигену, що припадають на одну й ту саму масу Карбону відносяться один до одного як 1:2.
Цей закон підтвердив атомну теорію будови речовин, він безпосередньо свідчить про те, що елементи входять до складу сполук лише певними порціями.
4. Закон об’ємних відношень газів:
Об’єми газів, що вступають в реакцію, відносяться один до одного і до об’ємів газоподібних продуктів реакції, що утворилися, як невеликі цілі числа.
Приклад: 2Н2 + О2 → 2Н2О(г)
V(Н2) : V(О2) : V(Н2О) = 2:1:2
Цей закон дає можливість розв’язувати задачі за рівняннями реакцій за участю газоподібних речовин.
5. Закон Авогадро:
У рівних об’ємах будь-яких газів, взятих при однаковій температурі і однаковому тиску, міститься однакове число молекул.

1 моль 1 моль 1 моль
Наслідки:
1) Однакове число молекул будь-яких газів за однакових умов займають однаковий об’єм.
2) Об’єм 1 моль будь-якого газу за нормальних умов завжди дорівнює 22,4л.
Цей закон дає можливість розв’язувати розрахункові задачі за участю газоподібних речовин за нормальних умов.
6. Іззакону сталості складу виходить, що елементи сполучаються один з одним точно визначених кількісних співвідношеннях. Тому в хімію було введено поняття еквівалента й еквівалентної маси («рівноцінний»)
Еквівалент елемента – така кількість елемента, що сполучається з 1 молем атомів Гідрогену або заміщає ту саму кількість атомів Гідрогену в хімічних реакціях. Пр.: НCl (1), H2S (1/2), NH3 (1/3).
Маса 1 еквівалента елемента називається його еквівалентною масою.
Пр.: еквівалентна маса хлору, сульфуру та нітрогену відповідно дорівнює 34,45 г/моль, 32/2 = 16 г/моль; 14/3 = 4,67 г/моль
Закон еквівалентів:
Речовини взаємодіють одна з одною у кількостях, пропорційних їхнім еквівалентам.
При розв’язуванні деяких задач зручніше користуватися іншим формулюванням закону еквівалентів:
Маси (об’єми) реагуючих одна з одною речовин пропорційні їхнім еквівалентним масам(об’ємам).
Контрольні запитання:
- Сформулюйте закон збереження маси речовини та розкрийте його практичне значення. Розставте коефіцієнти в рівнянні реакції: KClO3 → KCl + O2
- Визначте об’єм аміаку, який утворюється при взаємодії 3 л азоту з 3 л водню.
- Сформулюйте закон Авогадро і наслідки з нього.
- Який об’єм займає кисень масою 32 г за н.у.?
- Сформулюйте закон еквівалентів та розкрийте його практичне значення.
- Невідомий метал масою 18 г замістив 1,5 г Гідрогену з кислоти. Розрахуйте значення молярної маси еквівалентів металу.
Література:
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. І, §§ 4, 7, 8, 12 с. 18-19, 23-26, 31-33.
2. Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 1, § 6, с. 11-13.
Тема 1.2. Будова атома
План
1. Сучасні уявлення про будову атома. *
- Характеристика квантових чисел. **
- Розподіл електронів по рівнях і підрівнях. **
1. Довго в науці панувала думка, що атоми неподільні, тобто не містять простіших складових частин. Вважалося також, що атоми незмінні: атом певного елемента ні за яких умов не може перетворитися в атом будь-якого іншого елемента. Проте наприкінці ХІХст. було встановлено ряд фактів, які свідчать про складну будову атомів і про можливість взаємоперетворень їх.
Резерфорд у 1911р. запропонував схему будови атома, згідно якої він містив позитивно заряджене важке ядро, оточене електронами. Проте модель Резерфорда у деяких відношеннях суперечила твердо встановленим фактам:
- не пояснювала стійкості атома (за законами електродинаміки електрон, обертаючись навколо ядра, повинен в результаті втрати енергії на випромінювання «впасти» на ядро і атом припинить своє існування)
- при наближенні до ядра довжини хвиль, що випромінюються електроном, повинні безперервно змінюватися, утворюючи суцільний спектр. А спектр є лінійчатим.
Істотний крок у розвитку уявлень про будову атома зробив у 1913р. Нільс Бор, який запропонував теорію, що об’єднує ядерну модель атома з квантовою теорією світла.
Основні положення своєї теорії Бор сформулював у вигляді таких постулатів:
- Електрон може обертатися навколо ядра не по будь-яких, а тільки по деяких певних колових орбітах (стаціонарних). рухаючись по стаціонарній орбіті, електрон не випромінює електромагнітну енергію.
- При переході з однієї орбіти на іншу електрон поглинає або випромінює квант енергії.
Проте залишалось незрозумілим: де перебуває електрон у процесі переходу з однієї орбіти на іншу? Зомерфельд вдосконалив теорію Бора. Він припустив, що в атомі можуть бути не тільки кругові, а й еліптичні орбіти електронів. Недоліки теорії Бора-Зомерфельда:
- не пояснює всі деталі спектральних характеристик атомів
- не дає можливості кількісно розрахувати хімічний зв'язок.
У 1924р. де Бройль припустив, що корпускулярно-хвильова двоїстість властива електронам. Тому електрон повинен мати хвильові властивості, і для нього справджується рівняння де Бройля. Для електрона з масою і швидкістю можна написати:
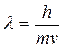
Корпускулярні властивості електрона виявляються у його здатності проявляти свою дію тільки як цілого. Хвильові властивості виявляються в особливостях його руху, дифракції і інтерференції електронів.
2. Існує система квантових характеристик електрона (квантові числа), яка визначає стан електрона в атомі.
Характеристика квантових чисел
| Головне | n | Визначає можливі енергетичні стани електрона в атомі. Чим більше n, тим більший розмір електронної хмаринки і більша енергія електрона. Набуває позитивні цілочисельні значення – 1, 2, 3, 4…, які відповідають енергетичному рівню електрона. |
| Орбітальне | l | Визначає форму електронної орбіталі. Може приймати значення від 0 до (n-1). Таким чином для: 1) n =1 - підрівень l = 0(s-стан) – сферична форма орбіта лі; 2) n =2 - підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; 3) n =3 - підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; підрівень l = 2(d-стан) – складна гантелеподібна форма 4) n =4 - підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; підрівень l = 2(d-стан) – складна гантелеподібна форма; підрівень l = 3(f-стан) 5) n =5- підрівень l = 0(s-стан) – сферична форма орбіта лі; підрівень l = 1(p-стан) – гантелеподібна форма орбіта лі; підрівень l = 2(d-стан) – складна гантелеподібна форма; підрівень l = 3(f-стан) підрівень l = 4(g- стан) |
| Магнітне | m | Визначає орієнтацію орбіта лі в просторі. Набуває цілочисленних значень від +l до –l, включаючи 0. |
| Спінове | s | Визначає стан електрона. Крім орбітального момента кількосиі руху, електрон володіє власним моментом кількості руху в результаті руху навколо своєї осі. Цей рух має назву «спін». Може приймати два значення +1/2 і -1/2 або просто + і -. |
Приклад: для атому Гідрогену характерний набір квантових чисел: n=1; l=0; m=0; s=+1/2 або -1/2.
Електронні стани, які відповідають певним значенням n, l, m позначають коміркою. Таких стани два, і вони відрізняються лише s. Комірка являється символічним зображенням певної орбіталі.
3. Заповнення електронних оболонок атомів електронами головним чином визначається принципом Паулі і правилом Гунда (Хунда).
Принцип Паулі:
В атомі не може бути двох електронів в станах, які характеризуються чотирма однаковими квантовими числами.
Цей принцип дає можливість визначити число електронів на енергетичному рівні і підрівні.
Правило Гунда (заповнення орбіталей підрівня):
В межах підрівня електрони заповнюють максимальне число орбіталей.
або
Сумарний спін електронів в даному підрівні повинен бути максимальним.
Послідовність заповнення атомних орбіталей залежно від значень головного і орбітального квантових чисел дослідив Клечковський, який встановив, що енергія електрона зростає із збільшенням суми цих двох квантових чисел.
Правила Клечковського:
1) При збільшенні заряду ядра атома послідовне заповнення електронних орбіталей відбувається від орбіталей з меншим значенням суми головного і орбітального квантових чисел до орбіталей з більшим значенням цієї суми.
Електронна будова атомів калію і кальцію відповідає цьому правилу. Для 3d-орбіталей (n=3, l=2) сума дорівнює 5, а для 4s-орбіталі (n=4, l=0) дорівнює 4. Раніше заповнюється 4s-підрівень.
2) При однакових значеннях суми (n+l) заповнення орбіталей відбувається послідовно у напрямі зростання значення головного квантового числа n.
Контрольні запитання:
- Постулати Бора. Недоліки теорії Бора.
- Запишіть квантові числа для останнього електрона атома Карбону.
- Сформулюйте правила Клечковського.
- Яка орбіталь буде заповнюватися першою 5s або 4f? Відповідь обґрунтуйте розрахунками.
- Складіть електронні та графічні формули атомів алюмінію, кадмію, вольфраму.
Література:
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. - Гл. ІІІ, §§ 20-32 с. 57-99.
2. Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. І, Гл. 2, §§ 9-12, 14, с. 16-23.
Тема 1.3. Будова речовин
План