Кафедра химии, физики и биологии
Занятие № 8 по Химии.
Руководство для студентов.
Тема:Коллигативные свойства растворов
Коллигативными называют свойства разбавленных растворов неэлектролитов и электролитов, которые определяются суммарной концентрацией всех частиц в растворе, в виде которых растворённое вещество присутствует в нём. Это могут быть молекулы, ионы, ассоциаты, коллоидные частицы.
Если в растворе молярная концентрация растворённого вещества равна С0 , то реальная концентрация частиц в нём может быть или равна С0,если молекулы растворённого вещества не видоизменяются в растворе, или больше С0, если растворённое вещество диссоциирует на ионы, или меньше С0, если образуются ассоциаты растворённых частиц.
Пример: Уксусная кислота СН3СООН или НАс в зависимости от природы растворителя находится в растворе в разных формах:
а) В неполярных растворителях, например в хлороформе, кислота присутствует или в виде мономера НАс, или в виде димера (НАс)2, который образуется за счет водородных связей между молекулами:
 |
Таким образом, реальное число частиц в растворе меньше, чем число растворённых молекул уксусной кислоты и Счастиц < C0.
б) В водных растворах уксусной кислоты она присутствует в виде недиссоциированных молекул НАс, а часть их диссоциирует на ионы
НАс«Н+ + Ас- поэтому реальное число частиц в растворе становится больше и Счастиц > C0.
Изменение числа частиц в растворе учитывают с помощью изотонического коэффициента i, который показывает во сколько раз изменяется реальная концентрация всех видов частиц (Счастиц) относительно концентрации приготовленного раствора С0: 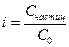 (1)
(1)
Для неэлектролитов i =1, для электролитов i>1, для веществ, молекулы которых ассоциируют в растворе, i <1.
Установим связь между степенью диссоциации электролита AnBm и изотоническим коэффициентом :
AnBm « nAz+ + mBz-
начало С0 - -
равновесие С0(1-α) n αС0 m αС0
По определению (1)
 (2)
(2)
Из полученного результата вытекают частные случаи:
а) Для неэлектролита a = 0 и согласно (2) величина i = 1
б) Для сильного электролита a = 1 и величина i = m + n , т.е. суммарному числу ионов, на которые диссоциирует одна молекула электролита.
Замечание: Экспериментально определённые величины i для растворов сильных электролитов оказываются меньше, чем ( m + n), что связывает с присутствием в растворе некоторого числа ионных пар – ассоциатов ионов, отделенных друг от друга их гидратными оболочками. Последнее обстоятельство приводит к кажущемуся снижению степени диссоциации электролита, определенному по формуле (2), aкаж<1. При разбавлении раствора aкаж®1 и i® (m + n).
в) Для слабых электролитов 0 < a << 1 и 1 < i << (m + n)
Примеры:
| Вещество | Nа Сl | Na2SO4 | CaCl2 | Мочевина | Al2(SO4)3 |

|
Суммарная концентрация всех видов частиц в растворе называется его осмолярностью:
Сосм.= i C0 (3)
Если в растворе присутствует несколько растворённых веществ, то осмолярность раствора рассчитывается как сумма осмолярных концентраций каждого компонента раствора:
 (4)
(4)
Пример: Рассчитать осмолярность растворов:
а) 0,01М раствор глюкозы  i = 1
i = 1  Сосм.=iC0 = 0,01М
Сосм.=iC0 = 0,01М
б) 0,01М раствор хлорида кальция СаСl2  i = 3
i = 3  Сосм.= iC0 = 3*0,01 = 0,03 М
Сосм.= iC0 = 3*0,01 = 0,03 М
в) Смешанный раствор, содержащий 0,01М глюкозы и 0,01М СаСl2

г) Смешанный раствор, содержащий 0,01М мочевины, 0,005М Са2+, 0,01М Na+ и 0,02М Cl-
Сосм = 0,01+0,005+0,01+0,02 =0,045М