Пептидная связь. Первичная структура белков
Аминокислоты, алфавит для белков, органическое соединение, которое имеет в своем составе как амино-, так и карбоксильную группу, соединнёные с одним и тем же альфа-углеродным атомом. Плюс еще имеется радикал аминокислот, которые создает уникальное различие, благодаря химическим свойствам. Всего в построении белков человека учавствует 20 аминокислот.
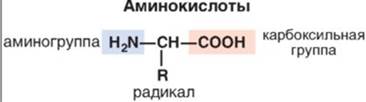
Их можно разделить по химическому строению на:
- алифатические;
- ароматические;
- гетероциклически.
Также радикалы можно выстроить в непрерывный ряд, от полностью гидрофобных до сильно гидрофильных.
Пептидная связь - связь между альфа-карбоксильной группой одной аминокислоты и а-аминогурппой другой, т.е. есть амидная связь. При этом образуется молекула воды.
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках. Для этого нужны специальные протеолиические ферменты, называемые протеазы или пептидогидролазами.
Первичная структура есть линейная последовательность аминокислотных остатков в полипептидной цепи. Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом генов. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем используется как чертеж для сборки первичной структуры белка.
Зависимость биологических свойств белков от первичной структуры.
Видовая специфичность первичной структуры белков (инсулины
Разных животных).
Что есть первичная структура, как не чертеж, не сценарий, для белка? Знаки и символы - есть аминокислоты, что построены в определеном порядке и от этого отталкивается когда формирует третичную структуру. Третичная структура формирует активный центр, а именно он обеспечивает взаимодействие с лигандам, т.е. к выполнению функций белка.
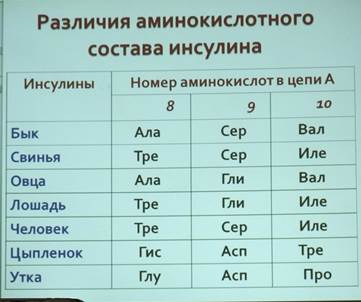
Видовая специфичность обеспечивается за счет различий в последовательности аминокислот в первичной структуре белка. Пример инсулина выше.
Конформация пептидных цепей в белках (вторичная и третичная
Структуры). Слабые внутримолекулярные взаимодействия в пептидной
Цепи; дисульфидные связи.
Конформация белка есть определенная пространственная структура белка образующаясь за счет взаимодействия функциональных групп аминокислот.
Различают два основных вида конформации - вторичная и третичная структура.
Вторичная структура имеет два основных представителя - альфа спираль и бета-структура.
Альфа-спираль - вторичная структура, она формируется за счет водородных связей между атомами кислорода карбонильных групп и атомами водорода аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. На один виток спирали приходится 3,6 аминокислотных остатка. В образовании участвуют практически все атому водорода и кислорода пептидных групп. Связи сами по себе слабые, но их много.
Бета-структура -также вторичная структура, формирующаясь за счет образования множества водородных связей между атомами пептидных цепи, делающей изгибы, или между разными полипептидными цепями. Структура образует фигуру, подобную листу, сложенную "гармошкой" - бета-складчатый слой.
Третичная структура - трехмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, котроые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Виды связей:

Дисульфидные связи - ковалентная связь между SH-группами двух остатков цистеина.