Фізико-хімічні основи технологічних процесів
О. К. Горлов, Є. П. Рогачов, С. М. Лашко
Фізико-хімічні основи технологічних процесів.
ЗВАРЮВАННЯ
Частина 1
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Національний аерокосмічний університет Ім. М. Є. Жуковського
«Харківський авіаційний інститут»
О. К. Горлов, Є. П. Рогачов, С. М. Лашко
Фізико-хімічні основи технологічних процесів.
ЗВАРЮВАННЯ
Частина 1
Харків «ХАІ» 2010
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Національний аерокосмічний університет Ім. М. Є. Жуковського
«Харківський авіаційний інститут»
О. К. Горлов, Є. П. Рогачов, С. М. Лашко
Фізико-хімічні основи технологічних процесів.
ЗВАРЮВАННЯ
Частина 1
Харків «ХАІ» 2010
УДК 62.002:621.791
Горлов О. К. Фізико-хімічні основи технологічних процесів. Зварювання: навч. посібник / О. К. Горлов, Є. П. Рогачов, С. М. Лашко. – Х.: Нац. аерокосм. ун-т „Харк. авіац. ін-т”, 2010 – Ч.1. – 72 с.
Викладено фізико-хімічні основи зварювання плавленням. Дано уявлення про сукупність металургійних процесів, що впливають на утворення з'єднань. Показано принципові труднощі, які перешкоджають утвореннюзварних з'єднань.Описано закономірності атомно-кристалічної будови металів з позицій утворення нерознімного з’єднання, металургійні процеси при різних способах захисту зони зварювання.
Для студентів механічних спеціальностей при самостійному вивченні відповідних розділів курсів „Зварювання в авіації”, „Фізико-хімічні основи технологічних процесів”.
Іл. 25. Табл. 24. Бібліогр.: 9 назв.
Рецензенти: канд. техн. наук М.Ф. Савченко, О.Ю. Шигімага
© Національний аерокосмічний університет ім. М. Є. Жуковського
„Харківський авіаційний інститут”, 2010
©О. К. Горлов, Є. П. Рогачов, С. М. Лашко, 2010
ВСТУП
Зварювання є одним з провідних технологічних процесів створення матеріальної основи сучасної цивілізації. До 70% світового використання сталевого прокату йде на виробництво зварних конструкцій і споруд.
Зварювання можна використовувати для з’єднання практично будь-яких металів і неметалів (пластмас, скла, кераміки та ін.) в будь-яких умовах – на землі, в морських глибинах і космосі. Товщина зварюваних деталей становить від мікрометрів до метрів, маса зварних конструкцій – від часток грама до сотень і тисяч тонн.
Часто зварювання є найбільш ефективним або єдиним способом створення нерознімних з’єднань конструкційних матеріалів і ресурсозберігаючих заготовок, максимально наближених за геометрією до оптимальної форми готової деталі або конструкції.
Утворення зварного з’єднання у зв’язку з уведенням концентрованої енергії в його зону супроводжується комплексом складних фізичних і хімічних процесів, що відбуваються одночасно, основними з яких є:
– розплавлення основного і електродного металів, їх перемішування;
– дифузія елементів у зоні контакту твердого й рідкого металів;
– хімічні реакції, що здійснюються у газовій і рідкій фазах і на їхніх межах;
– кристалізація розплавленого металу в об’ємі зварювальної ванни та в зоні плавлення;
– теплова дія на метал в зоні термічного впливу, утворення власних зварювальних напружень і деформацій та ін.
Фізико-хімічні процеси, що відбуваються при зварюванні, відрізняються від аналогічних процесів, характерних для виплавлення сталі, такими особливостями:
– швидкостями і напрямом реакції, що пов’язано з високою температурою в зоні зварювання;
– невеликим об’ємом рідкого металу в зварювальній ванні;
– короткочасністю існування металу в розплавленому стані та ін.
Велике значення має також енергійна безперервна фізична й хімічна взаємодія розплавленого металу з газовою атмосферою, шлаками, основним металом. Внаслідок цього склад зварного шва може відрізнятися від складів електродного і основного металів.
Вплив фізико-хімічних процесів, які відбуваються в зварному шві, на якість з’єднання є настільки значним, що слід розглянути це питання детальніше.
1 ФІЗИКО-ХІМІЧНІ ПРОЦЕСИ ПРИ ЗВАРЮВАННІ
1.1 Загальні відомості
Існує три стани речовини, що розрізняються між собою силами взаємодії атомів і молекул: твердий, рідкий і газоподібний. Перехід речовини з одного стану в інші супроводжується значними витратами енергії, що прикладаються зовні.
Для твердого й рідкого станів є характерними невеликі відстані між молекулами, між якими діють сили взаємного притягання. При переході речовини в рідкий, а потім у газоподібний стан ці відстані збільшуються, а сили їхньої взаємодії знижуються. Цей процес наочно можна спостерігати під час зварювання, коли метал плавиться, частково переходить у газоподібний стан, а потім виникають зворотні процеси, названі кристалізацією.
Процес плавлення металу в зоні зварного шва викликає виникнення складних фізико-хімічних процесів й утворення характерного з'єднання, що відрізняється за своєю структурою від основного металу.
До фізичних належать процеси, які, змінюючи фізичні властивості речовини, не змінюють будову елементарних часток, з яких складається ця речовина, а також її хімічні властивості.
До таких процесів належать:
- електричні, теплові, механічні явища в джерелах нагрівання;
- проходження електричного струму й теплові коливання кристалічних ґраток;
- перехід основної й електродної речовини з твердого стану в рідкий (плавлення), перемішування їх між собою, кристалізація металу в зоні зварювальної ванни;
- напруги й деформації, що виникають у кристалічних ґратках зварного шва й прилеглій до нього зоні основного металу.
Хімічні процеси змінюють будову елементарних часток, з яких складається ця речовина, у результаті чого створюються нові речовини з новими хімічними й фізичними властивостями.
До основних хімічних процесів належать хімічні реакції в газовій і рідкій фазах, на межах фаз (газової з рідкою, газової з твердою, рідкої з твердою) при взаємодії компонентів покриттів, флюсів, захисних газів з рідким металом з утворенням окислів, шлаків та інших сполук, що відрізняються своїми хімічними властивостями від основного металу.
Фізичні й хімічні процеси при зварюванні поєднані в часі й просторі, тому їх можна віднести до загального поняття – фізико-хімічні процеси.
1.2 Принципові труднощі, що перешкоджають
утворенню зварних з'єднань
Відповідно до другого закону термодинаміки кожна система прагне прийти в стан, при якому вона має мінімальний запас внутрішньої енергії. Однією зі складових внутрішньої енергії є поверхнева енергія. Чим менше величина поверхневої енергії, тим система є більш стійкою. При утворенні зварного з'єднання зменшується поверхня деталей, отже, й величина поверхневої енергії. Тому теоретично процес утворення зварного з'єднання має відбуватися мимовільно й з виділенням енергії. Однак на практиці для створення зварного з'єднання доводиться витрачати енергію величиною до 103…104 Дж/моль. Причиною цього є ряд проблем.
У твердому металі атоми розташовуються в певному порядку, утворюючи кристалічні ґрати. Кожний вид кристалічних ґрат металу характеризується параметром а, тобто відстанню між сусідніми атомами. Для більшості металів параметр кристалічних ґрат становить (3…5)А0 (1А0=10-10м). Отже, для забезпечення міжатомних зв'язків між поверхневими атомами деталей, що зварюють, необхідно їх зблизити на величину параметра кристалічних ґрат, тобто приблизно на 1А0.
Однак навіть при самому якісному механічному обробленні поверхні металів (шліфуванні, поліруванні) висота мікронерівностей поверхні становить (103…104)А0. У цих умовах фізичний контакт деталей, що зварюють, здійснюється тільки на окремих мікронерівностях, що не забезпечує необхідної міцності з'єднання.
Крім того, утворенню зварного з'єднання перешкоджають окісні плівки, забруднення на поверхні деталей. Усередині металу кожний атом утримується у своєму положенні силами зв'язку з симетрично розташованими щодо оточуючих його з усіх боків атомами. На вільній поверхні кристала або рідини атом виявляється неврівноваженим внаслідок відсутності зв'язку з одного або двох напрямків. Ця обставина обумовлює підвищення енергії поверхневого шару. Досить 10-6…10-7 с, щоб валентні зв'язки поверхневих атомів виявилися насиченими внаслідок взаємодії з навколишнім середовищем. Товщина поверхневих забруднень, отриманих за допомогою молекулярних сил взаємодії поверхневих атомів (сил Ван-дер-Ваальса), дорівнює величині 103…104 А0. Отже, крім необхідності забезпечити фізичний контакт на всій поверхні з’єднання деталей, що зварюють, треба спочатку очистити ці поверхні від різноманітних забруднень.
Існує ще й третя проблема у встановленні міжатомної взаємодії деталей. Кожний атом, що знаходиться всередині кристала, утримується симетрично спрямованими силами. На вільній поверхні, як уже було відзначено вище, атом є неврівноваженим внаслідок відсутності або ослаблення зв'язків із зовнішнім середовищем. Тому поверхневий атом буде мати більший запас потенційної енергії.
З’єднання деталей зі знищенням вільної поверхні має супроводжуватися звільненням енергії. Для зміни положення атом має перебороти енергетичний бар'єр. Для цього йому потрібно надати додаткову енергію. Ця енергія називається енергією активації, завдяки якій підвищується енергія атомів до рівня «бар'єра» схоплювання.
Енергія активації витрачається на подолання сил відштовхування, що виникають між зближуваними поверхневими атомами. Коли відстань між ними буде дорівнювати міжатомним відстаням у ґратах кристалів, виникнуть квантові процеси взаємодії електронних оболонок атомів. Після цього загальна енергія системи почне зменшуватися до рівня, що відповідає енергії атомів у ґратах цілого кристала. Чим вище температура, тим меншою буде необхідна енергія активації.
Отже, процес зварювання має кілька стадій. На першій стадії розвивається фізичний контакт до рівня, необхідного для міжатомної взаємодії. На другій стадії відбувається хімічна взаємодія з утворенням з'єднання. У макрообсягах процес зварювання завершується третьою стадією – дифузією атомів углиб тіла.
Всі існуючі способи зварювання – це різні технологічні прийоми подолання принципових труднощів, що перешкоджають об'єднанню кристалів.
Енергія активації може передаватися зварюваним деталям у вигляді:
– теплоти (термічна активація);
– пружно-пластичної деформації (механічна активація);
– електронного, іонного й інших видів опромінення (радіаційна активація).
Найчастіше застосовують який-небудь один з перших двох видів активації або обидва разом.
Енергія при зварюванні витрачається на таке:
– пружну й пластичну деформації, необхідні для зближення поверхонь, що з'єднують;
– обривання зв'язків між атомами тіла й молекулами (атомами) зовнішнього середовища, що насичують їхні вільні зв'язки;
– підвищення енергії поверхневих атомів до рівня енергетичного «бар'єра» схоплювання, тобто для переходу їх в активний стан.
При зварюванні тиском якісне нероз'ємне з'єднання утвориться при зближенні зварюваних поверхонь на відстань, що дозволяє реалізуватися силам міжатомної взаємодії і установити електронний обмін між збудженими (активованими) атомами на цих поверхнях. Тому для цього виду зварювання мають значення природа атомів, що вступають у контакт, умови активації атомів і чинники, що перешкоджають активації, а також характер міжатомних зв'язків зварюваних поверхонь.
При зварюванні плавленням для спільної кристалізації металу шва і оплавленого металу деталей, що зварюють, має значення характер взаємодії атомно-кристалічних ґрат у твердо-рідинному і твердому станах, природа зв'язків та інше, що пов'язане з атомно-кристалічною будовою цих металів.
Різноманіття хімічних і фізичних властивостей елементів і, в тому числі, здатність атомів до взаємодії з утворенням зв'язку того або іншого ступеня міцності, визначається різницею в електронній будові.
1.3 Закономірності атомно-кристалічної будови металів
Елементарною комплексною основою елементів, в тому числі металів, є атом, що складається з позитивно зарядженого ядра й негативно заряджених електронів, що обертаються на різній відстані від ядра. У цілому атом є електрично нейтральним.
Електрони в атомах знаходяться на різній відстані від ядра, що визначає їхній енергетичний рівень і міцність зв'язку з ядром. Чим ближче розташовані один до одного протилежно заряджені ядро і електрони, тим сильніше вони взаємно притягаються. Крім різної відстані від ядра, стан електронів визначається орбітами, вздовж яких вони обертаються. Орієнтування орбіт у просторі може бути різним. Такі орбіти можуть бути круговими з ядром у центрі й еліптичними з різним ступенем еліптичності. Крім того, сам електрон обертається навколо своєї осі й напрямок цього обертання може бути в різних електронів різним.
Стан та енергія електронів в атомі визначаються чотирма квантовими числами. Головне квантове число n характеризує енергію й розмір електронної орбіталі й збігається з номером періоду елемента в періодичній системі елементів Д. І. Менделєєва. Воно може набувати цілих значень від 1 до 7, що свідчить про можливість наявності в різних елементах від одного до семи головних енергетичних електронних рівнів. Орбітальне квантове число lвизначає енергію, орбітальний момент кількості руху та форму орбіталі (змінюється від 0 до n-1). Магнітне квантове число ml характеризує просторове положення тієї або іншої орбіталі, а також магнітний момент електрона відносно ядра. Воно змінюється від -l до +l й має значення тільки цілих чисел. Спінове квантове число характеризує власне обертання електрона навколо своєї осі, має тільки два значення: +1/2 й -1/2. Обертання може бути в одну або іншу сторону.
В атомі не може бути двох електронів з однаковими чотирма числами (принцип заборони Паулі).
Енергетичні показники зв'язку між електронами і ядром, а також зв'язок між собою атомів тих же самих елементів й атомів різних елементів залежать від загального числа електронів в атомі, їхнього розташування за електронними рівнями, від ступеня заповнення електронних рівнів або підрівнів, загального числа електронних рівнів, стану останнього зовнішнього електронного рівня, а також від того, чи є спіни сусідніх електронів цього підрівня і особливо електронів зовнішньої оболонки взаємно врівноваженими.
Відповідальними за створення міжатомного зв'язку, що характеризується прагненням атома одержати завершену електронну оболонку, є зовнішні електрони, що найслабкіше пов'язані з ядром. Кількість цих електронів визначає валентність атома, а ступінь заповнення зовнішньої оболонки – його активність або здатність вступати в з'єднання з іншими атомами. Там, де зовнішня оболонка повністю заповнена, атом речовини виявляється практично пасивним до утворення зв'язків.
Здатність атомів тієї ж самої речовини або різних речовин з'єднуватися один з одним у міцний агрегат – утворювати нероз'ємне з'єднання – є найважливішим чинником при зварюванні металів і особливо при зварюванні тиском у твердому стані.
Серед багатьох показників, пов'язаних з особливостями атомної будови металів, для зварювання найбільше значення мають такі:
– міцність зв'язку найлегше відокремлюваних електронів зовнішньої оболонки з ядром або іоном;
– тип і міцність зв'язку між атомами;
– показник вільної енергії поверхні.
Атоми різних елементів відрізняються між собою кількістю електронних оболонок (енергетичних рівнів, на яких розташовані електрони). Чим більше головне квантове число електронної оболонки, тим далі електрони розміщені від ядра, тим більшою є їхня вільна енергія, тим слабкіше вони пов'язані з ядром.
Має значення не тільки збільшення відстані цих електронів від ядра й зменшення сили взаємодії електрона і ядра, але й вплив проміжних електронних оболонок. Електрони зовнішніх оболонок в атомі можуть при відповідних умовах віддалятися від ядра, взагалі його залишати, переходячи, наприклад, до іншого атома, у якого зовнішня оболонка має більш низький енергетичний рівень і вільне місце (незаповнене). Таким чином, одним з факторів, що визначають з'єднання атомів, є енергетичний стан електронів на зовнішній оболонці – валентних електронів: чим слабкіше вони пов'язані з ядром цього атома, тим легше переходять до утворення зв'язку з іншим атомом.
Велике значення для міцності зв'язку зовнішніх електронів з атомом має ступінь заповнювання зовнішньої оболонки. Чим повніше заповнена зовнішня оболонка, тим міцніше закріплені на ній електрони. Атоми з одним електроном на зовнішній оболонці легше всього його віддають.
На міцність закріплення зовнішнього електрона у «свого» атома також впливає утворення замкнутих магнітних полів, створюваних спінами електронів (обертанням електронів навколо своєї осі). Якщо атом має два зовнішніх електрони з антипаралельними спінами (що обертаються в різних напрямках), тобто четверте квантове число у одного -1/2, у іншого +1/2, то магнітні поля, що створюються при обертанні електрона, утворять більш замкнуте магнітне поле, що сприятиме утриманню кожного з електронів. Якщо розглядати з'єднання двох різних атомів (зварювання різних металів), то наявність на зовнішніх оболонках атомів з протилежними спінами має обумовлювати утворення врівноважених магнітних полів і поліпшення зварюваності.
Сила, з якою утримується електрон у «своєму» атомі (мова звичайно йде про зовнішні електрони), визначається іонізаційним потенціалом – напругою, яку необхідно прикласти, щоб відірвати електрон і зробити атом позитивно зарядженим іоном. Іонізаційний потенціал є важливим показником здатності атомів до встановлення міжатомних зв'язків. В атомі може бути кілька іонізаційних потенціалів відповідно до того, скільки у нього електронів на зовнішній оболонці і який за рахунком електрон відривається. Чим нижче потенціал іонізації атома, тим легше зробити атом активним для встановлення зв'язку . Так, серед металів, що використовують у техніці, легше всього мають зварюватися у твердому або пластичному стані деталі з алюмінію (іонізаційний потенціал – 5,98 еВ), трохи складніше – титан (6,82 еВ), потім – ніобій (6,88 еВ), молібден (7,1 еВ), свинець (7,42 еВ), срібло (7,57 еВ), нікель (7,63 еВ), магній (7,64 еВ), мідь (7,72 еВ), залізо (7,8 еВ), вольфрам (7,98 еВ).
Найбільш високі потенціали іонізації мають елементи з повністю заповненою зовнішньою оболонкою (інертні гази). Найнижчі потенціали мають елементи з найменш заповненими оболонками. У міру збільшення атомного номера елемента виявляється екранованим вплив внутрішніх електронних рівнів.
Для міцності міжатомного зв'язку велике значення має його тип, тобто спосіб і принцип з'єднання атомів між собою. Основою міжатомного зв'язку й, отже, утворення нероз'ємних з'єднань є взаємодія електронів, а рушійною силою цієї взаємодії – прагнення атомів одержати завершені електронні оболонки та досягти найбільш стійкого розподілу електронів за рівнями й підрівнями. Таким чином, при взаємодії кожен з атомів різних речовин шляхом віддачі або захвату електронів прагне придбати найближчу йому стійку електронну будову.
1.4 Сили зв'язку в твердих тілах
Розгляд природи зв'язку між атомами має першорядне значення як для розуміння умов утворення різних з'єднань, в тому числі зварних, так і для розроблення нових процесів і нових видів зварних з'єднань.
Іонний зв'язок. Усі іонні кристали являють собою хімічні сполуки. Іонний зв'язок (рис. 1,а ) утворюється між атомами двох видів: одні з них легко втрачають електрони, створюючи позитивно заряджені
іони – катіони, інші – легко приєднують електрони, утворюючи негативно заряджені іони – аніони. Іонний зв'язок виникає між по-різному зарядженими атомами.
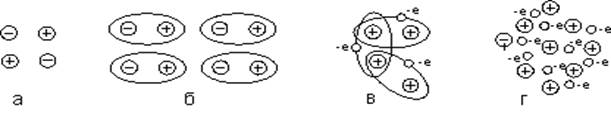
Рисунок 1 – Типи зв’язків між атомами:
а – іонні; б – ковалентні; в – молекулярні; г – металеві
Між утвореними іонами виникають кулонівські сили притягання, які на близьких відстанях урівнюються силами відштовхування між електронними оболонками сусідніх атомів. Ці сили визначають стійкість іонного кристала.
Для іонних кристалів є характерними високі температури плавлення, міцність, твердість, крихкість, теплота сублімації, діамагнетичні властивості.
Ковалентний зв'язок. Цей зв'язок виникає між атомами з однаковою або майже однаковою валентністю внаслідок присвоєння парою атомів (рідше більшою кількістю) валентних електронів із протилежно спрямованими спінами (рис. 1,б).
Таке об'єднання створює для електронів загальну орбіту з двома ядрами всередині й може бути безперервним унаслідок того, що різні електрони зовнішньої оболонки спарюються з відповідними електронами різних атомів. У результаті утворюється тверда частка розміром, що залежить від кількості певної речовини.
Для кристалів із ковалентними зв'язками є характерними: високі температура плавлення, теплота сублімації, твердість, пружність, крихкість. За електричними властивостями ковалентні кристали належать до напівпровідників і діелектриків, але в деяких металах також є значна частка ковалентних зв'язків.
Стосовно до зварювання й пайки ковалентні зв'язки встановлюються при з'єднанні металів з неметалами.
Молекулярний зв'язок (Ван-дер-Ваальса). Це слабкий електростатичний зв'язок, обумовлений силами притягання між миттєвими електричними диполями, які виникають унаслідок руху електронів в атомах і молекулах. При зближенні атомів електрони кожного з них зміщуються відносно ядра. Внаслідок координації руху електронів в електронних оболонках та індуктивного перерозподілу зарядів відбувається взаємна поляризація атомів і з'являються сили Ван-дер-Ваальса (рис. 1,в).
Сили Ван-дер-Ваальса діють у різних кристалах незалежно від природи атомів, але вони досить слабкі. За наявності значно сильнішої міжатомної взаємодії (іонного, ковалентного або металічного зв'язків) ці сили практично не мають ніякого значення.
Для молекулярних кристалів є характерними низькі температура плавлення й теплота сублімації та високий коефіцієнт термічного розширення.
Нехарактерними для металів є найбільш слабкі міжмолекулярні (Ван-дер-Ваальсові) сили, що використовують при зварюванні пластмас.
Металевий зв'язок. Цей зв'язок обумовлено валентними електронами. Вони слабко пов'язані з атомом, рівномірно розподіляються та легко рухаються в просторі між атомами, які з'єднуються в кристал.
Слабкий зв'язок зовнішнього електрона приводить до того, що в атомному агрегаті ці електрони відриваються й безладно блукають між позитивними (тими, які залишилися) іонами, що утворилися (рис.1,г).
Електрони присвоюються не декількома атомами кристала, як у випадку ковалентного зв'язку, а всіма атомами, тобто утворюють електронний "газ", що заповнює весь кристал (рис.1, г). Позитивні іони металу, які виникли внаслідок втрати валентних електронів, утворюють кристалічну ґратку.
На рис. 2 показано характер енергетичної взаємодії двох позитивно заряджених часток рухливих електронів, що знаходяться у полі цієї взаємодії залежно від відстані між цими частками. Сили притягання (зокрема, гравітаційні) при зближенні часток зростають повільніше, ніж сили відштовхування (зокрема, для двох однаково заряджених часток), і при деякій відстані r0між частками вони врівноважуються. Потенційна енергія має мінімум Uminпри деякій відстані r0.
Якщо розглянути не окремо взяті дві частки, а значну їхню кількість з певною системою геометричного взаєморозташування, то від 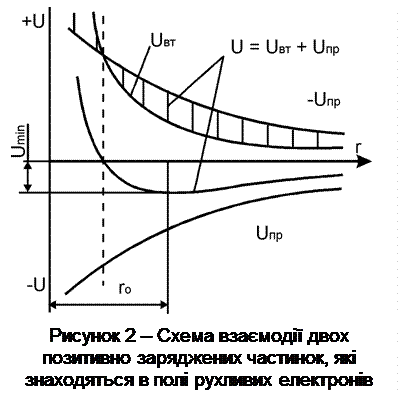 стань, що є подібною r0, буде визначати параметр кристалічної ґратки речовини (металу) при певній температурі. Звичайно для більшості металів параметр кристалічної ґратки становить (3...5)10-10м.
стань, що є подібною r0, буде визначати параметр кристалічної ґратки речовини (металу) при певній температурі. Звичайно для більшості металів параметр кристалічної ґратки становить (3...5)10-10м.
Відстань r0 – параметр ґратки – не залишається сталим. Це тільки деяка середня відстань між частками, які коливаються біля свого середнього положення. Звичайно амплітуда коливань при нормальних температурах становить 5…10 % середньої міжатомної відстані й має значні флуктуації. З підвищенням температури ці теплові коливання збільшуються так само, як збільшується параметр ґрат, що в цілому ослаблює взаємозв'язки.
Взаємодія між іонами та валентними електронами визначає стійкість усієї системи.
Утворення металічного зв'язку в кристалах обумовлено двома принципово важливими явищами:
1. Кожний атом набуває структури попереднього інертного газу й виникають відповідні зменшенню енергії сили притягання.
2. Колишні валентні електрони атомів стають узагальненими, тобто утворюється електронний газ, що належить усьому кристалу.
Електронний газ компенсує сили відштовхування між іонами і об’єднує їх у тверде тіло.
Для металів є характерними три основних типи кристалічних ґраток:
1.ОЦК – об'ємно-центрована кубічна ґратка (рис. 3, а). Таку ґратку мають: Li , Na , K , Ba , Cr , Mo , W , V , Fe при температурі більше 13920С и менше 9110С;
2. ГЦК – гранецентрована кубічна ґратка (рис. 3, б). Таку ґратку мають: Ag , Au , Pt , Cu , Al , Fe при температурі 911…1392 0С;
3.ГЩУ – гексагональна щільно упакована ґратка (рис. 3, в). Таку ґратку мають: Mg , Ti , Zn , Y , Be , La.
Для кристалічних ґраток різних металів є характерною різна відстань між базовими атомами, тобто атомами, що утворюють геометричну фігуру. Наприклад, у кубічних ґраток це – розмір ребра куба – відстань між центрами атомів, що розташовані у його вершинах. Цю відстань називають параметром ґратки, у кубічних ґраток – один параметр а, у гексагональної – два: а й с (див. рис. 3).

Рисунок 3 – Кристалічні ґратки металів:
а – ОЦК; б – ГЦК; в – ГЩУ
Фізичні явища, що відбуваються у металах, можна класифікувати таким чином: метал складається з двох підсистем – легкої та важкої. Легка підсистема – це колишні валентні електрони атомів металу, що є дуже рухливими й миттєво реагують на будь-яке електромагнітне поле. Важка підсистема – це атоми, які в процесі кристалізації втратили свої валентні електрони. У кристалічних металах вони знаходяться у вузлах кристалічної ґратки. В аморфних металах вони не утворюють у просторі правильні геометричні структури, але деякі ознаки впорядкованості в їхньому розташуванні існують. В обох випадках атоми знаходяться у постійному русі. Оскільки валентні електрони стають спільними для всієї важкої системи, то металічний зв'язок не є спрямованим, чим обумовлено пластичність і здатність металу до деформування.
У металах існує три види явищ, що пов'язані з їхньою будовою [10]: явища, в яких легка підсистема (електронний газ) виявляє свої властивості автономно (електропровідність при низьких температурах, парамагнетизм вільних електронів тощо); явища, в яких важка підсистема (атоми) виявляє свої властивості значною мірою незалежно від електронного газу (пластичні властивості, ґраткові теплоємність і теплопровідність, теплове розширення тощо); явища, сутність яких полягає в сильній безпосередній взаємодії легкої й важкої підсистем (електропровідність, надпровідність, електрофізичні властивості у високочастотних полях).
Наведена вище класифікація фізичних явищ у металах є умовною, оскільки не можна відокремити одну підсистему від іншої. Наприклад, високу пластичність металів обумовлено самою природою металевого стану, а саме – неспрямованістю металічнихзв'язків. Однак така класифікація дозволяє виділити основні риси й характерні особливості явищ. Відповідно виділяють електронні властивості металів (термоелектронну емісію, надпровідність, електричний опір тощо), які пояснюються самою електронною системою і її взаємодією з ґраткою.
Валентна зона металів містить незайняті рівні безпосередньо над рівнем Фермі. При передачі незначної енергії електрони можуть переходити на незайняті рівні, тобто збуджуватися. Низька енергія збудження електронів характеризує тепло- і електропровідність металів.
Присвоювання валентних електронів у металах приводить до того, що в твердому стані металу вони займають більш низькі енергетичні рівні, ніж в ізольованому атомі, і забезпечують енергію зв’язку у твердому тілі аналогічно з утворенням хімічного зв’язку.
Таблиця 1 – Тип і параметр ґратки металів
| Метал | Fe | Fe | Ni | Al | Mg | Cu | Cr | W | Ag | Ti |
| Тип ґратки | ОЦК | ГЦК | ГЦК | ГЦК | ГЩУ | ГЦК | ОЦК | ОЦК | ГЦК | ОЦК |
| Параметр ґратки,нм | 2,9 | 3,6 | 3,5 | a=3,5 c=5,2 | 3,6 | 2,9 | 3,1 | 4,1 | 3,3 | |
| Атомний радіус, нм | 1,24 | 1,24 | 1,25 | 1,43 | 1,6 | 1,28 | 1,25 | 1,36 | 1,44 | 1,44 |
При зварюванні однорідних металів, які мають ідентичні кристалічні ґратки, здатність до з'єднання визначається в основному розглянутими закономірностями електронної будови атомів цього металу. При зварюванні різнорідних металів важливого значення набуває їхня атомно-кристалічна будова. Чим меншою є різниця в атомно-кристалічній будові металів, тим легше вони з'єднуються при зварюванні. Схожість атомно-кристалічної будови металів, що з'єднують, означає подібність енергетичного стану їхніх атомів. Це свідчить про те, що атоми одного зварюваного металу здатні енергетично сприятливо розташовуватися в кристалічних ґратках іншого металу. Ознакою цього є рівність величин атомних радіусів, а також подібність типів і параметрів кристалічних ґраток.
1.5 Фізико-механічні процеси встановлення міжатомних
зв'язків у зварних з'єднаннях
Існують три основні форми встановлення міжатомних зв'язків при зварюванні металів, кожна з яких є основною для свого класу зварювальних процесів.
Всі зварювальні процеси, що входять до механічного класу зварювання, за винятком зварювання тертям, здійснюються без попереднього нагрівання деталей.
Холодне зварювання – один з видів зварювання у стані твердої фази зі значною об'ємною пластичною деформацією. Основним технологічним варіантом цього типу зварювання є спільна пластична деформація деталей, які з'єднують, у результаті прикладення сил, нормальних до поверхні з'єднання. В основі холодного зварювання лежить явище, що одержало назву «схоплювання». Досить часто це явище також називають адгезією (для різнорідних металів) або когезією (для однорідних металів). Для одержання якісного з'єднання є необхідним значне розтікання металу в місці з'єднання, що сприятиме руйнуванню й виносу окісних плівок із зони контакту, згладжуванню поверхневих мікронерівностей та утворенню активних центрів схоплювання в місцях виходу дислокацій та їхніх скупчень.
Ступінь деформації при холодному зварюванні досягає 80…90 %. Для цього необхідно прикладати тиск, що у чотири – п’ять разів перевищує межу плинності зварюваних металів. Тривалість процесу макрооб'ємної деформації звичайно становить 1…2 секунди.
Здатність до схоплювання значною мірою визначається положенням металу в періодичній системі елементів і будовою кристалічних ґрат. В основному, холодним зварюванням з’єднують такі пластичні метали, як алюміній і мідь, хоча його застосовують і для з’єднання різнорідних металів.
При зварюванні вибухом відбувається фізичний контакт між поверхнями, що з'єднують, а наступна електронна їхня взаємодія забезпечує створення міцного металевого зв'язку. Зближення поверхонь на відстань фізичного контакту здійснюється при зварюванні вибухом за допомогою спільної пластичної деформації поверхневих шарів матеріалів.
При термомеханічних способах зварювання (а також при зварюванні тертям) зближення атомів, активація поверхонь (очищення поверхневих шарів і плинність ювенільних шарів металу) досягається завдяки спільній пружньо-пластичній деформації матеріалів, що з'єднують, одночасно з їх нагріванням. З підвищенням температури межа плинності металу зменшується, тому потрібно застосувати набагато менший тиск для забезпечення фізичного контакту деталей, що зварюють, за всією площею стику.
Протікання струму через деталі приводить до поступового нагрівання металу в стику до температури, близької до температури плавлення (0,8…0,9)Тпл. Потім збільшують зусилля стискування деталей, а струм вимикають. При цьому прискорюється переміщення рухливої деталі, відбувається пластична деформація металу в стику і утворення з'єднання у твердому стані. Безперервний структурний зв'язок здійснюється завдяки спільній (взаємній) рекристалізації металу деталей. Зварне з'єднання має зернисту структуру.
При контактному стиковому зварюванні оплавленням деталі зближують при дуже малому зусиллі й вимкненому джерелі струму. Оплавлення деталей відбувається в результаті безперервного утворення й руйнування контактів – перемичок між їхніми торцями. Перемички нагріваються значно вище температури плавлення, аж до температури кипіння.
Після утворення необхідного шару розплавленого металу на торці деталей, що зварюють, струм вимикають, застосовують осаджувальний тиск. Рідкий метал разом із забрудненнями (окисними плівками) видавлюється зі стику, утворюючи при затвердінні ґрати. З'єднання утворюється між твердими металами, нагрітими до пластичного стану знову ж внаслідок спільної (взаємної) рекристалізації металу деталей.
При точковому контактному зварюванні деталі з'єднуються за окремими зонами стикання, що називають точками. При цьому деталі складають внапуск і стискають електродами, з'єднаними зі зварювальним трансформатором, при вмиканні якого деталі нагріваються короткочасним (0,01…0,5 с) імпульсом струму до появи розплавленої зони або ядра точки. Розплавлений метал утримується в ядрі від вибризкування й надійно захищається від взаємодії з навколишнім середовищем ущільнювальним поясом, який формується в результаті значної пластичної деформації металу, що примикає до ядра.
Зусилля після вимикання струму зберігається якийсь час для того, щоб кристалізація металу відбувалася під тиском, завдяки чому метал захищається від утворення дефектів усадочного походження – тріщин, пухкості та ін.
Шовне зварювання – це утворення безперервного зварного з'єднання шляхом поставлення послідовного ряду точок, що перекривають одна одну. Таким способом досягається герметичність зварного з'єднання. При шовному зварюванні, як і при точковому, утворення міжатомних зв'язків відбувається шляхом взаємної кристалізації розплавленого металу під тиском у замкненому об’ємі.
При зварюванні в рідкій фазі (термічний клас зварювання) зближення атомів здійснюється завдяки явищу змочування й теплових коливань часток. Очищення поверхонь відбувається шляхом відновлення елементів з окислів (термічної дисоціації окислів) при нагріванні, десорбції, металургійному обробленні зварювальної ванни.
Початок контакту металів, що зварюють, тобто встановлення безперервного структурного зв'язку, відповідає моменту утворення загальної зварювальної ванни. З'єднання відбувається шляхом мимовільного змішування й взаємного розчинення рідкого металу деталей з наступною його кристалізацією на основі частково оплавлених зерен основного металу. Зварний шов має структуру литого, тобто кристалічного або дендритного металу. Отже, при зварюванні плавленням зварне з'єднання утворюється у процесі спільної кристалізації.
При зварюванні деталей з того ж самого матеріалу процеси розчинення, взаємної дифузії, утворення твердих і рідких розчинів, тобто взаємної кристалізації, нічим не обмежені. Більш складна ситуація може виникнути при зварюванні деталей з різнорідних металів. Основними труднощами, що існують при цьому є їхня металургійна несумісність: різні кристалічні будови (тип кристалічних ґраток і величина їх параметрів), температури плавлення, теплофізичні властивості (коефіцієнти лінійного розширення, теплопровідності). У першому наближенні металургійну сумісність можна оцінити за діаграмами стану сплавів. Усі можливі сполучення металів можна поділити на три види.
До першого виду сполучень належать метали, що мають гарну фізичну зварюваність, тобто однакову кристалічну структуру, можуть утворювати безперервні тверді розчини, змішуючись у різних співвідношеннях, тобто здатні створювати загальні кристалічні ґрати. Ці метали належать до тієї ж самої групи або до суміжних груп періодичної системи елементів, наприклад, залізо-нікель, нікель-мідь, хром-ванадій. Тут процеси розчинення й дифузії нічим не обмежені.
До другого виду відносять метали, розходження розмірів атомів яких перевищує 14…15 %, тобто й розчинність їх у твердому стані буде обмеженою (правило Юм-Розері). У сплаві будуть утворюватися тендітні хімічні сполуки – інтерметалоїди. При зварюванні таких пар металів установлюється структурний зв'язок внаслідок наявності як кристалічної, так і міжкристалічної взаємодії.
До третього виду належать метали і їх сплави, які практично не зварюються плавленням, тобто не можуть взаємно розчинятися в рідкому стані. Між ними встановлюється лише дуже слабкий міжкристалічний зв'язок елементів.
2 МЕТАЛУРГІЙНІ ПРОЦЕСИ ПРИ ЗВАРЮВАННІ
ПЛАВЛЕННЯМ
Під терміном «металургійні процеси» розуміють високотемпературні явища взаємодії фаз, які супроводжують одержання металу.
Це процеси розплавлення й затвердіння металу, при яких відбувається зміна його хімічного складу й кристалічної будови, перехід з однієї фази в іншу. Ці процеси можуть бути реакціями переходу, заміщення й розподілу елементів між фазами.
Процеси зварювання плавленням обов'язково містять фазу нагрівання основного й присадного металів до їхнього розплавлення з наступним охолодженням і затвердінням. У зв'язку з цим взаємодія фаз спершу йде в умовах підвищення, а потім зниження температури. Ця взаємодія може бути ендотермічною, що проходить з поглинанням теплоти, або екзотермічною, що супроводжується виділенням теплоти. Підвищення температури підсилює ендотермічні процеси й послабляє екзотермічні. При зниженні температури відбувається протилежний процес.
При сталих умовах (температура, тиск та ін.) реакції взаємодії фаз із часом прагнуть досягти рівноважного стану, при якому швидкості проходження цих реакцій в одному напрямку дорівнюють швидкостям їхнього проходження в протилежному. Рівновага реакцій взаємодії фаз залежить від температури. Через те, що температура в зоні зварювання постійно змінюється, реакції взаємодії фаз можуть змінювати як напрямок свого проходження, так і стан фаз. При цьому рівновага між реагуючими речовинами, як правило, не встигає встановлюватися.
2.1 Особливості металургійних процесів при зварюванні
плавленням
Зварювання також є металургійним процесом, але відрізняється від інших подібних процесів такими особливостями:
– відбувається при високій температурі нагрівання;
– здійснюється з великою швидкістю;
– характеризується дуже малими обсягами нагрітого й розплавленого металу;
– при зварюванні тепло швидко відводиться від розплавленого металу зварювальної ванни в прилеглі до неї зони твердого основного металу;
– на розплавлений метал у зоні зварювання інтенсивно впливають гази й шлаки, що його оточують;
– у ряді випадків для утворення металу шва використовується присадний метал, хімічний склад якого може значно відрізнятися від складу основного металу;
- у зварювальній ванні розплавлений метал енергійно безперервно фізично й хімічно взаємодіє з навколишнім середовищем, захисною газовою атмосферою, шлаками, основним металом.
2.2 Хімічний склад металу шва
Метал шва в загальному випадку при зварюванні електродом, що плавиться, або застосуванні металевих присадок (дроту, порошку й ін.) утвориться в результаті перемішування у ванні основного і електродного (присадного) металів.
Частку основного металу y у шві, що залежить від виду з'єднання (з обробленням і без нього), типу й режиму зварювання, можна визначити з відношення площі F0, зайнятої основним металом у поперечному перетині шва, до всієї його площі F0 + Fел (рис. 4).
При ручному дуговому зварюванні покритим електродом частка основного металу у шві становить: 0,15…0,40 – при наплавленні валиків; 0,25…0,50 – при зварюванні кореневих швів; 0,25…0,60 – при зварюванні під флюсом.
Хімічний склад металу шва і його властивості залежать від складу й частки участі у формуванні шва основного й електродного (присадного) металів, а також реакцій, що відбуваються в процесі зварювання. На хід та інтенсивність цих реакцій впливають, головним чином, навколишнє середовище, ступінь захисту розплавленого металу від повітря, склад навколишніх газів і шлаків, режим зварювання.
За відсутності хімічних реакцій у зоні зварювання кількість будь-якого елемента в металі шва (Mш) може бути знайдена за формулою
Мш = М0y + Мел(1-y),
де М0, Мел – вихідний вміст елемента в основному і електродному металі; y – частка основного металу.
У випадку хімічних реакцій розплавленого металу з газами, покриттями, шлаковою ванною склад металу шва визначають з урахуванням коефіцієнтів переходу, що показують, яка частка металу, що міститься в електродному дроті, переходить в метал шва:
Мш = М0y + nМел(1-y),
де n – коефіцієнт переходу, він змінюється в широких межах (0,3…0,95) залежно від хімічної активності елемента, виду зварювання, технології зварювання й ін.
Хімічні реакції взаємодії розплавленого металу з газами при застосуванні певних засобів захисту називають зварювальними металургійними реакціями.
Таблиця 2 – Коефіцієнт переходу деяких елементів при різноманітних засобах зварювання
| Вид дугового зварювання | Легуючі елементи | |||
| С | Mn | Si | Cr | |
| Зварювання без захисту: дріт марки Св 08А; дріт марки Св 18ХГСА | 0,3...0,4 0,29...0,34 | 0,39...0,56 0,63...0,69 | 0,5...0,87 | 0,9...0,95 |
| Зварювання в середовищі СО2: дріт марки Св 12Х19Н9Т дріт марки Св 18ХГСА | 0,8 | 0,78 0,8 | 0,78 0,81 | 0,94 0,94 |
| Зварювання в середовищі Ar + 5%O2: дріт марки Св 18ХГСА дріт марки Св 10ГС | 0,6 0,59 | 0,69 0,41 | 0,71 0,32 | 0,92 |
| Зварювання електродами марки УОНИ 13/45 | 0,45...0,55 | 0,14...0,27 |
Виділяють дві основні зони або стадії взаємодії розплавленого металу з газами й шлаками: торець електрода з краплями, що утворюються на ньому, і зварювальну ванну. Повнота металургійних реакцій залежить від температури, часу взаємодії, стану (площі) й концентрації реагуючих речовин. Характерні умови металургійних реакцій при зварюванні, як і при кристалізації, – висока температура нагрівання, відносно малий обсяг металу, який розплавляють, короткочасність процесу.
Середня температура крапель електродного металу, що надходять у ванну, зростає зі збільшенням щільності струму й становить при зварюванні сталей від 2200 до 2700 °С, тобто характеризується значним перегрівом. Температура зварювальної ванни при дуговому зварюванні також характеризується значним перевищенням температури плавлення, перегрів становить 100…500 °С. Висока температура сприяє значній швидкості реакцій завдяки високій швидкості охолодження.
2.3 Характеристика фаз, що утворюють зварювальну
систему
В умовах зварювання плавленням створюється багатокомпонентна гетерогенна система, компонентами якої є метали ( Fe при зварюванні сталей, а також елементи, що вводять для розкиснення, легування й модифікування металу шва), металоїди (С , Н , N , O, S , P та інші), хімічні сполуки (оксиди, нітриди, гідриди, сульфіди, фосфіди). В умовах зварювання компоненти можуть існувати у твердому,рідкому й газоподібному стані. Відповідно до цього у зварювальній зоні утворюються три основні складні змішані фази: газова,рідка металева й рідка шлакова. При цьому окремі компоненти (як правило, хімічні сполуки) можуть утворювати самостійні прості фази в змішаних конденсованих фазах: металевій і шлаковій.
У зв'язку із цим у металургічній літературі для визначення, в якій фазі знаходиться реагуючий компонент (метал, металоїд, хімічна сполука) і, відповідно, у якій фазі проходить хімічна взаємодія, прийнято такі позначення: якщо речовина існує в металевій фазі, її хімічну формулу беруть у квадратні дужки; якщо – в шлаковій, її хімічну формулу беруть у круглі дужки; якщо – в газовій, її хімічну формулу записують без дужок.
З урахуванням цього хімічні реакції записують таким чином:
у газовій фазі (метал і його оксид існують у вигляді пари)
Ме + O Û МеО;
у металевій фазі (кисень й оксид знаходяться у розчині)
[Ме] + [O] Û [МеО];
у двофазній системі (оксид утворює самостійну фазу, що не розчиняється в металі, та переходить у шлак)
[Ме] + [O] Û (МеО);
у трифазній системі
2[Ме] + O2 Û 2(МеО).
Обмінна реакція між металевою й шлаковою фазами має вигляд
[Me¢ ] + (Me²nOm) Û m(Me¢ O) + n[Me² ].
У цьому випадку речовини переходять у металеву або шлакову фазу залежно від розчинності в цих фазах.
Стрілки в рівняннях показують, що взаємодія може йти в обох напрямках. При високих температурах реакції відбуваються переважно зліва направо. При зниженні температури рівновага цих реакцій зміщується зправа наліво.
2.3.1 Газова фаза при зварюванні плавленням
Газова фазаскладається з простих двохатомних газів: O2, Н2 , N2 і складних газів: СO, CO2 , Н2O пара, СnHm, які попадають у зону зварювання безпосередньо або в результаті дисоціації різних органічних і неорганічних речовин і газів, а також різних обмінних реакцій (наприклад, карбідів і парів води). Так, азот попадає в зону зварювання, головним чином, із повітря. Джерелами кисню й водню є повітря, зварювальні матеріали (електродні покриття, флюси, захисні гази та ін.), а також окисли, поверхнева волога й інші забруднення на поверхні основного й присадного металів. Нарешті кисень, водень та азот можуть утримуватися в надмірній кількості в металі, що переплавляють.
 Зварювання плавленням характеризується високими температурами (при дуговому зварюванні – 5000...7000 К, при плазмовому –10000...12000 К). При таких температурах у газовій фазі відбувається багатостадійний процес дисоціації газів (рис. 5).
Зварювання плавленням характеризується високими температурами (при дуговому зварюванні – 5000...7000 К, при плазмовому –10000...12000 К). При таких температурах у газовій фазі відбувається багатостадійний процес дисоціації газів (рис. 5).
Дисоціацію простих двоатомних газів – водню, кисню і азоту – можна записати такими рівняннями:
H2+103,8 кал/моль Н + Н;
O2+118,2 кал/моль O + O;
N2+103,8 кал/моль N + N.
Ці процеси супроводжуються поглинанням тепла, тобто є ендотермічними. Звідси видно, що енергія, яка витрачається на дисоціацію молекули азоту, найбільш висока й тому молекула азоту – сама міцна. В однакових умовах азот має дисоціювати менше, ніж кисень і водень.
Аналогічно відбувається дисоціація триатомних газів, з яких у зварювальних процесах звичайно беруть участь пари води й вуглекислий газ:
2H2O (пар) + 115,6 кал/моль 2H2 + O2;
CO2 + 67,65 кал/моль СО + ½O2.
Дисоціації підлягають й більш складні з'єднання. До складу багатьох електродних покриттів і флюсів входять плавиковий шпат CaF і карбонати, наприклад СаСО3. При високих температурах вони розкладаються відповідно до реакцій
CaF2 CaF + F;
CaCO3 CaC + CO2.
Двоатомні гази H2, O2 , CO, що утворюються, також дисоціюють.
На склад газової фази впливає також метал, що випаровується, змінюючи цим умови проходження дугового розряду, а також електронного або лазерного випромінювання. Це випарювання є вибірним, причому інтенсивніше випаровуються елементи з більш високою пружністю пари. Наприклад, при зварюванні сталі найбільш інтенсивно випаровується марганець, при зварюванні латуні – цинк. У результаті вибірного випарювання помітно знижується концентрація летких елементів у металі шва, що необхідно враховувати при розробленні технології зварювання.
2.3.2 Шлакова фаза при зварюванні плавленням
Шлаки являють собою рідкі мінеральні фази, що відокремлюють дзеркало металу від безпосередньої дії газової фази. Шлаки не ізолюють метал від газової фази, а тільки заміняють безпосередній контакт дифузійним. Вони утворюються при плавленні електродного покриття, флюсу, шихти порошкового дроту або при металургійних процесах, що відбуваються при зварюванні, наприклад, при зварюванні у вуглекислому газі.
Призначення шлаків – одержати бажаний напрямок процесів при зварюванні, а саме:
– захистити розплавлений метал від взаємодії з газовою фазою;
– забезпечити необхідні зварно-технологічні властивості процесу: мінімальне розбризкування, правильне формування шва, стабільне існування дугового розряду, газовиділення з металу шва, легке відділення шлакової кірки від поверхні металу шва, що кристалізувався;
– забезпечити проходження необхідних металургійних процесів у зоні плавлення – розкиснення, легування, рафінування, зв'язування водню в сполуки, що не розчиняються в металі;
– сповільнити охолодження металу шва після зварювання.
За своїм складом шлаки – це складна система з оксидів і (або) нейтральних солей, між якими можуть відбуватися хімічні реакції, що приводять до утворення нових речовин. Головні компоненти зварювальних шлаків можна розбити на чотири групи (табл. 3).
У розплавленому стані основні оксиди взаємодіють із кислотними або амфотерними і утворюють хімічні сполуки – комплексні оксиди, які, як правило, більш рідкоплинні й легкоплавкі.
У цей час існують дві теорії, що описують будову рідких шлаків, – молекулярна й іонна. Відповідно до молекулярної теорії шлаки – це системи вільних і хімічно сполучених неметалевих з'єднань (оксидів та інших), між якими є рухома хімічна рівновага. При цьому з металом взаємодіють тільки вільні компоненти (зокрема, оксиди).
Таблиця 3 – Головні компоненти зварювальних шлаків
| Кислотні оксиди | Основні оксиди | Амфотерні оксиди | Нейтральні солі |
| Si2, Ti2, B2O3, P2O5, Zr2 | Na2O, K2O, Ca, Mg, Fe, Mn | Al2O3, Fe2O3, Cr2O3, V2O3 | KF, Na, Li, Ca2, Ba2, KCl, NaCl, MgCl2, Na3Al6 (кріоліт) |
Згідно з іонною теорією шлаки мають будову іонного типу. В рідких шлаках всі оксиди і їхні хімічні сполуки дисоціюють на іони. У розплавлених шлаках існують позитивно заряджені катіони: Ca2+, Mg2+, Mn2+, Al3+ та інші й негативно заряджені аніони O2-, F2-, S2-, SiО,TiО й ін.
Молекулярна теорія шлаків розроблена досить детально. Вона є більш зручною для практичних розрахунків рівноважних систем.
Найважливіші показники зварювальних шлаків – їх здатність об'єднувати оксиди, нітриди, сульфіди, фосфіди в міцні хімічні сполуки, що не розчиняються в металі, і які можуть легко видалятися в шлаки.
Характер протікання металургійних процесів між металом і шлаками залежить від хімічного складу шлаків. Формальну перевагу кислотних або основних характеристик шлаків оцінюють коефіцієнтом основності В або кислотності К. Шлаки відносять до кислих при В<1 , до основних при В = 1, до нейтральних при В >1. Звичайно у зварювальних шлаках В = 0,6…1,3, але вже при В>1,1 погіршуються зварно-технологічні властивості шлаків.
Кислі шлаки добре розкиснюють сталі завдяки зв'язуванню Fe у комплексні сполуки з SiО2, TiО2. Однак значні швидкості охолодження не дозволяють довести процес до кінця, тому потрібно застосовувати ще й розкиснювачі. Крім того, кислі шлаки не можуть рафінувати метал, тому вихідні матеріали повинні мати мінімальну кількість сірки й фосфору (не більше ніж 0,10 % кожного).
Основні шлаки добре зв'язують сірку й фосфор у комплексні сполуки, що видаляють у шлаки, але вони не можуть зв'язати Fe у комплекси, тому що це потребує більшої кількості розкиснювачів.
Шлаки повинні мати такі фізичні властивості:
– їх температура плавлення має бути на 200…300 0С нижче температури плавлення металу (див. табл. 1);
– питома вага – менше питомої ваги металу (див. табл. 3);
– в'язкість – на два порядки більше в’язкості металу (так, коефіцієнт в'язкості сталей h = (1…2)×10-3 Па•с, коєфіціент в’язкості шлаків
h = (0,8…3)×10-1 Па•с);
– зварювальні шлаки при розплавленні мають різко зменшувати свою в'язкість, тобто вони мають незначний температурний перехідний інтервал;
– шлакова кірка має легко відділятися від поверхні металу, що закристалізувався.
Шлакова кірка легко відділяється за відсутності шпінелей у шлаках. Шпінелі – це комплексні сполуки типу MeR2O4, де елементом Ме є Fe, Mn, Mg, а елементом R – Al, Cr, V. Шпінель пристроюють до кристалічної ґратки сталі, тому її важко усувати з поверхні металу шва. Крім того, для ефективного відокремлювання шлаків від металу шва необхідно, щоб коефіцієнти a лінійного розширення металу й шлаків істотно розрізнялися. Звичайно у сталей a×106 = 11,5…14,0 1/0С, у шлаків a×108 = 9,9…11,5 1/0С. Найкраще відокремлювання шлаків спостерігається при малому їх окисненні.
Шлаки мають три стани: рідкоплинний (h £ 1 Па×с), в’язкий
(h = 10…102 Па×с) і крихкий (h > 102 Па×с).
Ті шлаки, у яких температурний інтервал переходу з в’язкого стану в рідкоплинний є незначним, називають короткими. Довгі шлаки мають значно більший температурний інтервал переходу.
Короткі шлаки мають в'язкість майже постійну в інтервалі температур 1200…1400 0С. При температурі близько 1100 0С в'язкість коротких шлаків різко підвищується й вони твердіють. Таким чином, короткі шлаки швидко твердіють з боку поверхні, залишаючись рідкими у зоні зіткнення з металом, що кристалізується. Це забезпечує як вільний вихід газів з металу, так і відповідне формування шва. Короткі шлаки є основними.
Довгі шлаки є більш густими, їхня в'язкість повільно знижується в інтервалі 1000…1400 0С. Такі шлаки поступово переходять спочатку з рідкого стану в густий, потім – у тістоподібний і далі – у твердий.
Температуру на початку твердіння довгих шлаків важко встановити. Перехід з тістоподібного стану в твердий в довгих шлаках супроводжується наростанням в'язкості, при якій перегрупування часток, необхідне для одержання кристалічної ґратки, утруднюється. Тому довгі шлаки не кристалізуються, а переходять у склоподібну масу.
Довгі шлаки – це звичайно кислі силікатні шлаки. Чим більший вміст SiО2 у шлаку, тим вище його в'язкість. Довгі густі повільнотверднучі шлаки є менш активними стосовно металу й відрізняються нижчими формуючими властивостями.
Від в'язкості шлаків залежить газопроникність металу, тобто його здатність пропускати гази, що з нього виділяються. Швидкість виділення газів з металу залежить від їхнього тиску над поверхнею металу. Якщо газопроникність шлаків є низькою, то на поверхні металу створюється підвищений тиск газів, що перешкоджає їхньому подальшому виділенню. У цьому випадку у шві може утворитися пористість, а на поверхні шва – дрібні тріщини та інші дефекти.
Густі шлаки мають низьку газопроникність, а малов’язкі рухливі шлаки – високу. У рідкоплинних шлаках швидке виділення газів з металу супроводжується попутним «захопленням» часток шлакових включень і більш повним очищенням металу шва. Тому важливо правильно підбирати відповідні добавки до шлаків, щоб впливати на їхню в'язкість у потрібній мірі.
Кращим розріджувачем шлаків, особливо основних, є фтористий кальцій CaF2 (плавиковий шпат). В'язкість зменшують також хлориди, оксиди (TiО2, K2O, Na2O, MnО). Особливо сприятливо впливає на одержання коротких шлаків TiО2. Збільшують в'язкість SiО2, Al2O3, ZrО2, CaО, MgО.
При зварюванні найчастіше використовують малов’язкі легкорухливі швидкотверднучі шлаки. Цій умові найбільше задовольняють короткі основні шлаки.
Головні шлакові системи за складом компонентів поділяють на три типи: оксидні (силікати і основні), оксидно-сольові й сольові. Силікати застосовують для зварювання маловуглецевих і низьколегованих сталей, основні шлакові системи – для зварювання нержавіючих високолегованих сталей. Оксидно-сольові шлаки використовують для зварювання середньо- й високолегованих сталей і для наплавлення, сольові – для зварювання алюмінієвих і титанових сплавів.
За своєю будовою шлаки повинні мати не більше трьох головних компонентів (див. табл. 1.) Наприклад, кислі електродні покриття побудовано на основі Si2-FeO-MnО, основні – на базі CaO-SiО2-CaF2, плавлені флюси для зварювання маловуглецевих сталей – на основі Si2-MnO- CaF2.
За вмістом двоокису кремнію SiО2 і закису марганцю MnO оксидні флюси (шлаки) поділяють на кілька категорій:
за вмістом Si2:
– безкремнисті (SiО2 у вигляді домішок не більше 5 %);
– низькокремнисті (SiО2 = 6…35 %);
– висококремнисті (SiО2 > 35 %);
за вмістом MnO:
– безмарганцеві (MnO у вигляді домішок не більше 1 %);
– низькомарганцеві (MnO до 10 %);
– середньомарганцеві (MnO = 15…30 %);
– високомарганцеві (MnO = 30 %).
Залежно від коефіцієнта активності Аф флюси можна класифікувати за чотирма групами:
– високоактивні (Аф > 0,6);
– активні (Аф = 0,6…0,3);
– малоактивні (Аф = 0,3…0,1);
– пасивні (Аф < 0,1).
Коефіцієнт відносної хімічної активності флюсу досить повно характеризує окисну здатність флюсів. Окиснювання металу шлаками відбувається в результаті окиснювально-відновних процесів на поверхні розподілу фаз шлак-метал. Окиснювання металу приводить до зниження його пластичних властивостей, насамперед ударної в'язкості.
Активні флюси використовують для зварювання сталей з межею міцності sВ £ 600 МПа. Застосування їх при зварюванні низьколегованих теплотривких сталей і сталей підвищеної й високої міцності призводить до забруднення металу швів неметалічними вкрапленнями, сіркою й фосфором, можливе також утворення кристалізаційних тріщин у металі швів, зниження стійкості швів до переходу в крихкий стан. Для зварювання низьколегованих сталей рекомендують застосовувати малоактивні флюси, а для середньо- й високолегованих сталей – малоактивні й пасивні флюси.
Найбільш інтенсивно взаємодіють фази при газовому і електродуговому зварюванні, коли знаходження металу в рідкому стані є відносно тривалим. Внаслідок великої концентрації енергії й малої площі плями нагрівання при електронно-променевому й імпульсному лазерному зварюванні тривалість перебування металу в рідкому стані є незначною. Швидкості плавлення, охолодження й затвердіння металу є високими, що утрудняє взаємодію фаз. При електрошлаковому зварюванні газова атмосфера з металом зварювальної ванни безпосередньо не контактує, внаслідок чого основною є лише взаємодія металу зі шлаками.
Процеси взаємодії фаз у зоні зварювання відбуваються одночасно, однак, для зручності опису спочатку розглянемо взаємодію металу з газовою фазою, а потім – зі шлаками.
2.4 Взаємодія металу з газовою фазою
2.4.1 Розчинення газів у рідкому металі
Дисоціація двоатомних газів до атомарного стану в умовах зварювання дуже важлива, тому що внаслідок дисоціації підвищується активність газів і вони при взаємодії з розплавленим металом у вигляді крапель і зварювальної ванни можуть у ньому розчинятися або ж утворювати з ним хімічні сполуки (табл. 4.)
Якщо при дисоціації відбувається розчинення газу в металі, то сумарний тепловий ефект, як правило, є позитивним (Н > 0), тобто такий процес – ендотермічний.
Таблиця 4 – Розчинність водню, азоту й кисню в рідких металах