Характеристики применяемых методик отбора проб
2.1.2.1 Методика определения взвешенных частиц.
Оборудование и материалы.Пробоотборники, аналитические весы, плоскодонные колбы, воронки, фильтры бумажные (синяя, белая лента), цилиндры.
Общие положения.Загрязнение осадков происходит как во время образования в облаке и выпадения их на земную поверхность, так и в результате сухого осаждения загрязнителей из атмосферы.
Большое количество пылевых примесей в атмосфере городов нередко провоцирует заболевания дыхательных путей и нарушение работы слизистых оболочек организма человека и животных. Пыль засоряет устьица растений, нарушает процессы цветения и оплодотворения в растениях. В больших количествах пыль образует налет или даже корку на поверхности растений, чем затрудняет протекание процесса фотосинтеза. Будучи сами по себе малотоксичными пылевые частицы способны адсорбировать на своей поверхности тяжелые металлы и другие токсичные вещества.
Ход работы.Произвести отбор снега (дождя) специальным пробоотборником. Если производится отбор снега, то его необходимо поместить в комнатные условия (18-20° С) до полного таяния. Собранные осадки фильтруются через широкопористый фильтр (белая лента), предварительно взвешенный на аналитических весах. Для фильтрования берутся три конические колбы, три воронки, в которые вставляются фильтры. Через каждый из них пропускается фильтрат объемом 300 мл. Если после фильтрования фильтрат получается мутным, то его фильтруют еще через узкопористый фильтр (синяя лента), выше указанным способом. После фильтрования фильтры высушиваются в эксикаторе и вновь взвешиваются на аналитических весах. По разности масс фильтров до и после фильтрования вычисляется масса взвешенных частиц.
2.1.2.2 Методика определения рН водных объектов.
Реактивы и оборудование.Химические стаканы на 150 мл, нанометр ЭВ-74, технические весы, разновесы, колбы мерные, пипетки.
Общие положения.Величина рН является мерой активной кислотности природной воды и других объектов окружающей среды, создавшейся в результате взаимодействия растворенных электролитов и газов. Определение величины рН в практике исследования природных вод, почв и растений имеет большое значение. Это величина позволяет судить о формах нахождения в объектах окружающей среды слабых кислот: угольной, кремневой, сероводородной, фосфорной, а также дает возможность судить о насыщенности объектов слабыми основаниями и служит для контроля некоторых аналитических определений. Активная кислотность почв имеет решающее значение для произрастания растений, жизнедеятельности микроорганизмов, развития и направления биохимических процессов почвы.
Ход определения.Приготовление водной суспензии. 10 г воздушно-сухой почвы, пропущенной через сито диаметром в 1 мм, отвешивают на технических весах, помещают в колбу емкостью 50-10 и приливают 25 мл дистиллированной воды, рН которой равна 6,6-6,8.Колбу плотно закрывают чистой каучуковой пробкой, встряхивают 5 минут и оставляют стоять 18-24 часа, после чего сливают отстоявшийся раствор и определяют рН водной вытяжки.
Приготовление солевой вытяжки. Отвешивают на технических весах 20 г воздушно-сухой (или сырой) почвы и помещают в сухую чистую колбу емкостью 100 мл. Приливают 50 мл 1,0 н раствора хлорида калия, закрывают чистой пробкой и энергично встряхивают 5 минут. Через 10-15 минут после встряхивания, когда большая часть почвы осядет на дно, пробку приподнимают и дают стечь жидкости, задержавшейся между пробкой и стеклом. Снова закрывают колбу пробкой, смывают отстоявшейся жидкостью частицы почвы со стенок колбы. Если это не удастся сделать за один прием, минут через 10 повторяют смывание еще раз, после чего колбу оставляют стоять 18-24 часа. По истечении срока отстаивания берут пипеткой часть раствора (фильтровать нельзя ,так как фильтр может изменить реакцию вытяжки) и определяют рН солевой вытяжки.
Пробы природной воды или вытяжек в подписанных или пронумерованных химических стаканчиках переносят к прибору. Порядок работы на приборе следующий:
1. Включить прибор в сеть, прогреть 15 минут.
2.Опустить электроды в стаканчик с раствором.
3.Нажать кнопку рХ и «-1:19»,по нижней шкале прибора определить приблизительное значение рН раствора.
4.На панели переключения пределов измерения нажать кнопку, в которую входит определенная по пункту № 3 величина. Например, 2,4, то нужно нажать кнопку «-1:4» и отсчитать показываемое значение по верхней шкале прибора.
5.Соблюдать осторожность при работе со стеклянным электродом, следить, чтобы шарик стеклянного электрода не прикасался к стенкам и дну стакана.
После каждого определения вымывают электроды в дистиллированной воде и высушивают фильтрованной бумагой. По окончании работы с прибором электроды помещают в стакан с дистиллированной водой.
2.1.2.3 Методика определения содержания хлорид-ионов в атмосферных осадках
Реактивы и оборудование. Конические колбы на 200 мл; пипетки на 10 мл; цилиндры мерные на 100 мл; бюретки для титрования; дистиллированная вода; 0,01 н раствор AgNO3: растворяют 1,6987 г AgNO3в дистиллированной воды; 0,01 н раствор NaCI, готовится из фиксанала; 5 %-ный раствор К2СrО4.
Общие положения. Высокая растворимость хлоридов объясняет широкое распространение их во всех природных водах. В проточных водоемах содержание хлоридов обычно невелико (20-ЗО мг/л). Незагрязненные грунтовые воды в местах с несолончаковой почвой обычно содержат до 30-50 мг/л хлор-иона. В водах, фильтрующихся через солончаковую почву, в 1 л могут содержаться сотни и даже тысячи миллиграммов хлоридов. Вода, содержащая хлориды в концентрации более 350 мг/л, имеет солоноватый привкус, а при концентрации хлоридов 500-1000 мг/л неблагоприятно влияет на желудочную секрецию. Содержание хлоридов является показателем загрязнения подземных и поверхностных водоисточников и сточных вод. Определение хлоридов ведется по методу Мора.
Принцип метода Мора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калия К2СrО4. При наличии в растворе хлоридов AgNO3связывается с ними, а затем образует хромат серебра оранжево-красного цвета.
NaCI + AgNO3 AgCI+ NaNO3
2AgNO3 + K2CrO4 Ag2CrO4 + 2KNO3
Ход работы. Вначале устанавливают титр AgNO3. Для этого в коническую колбу на 200 мл вносят 10 мл раствора NaCIи 90 мл дистиллированной воды, прибавляют 5 капель К2СгО4.Содержимое колбы титруют раствором AgNO3до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15-20 с.
При содержании хлоридов менее 250 мг/л берут 100 мл фильтрованной испытуемой воды. При большем содержании хлоридов берут 10-50 мл. Испытуемую воду наливают в две конические колбы, доводят до 100 мл дистиллированной водой, прибавляют 5 капель раствора К2СгО4.Раствор в одной колбе титруют AgNO3,a вторая колба используется для контроля.
Содержание хлор-иона в воде рассчитывается по формуле
Х=V35,5, (4)
где X - содержание хлор-иона в мг/л;
35,5 - эквивалентное количество хлора, соответствующее 1 мл 0,01 н раствору AgNO3мг;
V - объем исследуемой пробы, мл.
2.1.2.4 Методика определения содержания сульфидов и гидросульфидов в атмосферных осадках
Реактивы и оборудование.Кристаллический иодид калия, 0,5 %-ный раствор крахмала, 0,01 н раствор тиосульфата натрия, конические колбы, мерные пипетки на 20 мл, бюретки, штативы.
Основные положения.При действии раствора йода на связанный и свободный сероводород и соли сернистой и тиосерной кислот происходит окисление последних:
S2-+I2 2I-+S
HS-+I2H+ + 2I- + S
SОз2- + I2 SO42 -+ 2I-+ 2Н+
2S2Оз2-+ I2 2I+ S4О62-
Ход определения.Вследствие летучести свободного сероводорода производят два определения: ориентировочное и точное.
Ориентировочное определение. В коническую колбу помещают 20 мл фильтрата атмосферных осадков, добавляют 0,2 г иодида калия и перемешивают круговыми движениями, при этом кристаллы растворяются. Затем прибавляют 2-3 капли 0,5 %-ного раствора крахмала и титруют 0,01 н раствором йода до появления голубой окраски, не исчезающей при энергичном встряхивании.
Точное определение. В коническую колбу вносят 20 мл исследуемой пробы, 0,2 г иодида калия ,отмеряют из бюретки 0,01 н раствора йода на 1 мл больше, чем было израсходовано на ориентировочное титрование, затем прибавляют 2-3 капли 0,5 %-ного раствора крахмала ,тщательно взбалтывают и оттитровывают избыток йода 0,01 н раствором тиосульфата натрия.
Общее содержание соединений серы X (в мг/л), окисляемых йодом, выраженное в форме сероводорода, вычисляют по формуле
 , (3)
, (3)
где V1 – объем прибавленного раствора йода, мл;
H1-нормальность раствора йода, н;
V2-объем раствора тиосульфата натрия, израсходованный на титрование избытка раствора йода, мл;
H2-нормальность раствора тиосульфата натрия, н;
17-эквивалентный вес сероводорода, г/моль;
1000-коэффициент перевода мл в л;
V- объем исследуемой пробы, мл.
2.1.2.5 Методика определения содержания карбонат- и гидрокарбонат-ионов в атмосферных осадках
Реактивы и оборудование.Бюретка для титрования; колбы конические на 250 мл; пипетки 10 мл; раствор фенолфталеина; раствор метилового оранжевого; 0,05 н раствор соляной кислоты.
Ход определения.Определение карбонат-иона.
В колбу наливают 10 мл анализируемой воды. Добавляют пипеткой 5-6 капель раствора фенолфталеина (при отсутствии окрашивания раствора, либо при слаборозовом окрашивании считают что карбонат-ион в пробе отсутствует, рН пробы меньше 8,0-8,2). Постипенно титруют содержимое склянки раствором соляной кислоты (0,05н) до тех пор, пока окраска побледнеет до слаборозовой. Массовую концентрацию карбонат-иона рассчитывают по формуле
Ск = Vк 300, (1)
где Vк - объем раствора соляной кислоты, израсходованный на титрование, мг/л.
Определение гидрокарбонат-иона. В колбу наливают 10 мл анализируемой воды. Добавляют пипеткой 1-2 капели раствора метилового оранжевого. Постипенно титруют содержимое склянки раствором соляной кислоты (0,05 н) при перемешивании до перехода желтой окраски в розовую. Массовую концентрацию гидрокарбонат-иона рассчитывают по формуле
Ск = Vгк 305, (2)
где Vгк - объем раствора соляной кислоты, израсходованный на титрование, мг/л.
2.1.2.6 Методика определения содержания кальция и магния в атмосферных осадках
Реактивы и оборудование. Раствор трилона Б с молярной концентрацией эквивалента 0,05 моль/л, индикатор хромоген черный, раствор гидроксида натрия с молярной концентрацией 2 моль/л, аммонийный буферный раствор, индикатор мурексид.
Общие положения. В этой работе используется комплексонометрический метод определения Са2+ и Mg2+ при их совместном присутствии в растворе.
Сущность определения сводится к тому, что в начале определяют суммарное содержание молярной концентрацией эквивалента 0,05 моль/л Mg2+, титруя фильтрат раствором трилона Б в присутствии хромогена черного. Затем находят содержание ионов Са2+, титруя фильтрат раствором трилона Б в присутствии индикатора мурексида. По разности этих двух определений находят содержание ионов Mg2+.
Ход работы.Пипеткой на 50 мл отбирают фильтрат и переносят его в колбу для титрования, приливают 5 мл аммонийной буферной смеси, 25-30 мг хромогена черного и титруют раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до перехода винно- красной окраски раствора в синюю.
Титрование повторяют 2-3 раза и берут среднее значение.
Содержание Са2+ и Mg2+ вместе взятых можно найти по формуле
m(Ca2++Mg2+) = 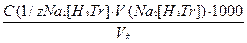 , (6)
, (6)
где С(1/zNа2[НзТг])- концентрация раствора трилона Б, н;
V(Na2[НзТг])- объем рабочего раствора трилона Б, затраченного на титрование, мл;
Уф- объем фильтрата, мл.
Определение содержания кальция. 50 мл фильтрата переносят в колбу для титрования, приливают 2,5 мл раствора NaOH с молярной концентрацией 2 моль/л, 30-40 мг смеси мурексида с хлоридом натрия и приступают к титрованию раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до появления сине-фиолетовой окраски, не исчезающей в течении 2-3 минут. Титрование повторяют 2-3 раза и берут среднее значение. Содержание кальция вычисляют по формуле, как и суммарное содержание Са2+ и Mg2+.
Количество магния находят
m(Mg2+) = m(Ca2++Mg2+) - m(Ca2+), (7)
2.1.2.7 Методика определения содержания сульфат-ионов в атмосферных осадках
Реактивы и оборудование.10 %-ный раствор хлорида бария; раствор электролита (NaCl+HCI), раствор сульфата натрия, мерные колбы на 50 мл, 100 мл, ФЭК, кюветы.
Общие положения.В работе используют реакцию образования дисперсной системы малорастворимого в кислых растворах сульфата бария (ПР=1,1 10 -10)
Ва2+ + SO42- =BaSO4
Для обеспечения избирательности определения сульфатов относительно карбонатов, фосфатов, хроматов реакцию проводят в кислой среде.
Ход определения.Приготовление рабочего раствора сульфата натрия. Раствор сульфата натрия с концентрацией 0,2 мг/ мл готовится растворением 0,8872 г прокаленного х.ч. сульфата натрия в 100 мл дважды перегнанной дистиллированной воды. Рабочий раствор сульфата натрия, содержащий 10 мкг в 1000 мл, готовят разбавлением полученного раствора в 20 раз.
Приготовление раствора электролита. 240 г химически чистого (х.ч.) хлорида натрия помещают в мерную колбу на 1000 мл, добавляют небольшое количество бидистиллята, приливают 20,5 мл концентрированной соляной кислоты и доводят бидистиллятом до метки.
Приготовление растворов для построения калибровочного графика. В мерные колбы вместимостью 50 мл вносят 1,2,4,6,10 мл рабочего раствора сульфата натрия, что соответствует 20,40,80,120,200 мкг сульфата натрия.
В каждую колбу приливают 10 мл электролита и соответственно 19,18,16,14,10 мл дважды перегнанной дистиллированной воды, перемешивают круговыми вращениями колбы. Затем приливают 7,5 мл раствора хлорида бария, перемешивают, доводят объем раствора до метки и снова тщательно перемешивают. Через 5 минут измеряют оптическую плотность стандартных растворов по отношению к раствору сравнения в порядке понижения концентрации в кюветах с толщиной поглощающего слоя 50 мл. Раствор сравнения готовят аналогично в колбе вместимостью 50 мл без сульфата натрия.
Снег перевести в жидкую фазу. Затем к 10 мл талой воды прибавляют 20 мл электролита, 20 мл бидистиллята, раствор перемешивают и добавляют 75 мл раствор хлорида бария. В колбе на 100 мл раствор доводят до метки и колориметрируют.
2.1.2.8 Определение содержания ионов аммония в атмосферных осадках
Реактивы и оборудование.ФЭК; электроплитка; мерные колбы на 50 мл, 100 мл; пипетки на 1 мл, 10 мл с делениями, на 10 мл без делений; раствор сегнетовой соли KNaC4H4O6 4Н2О - растворяют 50 г соли при нагревании в дистиллированной воде, доводят раствор до 100 мл, перемешивают, фильтруют, добавляют 5 мл 10 %-ного раствора NaOHи кипятят 30 мин (для удаления следов NH3).Объем раствора вновь доводят до 100 мл; реактив Несслера (щелочной раствор тетраиодмеркурата калия KНgI4торговый препарат); безаммиачная вода - дистиллированную воду с добавкой щелочи (25 мл 5 %-ного раствора NaOH на 1 л воды) кипятят 1 час; стандартный раствор NH4CI.Основной раствор: растворяют в безаммиачной воде 296,5 мг безводного NH4CI,высушенного при 100 °С, и разбавляют такой же водой до 100 мл; 1 мл полученного раствора содержит 100 мкг NH4.Рабочий раствор: разбавляют безаммиачной дистиллированной водой 5 мл основного стандартного раствора до 100 мл; 1 мл полученного раствора содержит 5 мкг NH4.
Общие положения.Ионы аммония определяют фотометрически по реакции с реактивом Несслера. Принцип метода основан на том, что аммоний с реактивом Несслера образует йодид меркураммония, который окрашивает раствор в желто-коричневый цвет. Интенсивность окраски пропорциональна содержанию аммония в воде.
NH4+ + 2К2НgI4 + 2КОН NH2Нg2I3 + 5KI + 2H2O + K+
Так как соли кальция и магния, обычно содержащиеся в природных водах, при взаимодействии с реактивом Несслера могут выпасть в осадок, их связывают раствором виннокислого натрия-калия (сегнетовой солью). Диапазон определяемых концентраций аммония - 0,05-4 мг/л.
Как правило, в чистых природных водах содержится 0,01-0,1 мг/л аммонийных солей. Предельно допустимые концентрации аммиака в воде водоемов 2 мг/л (по азоту).
Ход работы.К100 мл пробы воды добавляют 0,2 мл раствора сегнетовой соли и 0,2 мл реактива Несслера, перемешивают и через 10 мин измеряют оптическую плотность раствора при 425 нм в кювете толщиной 1 см на фоне дистиллированной воды. Из полученного значения оптической плотности вычитают оптическую плотность холостой пробы. Концентрацию ионов аммония в пробе определяют по калибровочному графику.
Построение калибровочного графика
В мерные колбы на 50 мл наливают 0,1,2,3,4,6 и 10 мл стандартного раствора NH4CIконцентрации 5 мкг NH4в 1 мл. Разбавляют до метки безаммиачной водой, перемешивают, отбирают из каждой колбы по 10 мл и переносят в пробирки. Концентрация ионов аммония в растворах составляет 0; 0,1; 0,2; 0,3; 0,6 и 1 мг/л. Определение ионов аммония ведут по методике, описанной выше. Из полученных значений оптических плотностей вычитают оптическую плотность холостого раствора.
2.1.2.9 Методика определения общей минерализации осадков
Материалы и оборудование.Фарфоровые чашки, сушильный шкаф, эксикатор, аналитические весы, водяная баня.
Ход работы.Для анализа используется фильтрат снеговой или дождевой воды, профильтрованный через фильтр «белая лента».
Фарфоровую выпаривательную чашку, предварительно ополоснув дистиллированной водой, высушивают до постоянного веса в сушильном шкафу при 150 °С.
Охлажденную в эксикаторе чашку взвешивают на аналитических весах.
25 мл фильтрата помещают в выпаривательную чашку (чашку наполняют постепенно, не более 1 объема) и выпаривают содержимое на водяной бане. Первое высушивание продолжительностью - 2 часа, последнее продолжительностью - 0,5 часа.
Помещают в сушильный шкаф и сушат до постоянного веса при тех же условиях. Затем охлаждают чашку с осадком в эксикаторе. Взвешивают охлажденную чашку вместе с содержимым на аналитических весах.
Расчет количества содержащихся в осадках минеральных веществ производится по формуле
Х= (а-в) 1000 1000
У (5)
где X - минерализация, мг/л;
а - вес чашки с осадком, г;
в - вес чашки без осадка г;
У- объем воды пропущенной через фильтр, л.
2.1.2.10 Методика определения цинка в природных водах
Реактивы и оборудование.20 % раствор тиосульфата натрия (Nа2S2О3), ацетатный буферный раствор, раствор дитизона в четыреххлористом углероде, хлорид цинка (ZnCl2). Конические колбы, делительные воронки на 500 мл, химический стакан, пипетки на 5 мл, кюветы на 10 мл, ФЭК, 7 мерных колб на 50 мл, цилиндр на 100 мл.
Общие положения.Цинк находится в природных водах главным образом в виде иона Zn2+. В водах обычно содержится п*10° мкг/л Zn2+, иногда это содержание повышается до сотен мкг/л. Более высокие концентрации цинка встречаются, как правило, в кислых водах. Наиболее удобным методом определения микроколичества цинка в природных водах является дитизоновый.
Метод примененим для анализа пресных и соленых вод (до минерализации 100 г/л), цинк образует с дитизоном красное соединение, экстрагируемое лучше всего четыреххлористым углеродом. Следует иметь ввиду, что цинк также образует с тиосульфатом комплексное соединение, хотя и относительно мало устойчивое. Это приводит к замедлению и некоторой неполноте реакции образований дитизоната цинка. Поэтому построение градуировочного графика и само определение надо проводить в одинаковых условиях.
Метод исключительно чувствителен, поэтому следует особо тщательно следить за чистотой посуды и реактивов.
Ход работы.Приготовление стандартных растворов для построения градуировочного графика. Для приготовления эталонов в мерные колбы на 50 мл наливают 0; 0,5; 1,0; 2,0; 3,0; 4,0 и 5,0 мл рабочего раствора хлорида цинка, в каждую из колб добавляют 5 мл ацетатного буферного раствора, затем 1 мл 20 % раствора тиосульфата натрия и 4 мл раствора дитизона; доводят объем до метки дистиллированной водой и фотометрируют. (После добавления каждого раствора содержимое колбы перемешивают).
Рабочий раствор хлорида цинка, содержащий 5 мкг/мл цинка, готовят, взяв навеску хлорида цинка 10,46 мг и растворив ее в мерной колбе на 1 л дистилированной водой. В коническую колбу помещают 100 мл исследуемого раствора, добавляют 5 мл ацетатного буферного раствора, перемешивают, приливают 1 мл 20 % раствора тиосульфата натрия (№28203) и 4 мл рабочего раствора дитизона в четыреххлористом углероде. Энергично встряхивают в течение 2-5 минут.
Окраска дитизона в зависимости от содержания цинка изменяется от зеленой до красной.
Содержимое колбы переливают в делительную воронку и отделяют окрашенную органическую часть раствора, которую помещают в кювету на 10 мл и определяют оптическую плотность на ФЭК. Зеленый светофильтр, Х= 540 нм.
Значение концентрации цинка определяется по калибровочному графику.
По критериям оценки качества природных сред можно проводить ранжирование территории подвергающийся воздействию со стороны загрязняющих веществ.(таб. 2.2)
Таблица 2.2 - Критерии оценки качества природных сред
| Показатели | параметры | |||
| Экологическое Бедствие (ЭБ) | Чрезвычайная экологическая ситуация (ЧЭС) | Критическая экологическая ситуация (КЭС) | Относительно- удовлетворительная ситуация (ОУС) | |
| pH | <5,6 | 5,7 – 6,5 | 6,6 – 7,0 | >7,0 |