Патологическая стираемость зубов
Категории: Ортопедическая стоматология, Заболевания в ортопедической стоматологии,
Патологическая стираемость зубов — полиэтиологического происхождения патологическое состояние зубочелюстной системы. Характеризуется чрезмерной убылью эмали или эмали и дентина всех или только отдельных зубов.
Патологическая стираемость зубов встречается у людей среднего возраста, достигая наибольшей частоты (35%) у 40—50-летних, причем у мужчин отмечается чаще, чем у женщин. На фоне врожденной патологии развития патологическая стираемость зубов отмечается у людей и подростков.
Этиология и патогенез
Возникновение патологической стираемости зубов связано с действием различных этиологических факторов, а также их различных комбинаций.
Условно можно выделить 3 группы причин патологической стираемости зубов:
1) функциональная недостаточность твердых тканей зубов;
2) чрезмерное абразивное воздействие на твердые ткани зубов;
3) функциональная перегрузка зубов.
Функциональная недостаточность твердых тканей зубов. Эта недостаточность может быть следствием эндогенных и экзогенных факторов. К эндогенны м факторам относят врожденные или приобретенные патологические процессы в организме человека, нарушающие процесс формирования, минерализации и жизнедеятельности тканей зубов.
Врожденная функциональная недостаточность твердых тканей зубов может быть следствием патологических изменений эктодермальных клеточных образований (неполноценность эмали) или патологических изменений мезодермальных клеточных образований (неполноценность дентина) либо их сочетания. Одновременно подобное нарушение развития может наблюдаться при некоторых общесоматических наследственных заболеваниях: мраморной болезни (врожденный диффузный остеосклероз или остеопороз почти всего скелета); синдромах Порака—Дюранта, Фролика (врожденный несовершенный остеогенез) и синдроме Лобштейна (поздний несовершенный остеогенез). К этой группе наследственных поражений следует отнести дисплазию Капдепона.
При мраморной болезни отмечаются замедленное развитие зубов, их позднее прорезывание и изменение строения с выраженной функциональной недостаточностью твердых тканей. Корни зубов недоразвиты, корневые каналы, как правило, облитерированы. Одонтогенные воспалительные процессы отличаются тяжестью течения и нередко переходят в остеомиелит.
При синдромах Фролика и Лобштейна зубы имеют нормальную величину и правильную форму. Характерна окраска коронок зубов — от серой до коричневой с высокой степенью прозрачности. Степень окрашивания разных зубов у одного и того же больного различна. Стирание больше выражено у резцов и первых моляров. Дентин зубов при данной патологии недостаточно минерализован, эмалево-дентинное соединение имеет вид прямой линии, что свидетельствует о недостаточной прочности его.
Такую же картину можно наблюдать при синдроме Капдепона. Зубы нормальных величины и формы, но с измененной окраской, различной у разных зубов одного больного. Чаще всего окраска водянисто-серая, иногда с перламутровым блеском. Вскоре после прорезывания зубов эмаль скалывается, а обнажившийся дентин вследствие низкой твердости быстро истирается. Нарушенная минерализация дентина приводит к снижению его микротвердости почти в 1, 5 раза по сравнению с нормой. Полость зуба и каналы корня облитерированы. Электровозбудимость пульпы стершихся зубов резко снижена. На химические, механические и температурные раздражители пораженные зубы реагируют слабо.
Облитерация полости зуба и корневых каналов при данной дисплазии начинается еще в процессе формирования зубов, а не является компенсаторной реакцией на патологическую стираемость. В области верхушек корней нередко отмечают разрежение костной ткани.
В отличие от функциональной недостаточности зубов при синдромах Фролика и Лобштейна дисплазия Капдепона наследуется как постоянный доминантный признак.
К приобретенным этиологическим эндогенным факторам патологической стираемости зубов следует отнести большую группу эндокринопатий, при которых нарушается минеральный, в основном фосфорно-кальциевый, и белковый обмен.
Гипофункция гипофиза передней доли, сопровождающаяся дефицитом соматотропного гормона, тормозит образование белковой матрицы в элементах мезенхимы (дентин, пульпа). Такой же эффект оказывает дефицит гонадотропного гормона гипофиза.
Нарушение секреции адренокортикотропного гормона гипофиза приводит к активации белкового катаболизма и деминерализации.
Патологические изменения в твердых тканях зубов при нарушении функции щитовидной железы связаны в основном с гипосекрецией тиреокальцитонина. При этом нарушается переход кальция из крови в ткани зуба, т. е. изменяется пластическая минерализующая функция пульпы зуба.
Наиболее выраженные нарушения в твердых тканях зубов наблюдаются при изменении функции паращитовидных желез. Паратгормон стимулирует остеокласты, которые содержат протеолитические ферменты (кислую фосфатазу), способствующие разрушению белковой матрицы твердых тканей зуба. При этом выводятся кальций и фосфор в виде растворимых солей — цитрата и молочно-кислого кальция. Вследствие дефицита активности в остеобластах ферментов лактатдегидрогеназа и изоцитратдегидрогеназа обмен углеводов задерживается в стадии образования молочной и лимонной кислот. В результате образуются хорошо растворимые соли кальция, вымывание которого приводит к существенному снижению функциональной ценности твердых тканей зубов.
Другим механизмом деминерализации твердых тканей зубов при патологии паращитовидных желез является гормональное торможение реабсорбции фосфора в канальцах почек.
К деминерализации твердых тканей зубов, усилению белкового катаболизма приводят также нарушения функции коры надпочечников, половых желез.
Особое значение в возникновении функциональной недостаточности твердых тканей зубов, приводящих к патологической стираемое™ их, имеют нейродистрофические нарушения. Раздражение различных отделов центральной нервной системы (ЦНС) в эксперименте приводило к повышенной стираемости эмали и дентина зубов у подопытных животных.
К экзогенны м фактора м функциональной недостаточности твердых тканей зубов следует отнести в первую очередь алиментарную недостаточность. Неполноценность питания (недостаток минеральных веществ, белковая неполноценность продуктов, несбалансированность рациона) нарушают обменные процессы в организме человека и, в частности, минерализацию твердых тканей зубов.
К функциональной недостаточности твердых тканей зубов вследствие недостаточной минерализации может приводить задержка всасывания кальция в кишечнике при дефиците витамина D, дефиците или избытке жира в пище, колите, профузном поносе. Наибольшее значение эти факторы приобретают в период формирования и прорезывания зубов. Недостаток витаминов D и Е в организме больного, также как и гиперсекреция паратгормона, тормозят реабсорбцию фосфора в почечных канальцах и способствуют его чрезмерному выведению из организма, нарушению процесса минерализации твердых тканей. Такая деминерализация наблюдается и при заболеваниях почек.
Химическое повреждение твердых тканей зубов встречается на химических производствах и является профессиональным заболеванием. Наблюдается также кислотный некроз твердых тканей зубов у больных с ахилическим гастритом, перорально принимающих соляную кислоту. Необходимо подчеркнуть большую чувствительность эмали зубов к кислотному воздействию.
Уже в начальных стадиях кислотного некроза у больных появляется чувство онемения и оскомины в зубах. Могут возникать боли при воздействии температурных и химических раздражителей, а также самопроизвольные боли. Иногда больные предъявляют жалобы на ощущение прилипания зубов при их смыкании.
По мере отложения заместительного дентина, дистрофических и некротических изменений в пульпе пораженных зубов эти ощущения притупляются или исчезают. Как правило, при кислотном некрозе поражаются передние зубы. Исчезает эмаль в области режущих краев, в процесс деструкции вовлекается подлежащий дентин. Постепенно коронки пораженных зубов, стираясь и разрушаясь, укорачиваются и становятся клиновидными.
Значительное нарушение функционального состояния твердых тканей зубов встречается в условиях фосфорного производства. Отмечены некротические изменения структуры дентина, в , некоторых случаях — отсутствие заместительного дентина, необычная структура цемента, сходная со структурой костной ткани.
Среди физических факторов, снижающих функциональную ценность твердых тканей зубов и приводящих к развитию патологической стираемости зубов, особое место занимает лучевой некроз. Это объясняется увеличением числа больных, подвергнутых лучевой терапии в комплексном лечении онкологических заболеваний области головы и шеи. При этом первичным считается лучевое повреждение пульпы, которое проявляется в нарушении микроциркуляции с явлениями выраженного полнокровия в прекапиллярах, капиллярах и венулах, периваскулярных кровоизлияниях в субодонтобластическом слое. В одонтобластах отмечаются вакуольная дистрофия, некроз отдельных одонтобластов. Кроме диффузного склероза и петрификации, наблюдается образование дентиклей разных размеров и локализаций, различной степени организованности. Во всех зонах дентина и цемента обнаруживаются явления деминерализации и участки деструкции. Указанные изменения в твердых тканях наступают в различные сроки после проведенного облучения и зависят от общей дозы. Наибольшие изменения в тканях зубов отмечаются в период с 12-го по 24-й месяц после лучевой терапии по поводу новообразований в области головы и шеи. В результате значительных деструктивных поражений пульпы изменения твердых тканей носят необратимый характер.
Для профилактики поражений зубов при лучевой терапии заболеваний челюстно-лицевой области необходимо накрывать зубы на период сеанса облучения пластмассовой каппой типа боксерской шины, проводить тщательную санацию, правильный гигиенический уход.
Вторую группу этиологических факторов патологической стираемости зубов составляют различные по характеру факторы, общим моментом которых является чрезмерно абразивное воздействие на твердые ткани зубов. Данные обследования жителей Ямало-Ненецкого округа [Любомирова И. М., 1961] выявили большое число тяжелых случаев патологической стираемости зубов вплоть до уровня десны в результате употребления жителями очень жесткой пищи — мороженного мяса и рыбы.
Многолетние наблюдения С. М. Ремизова за абразивным действием различных по конструкции зубных щеток, зубного порошка и зубных паст убедительно показали, что неправильное, нерациональное применение средств гигиены и ухода за зубами может превратиться из лечебно-профилактического средства в грозный разрушающий фактор, приводящий к патологической стираемости зубов. В норме имеется значительное различие микротвердости эмали (390 кгс/мм2 ) и дентина (80 кгс/мм2 ). Поэтому потеря эмалевого слоя приводит к необратимому износу зубов вследствие значительно меньшей твердости дентина.
Сильное абразивное действие на твердые ткани зубов оказывает и производственная пыль на предприятиях с сильной запыленностью (горнодобывающая промышленность, литейное производство). Значительная патологическая стираемость зубов встречается у работников угольных шахт.
В последнее время в связи с широким внедрением в ортопедическую стоматологическую практику протезов из фарфора и металлокерамики участились случаи патологической стираемости зубов, причиной которых является чрезмерное абразивное воздействие плохо глазурированной поверхности фарфора и керамики.
Изучение поверхности естественных зубов и зубных протезов из различных керамических материалов позволило установить, что поверхность естественного зуба гладкая, без шероховатостей, выступов, а видимые царапины являются следствием механического износа. Состояние поверхности фарфора имеет резкое отличие, заключающееся в наличии значительного количества неровностей заостренной формы точечного характера или в виде остеклованных участков с включением острых зерен. Более равномерную поверхность имеют образцы, изготовленные из «Сикора». Видимые шероховатости меньших размеров с большим радиусом закругления. Однако нарушение глянцевой поверхности выявляет пористый характер основного материала. Образец из литьевого ситалла имеет гладкую поверхность, лишенную выступов и шероховатостей.
Как правило, состояние поверхности характеризуется числом неровностей, приходящихся на единицу площади, и радиусом закругления вершин этих неровностей. При взаимодействии зубов-антагонистов основное значение имеет фактическая площадь контакта, которая прямо пропорциональна по величине нагрузке и обратно пропорциональна микротвердости материала. Зная состояние поверхности материала (плотность неровностей и радиус их закругления), можно приблизительно оценить площадь их контакта и предельные нагрузки, при которых начинается разрушение поверхности. Сравнение состояния поверхности фарфоровых и ситалловых протезов, полученных различными способами, дает основание утверждать, что величина и плотность шероховатостей поверхности зубных коронок определяется способом их изготовления. Формирование поверхности фарфоровых протезов происходит в процессе спекания поликомпонентных порошков, включающих различные по тугоплавкости составляющие. Острые выступы являются наиболее тугоплавкими компонентами материала, эти участки вследствие повышенной тугоплавкости, а следовательно, и повышенной вязкости (в процессе спекания) не могут снивелироваться силами поверхностного натяжения.
Основой для изготовления сикоровых изделий является гомогенная стекломасса, что исключает появление на их поверхности значительных неоднородностей. Однако метод спекания порошков предполагает неравномерность поверхностного натяжения в процессе спекания, следствием чего является наличие на поверхности отдельных выступов. Механическая полировка не позволяет сгладить шероховатости вследствие того, что вскрывается глазурная пленка и шероховатость увеличивается.
Таким образом, ситалловые зубные протезы, особенно изготовленные методом литья (В. Н. Копейкин, И. Ю. Лебеденко, С. В. Анисимова, Ю. Ф. Титов), по сравнению с протезами из фарфора, получаемыми методом спекания порошков, имеют значительно более гладкую поверхность, которая не меняется при длительной эксплуатации вследствие тонкокристаллической структуры ситалла и отсутствия в нем пор. Нарушение глазурованного слоя протезов, возникающее во время пришлифовки зафиксированных во рту ситалловых и фарфоровых протезов, резко увеличивает шероховатость поверхности, а следовательно, и коэффициент его трения с антагонистом, что в совокупности с высокой твердостью материала может приводить к интенсивному абразивному износу твердых тканей зубов-антагонистов. Поэтому при изготовлении протезов из керамических материалов следует для профилактики осложнений в виде патологической стираемости антагонирующих зубов тщательно выверять окклюзионные контакты на этапе припасовки протезов, обязательно хорошо заглазуровывать поверхность керамических протезов, не нарушая ее после фиксации.
Патологическая стираемость зубов может быть следствием особенностей характера жевания, при котором все зубы или только часть зубов испытывают чрезмерную функциональную нагрузку.
В таких случаях чрезмерная функциональная нагрузка со временем может приводить к двум типам осложнений: со стороны опорного аппарата зубов — пародонта или со стороны твердых тканей зубов — патологическая стираемость зубов, которая чаще возникает на фоне функциональной недостаточности твердых тканей, хотя может наблюдаться и у зубов с нормальными строением и минерализацией эмали и дентина. Перегрузка зубов может иметь очаговый или генерализованный характер.
Одна из причин очаговой функциональной перегрузки зубов — патология прикуса. При наличии патологии в процессе жевания в различные фазы окклюзии определенные группы зубов испытывают чрезмерную нагрузку и как следствие возникает патологическая стираемость зубов. Примером может служить стираемость небной поверхности передних зубов верхнего ряда и вестибулярной поверхности резцов нижней челюсти у больных с глубоким блокирующим прикусом. Частой причиной патологической стираемости отдельных зубов бывает аномалия положения или формы зуба, приводящая к возникновению суперконтакта на этом зубе в процессе функции.
Вид прикуса может также усугублять развитие патологической стираемости зубов, возникшей в результате функциональной неполноценности твердых тканей зубов или чрезмерного абразивного воздействия различных факторов. Так, при прямом прикусе процессы стирания твердых тканей протекают значительно быстрее, чем при других видах прикуса.
Частичная адентия (первичная или вторичная), особенно в области жевательных зубов, приводит к функциональной перегрузке оставшихся зубов. При двусторонней потере жевательных зубов передние зубы испытывают не только чрезмерную, но и несвойственную им функциональную нагрузку. При этом наблюдается патологическая стираемость оставшихся антагонирующих зубов.
К чрезмерной функциональной нагрузке приводят и врачебные ошибки при протезировании дефектов зубных рядов: отсутствие множественного контакта зубов во все фазы всех видов окклюзии обусловливает перегрузку ряда зубов и их стираемость. Часто наблюдается стираемость отдельных зубов, антагонирующих с зубами, имеющими выступающие пломбы из композитных материалов, вследствие присущего композитам сильного абразивного действия.
В ортопедической стоматологии в настоящее время большой арсенал материалов для изготовления зубных протезов. При их использовании следует строго соблюдать показания и обращать особое внимание на возможность их сочетанного применения.
Например, пластмасса для несъемных протезов «Синма» уступает по твердости эмали зубов. Поэтому при изготовлении пластмассовых протезов (мостовидные протезы с открытой жевательной поверхностью или съемные протезы) в области жевательных зубов неизбежно возникновение в ближайшие после протезирования сроки функциональной перегрузки передних зубов вследствие стираемое™ пластмассы. Другой пример: при сочетанном изготовлении протезов из драгоценных металлов и пластмассовых антагонистов пластмасса за счет присущего ей высокого абразивного эффекта будет приводить к быстрому износу коронок из драгоценных сплавов, а следовательно, к функциональной перегрузке имеющихся во рту антагонирующих естественных зубов. При оценке абразивного износа следует принимать во внимание не только твердость материала, но и величину коэффициента его трения с материалом антагониста: чем больше коэффициент трения, тем значительнее абразивное действие материала. Так, например, твердость ситалла «Сикор» выше твердости фарфора «Витадур», однако его абразивное действие меньше, так как коэффициент его трения с тканями естественных зубов ниже.
Одной из причин генерализованной патологической стираемости зубов принято считать бруксоманию, или бруксизм, — бессознательное (чаще ночное) сжатие челюстей или привычные автоматические движения нижней челюсти, сопровождающиеся скрежетанием зубов. Бруксизм наблюдается как у детей, так и у взрослых. Причины бруксизма недостаточно выяснены. Считают, что бруксизм является проявлением невротического синдрома, наблюдается также при чрезмерном нервном напряжении. Бруксизм относится к парафункциям, т. е. к группе извращенных функций.
Роль функциональной перегрузки зубов в этиологии патологической стираемости зубов была доказана в эксперименте на животных [Каламкаров X. А., 1984]. Перегрузку передних зубов моделировали, удаляя жевательные зубы либо изготавливая на передние зубы нижней челюсти коронки, повышающие прикус.
В результате уже через 3 мес была отмечена значительная стираемость режущего края передних зубов. При гистологическом исследовании установлено, что морфологические изменения при патологической стираемости зубов вследствие функциональной перегрузки имеют место во всех тканях пародонта.
При патологической стираемости зубов в большинстве случаев в ответ на убыль твердых тканей происходит образование заместительного дентина соответственно локализации стертой поверхности. Количество заместительного дентина различно и не связано со степенью стертости. При массивном отложении заместительного дентина отмечается его глобулярное строение. Полость зуба уменьшается в объеме вплоть до полной облитерации.
Конфигурация измененной зубной полости зависит от топографии стертости и степени повреждения. Нередко наблюдается образование дентиклей различной формы, размеров и степени зрелости.
В пульпе патологически стертых зубов имеются существенные изменения (рис. 85). Они выражаются, в частности, в следующем:
В изменении васкуляризации: обеднение пульпы сосудами, склерозирование сосудов; иногда, наоборот, отмечаются усиленная васкуляризация, небольшие очаги кровоизлияний; в частичной или полной вакуолизации, атрофии одонтобластов, уменьшении числа клеточных элементов; в сетчатой атрофии, склерозе, гиалинозе пульпы.
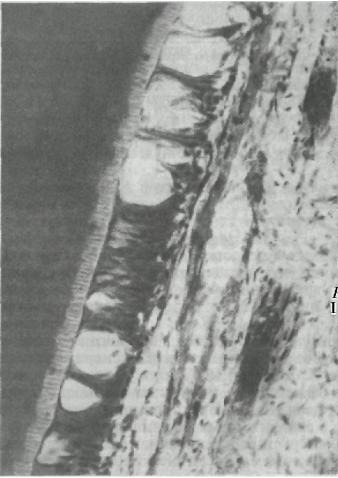
Рис. 85. Вакуолизация слоя одонтопластов при патологической стертости. Микрофото.
Выраженность поражения пульпы зависит от степени патологической стираемости зубов. В нервном аппарате пульпы отмечаются изменения типа раздражения: гипераргирофилия, утолщение осевых цилиндров.
Типичным для патологической стираемости зубов при функциональной перегрузке (более 80%) является компенсаторное увеличение толщины ткани цемента — гиперцементоз (рис. 86).
При этом наслоение цемента происходит неравномерно, наибольшее отмечается у верхушки корня. Увеличивается не только масса цемента, но часто структура его приобретает слоистый вид.
Нередко встречаются цементикли. У некоторых больных наблюдается деструкция цемента с его частичным отслаиванием от дентина, что можно расценивать как остеокластическую резорбцию тканей корня в ответ на функциональную перегрузку.
Изменения в периодонте при патологической стираемости зубов вследствие функциональной перегрузки заключаются в неравномерности ширины периодонтальнои щели на протяжении отдесневого края до верхушки корня. Расширение периодонтальнои щели происходит больше в пришеечной части и у верхушки корня и прямо зависит от степени функциональной перегрузки.

Рис. 86. Гиперцементоз зуба при стираемости. Микрофото.
В средней трети корня периодонтальная щель, как правило, сужена. Во всех случаях отмечаются нарушение локальной гемодинамики, отек, гиперемия, очаговая инфильтрация. Нередко в ответ на чрезмерную функциональную нагрузку в пародонте стершихся зубов развивается хроническое воспаление с образованием гранулем и кистогранулем, что необходимо учитывать при обследовании таких больных и выборе плана лечения (рис. 87).
Патологическая стираемость зубов приводит к изменению формы коронковой части, что в свою очередь способствует изменению направления действия функциональной нагрузки на зуб и пародонт. При этом в последнем возникают зоны сдавления и растяжения, что обязательно приводит к характерным патологическим изменениям в пародонте. В участках сдавления отмечаются рассасывание цемента, его отслаивание от дентина, замещение остеоцементом, остеокластическое рассасывание костной ткани, коллагенизация периодонта. В зонах растяжения, наоборот, наблюдается массивное наслоение цемента, по периферии которого отмечается отложение остеоцемента.

Рис. 87. Рассасывание верхушки корня зуба. Видна также гранулема. Микрофото.
Изменение формы коронковой части при патологической стираемости зубов (ПСЗ) увеличивает функциональную нагрузку на зубы.
Таким образом, при патологической стираемости зубов, возникшей в результате функциональной перегрузки, наблюдается порочный круг: функциональная перегрузка ведет к патологической стираемости зубов, изменению формы коронок, что в свою очередь изменяет функциональную нагрузку, необходимую для пережевывания пищи, увеличивая ее, а это еще больше способствует деструкции твердых тканей зубов и пародонта, усугубляя патологическую стираемость. Поэтому ортопедическое лечение, направленное на восстановление нормальной формы стершихся зубов, следует считать не симптоматическим, а патогенетическим.
Клиническая картина
Клиническая картина патологической стираемости зубов чрезвычайно разнообразна и зависит от степени поражения, топографии, распространенности и давности процесса, его этиологии, наличия сопутствующей общей патологии и поражений зубочелюстно-лицевой системы.
При патологической стираемости зубов в первую очередь нарушаются эстетические нормы вследствие изменения анатомической формы зубов. В дальнейшем при прогрессировании патологического процесса и существенном укорочении зубов изменяются жевательная и фонетическая функция. Кроме того, у части больных даже в начальных стадиях патологической стираемости зубов отмечается гиперестезия пораженных зубов, что нарушает прием горячей, холодной, сладкой или кислой пищи.
Для классификации всего многообразия клинического проявления патологической стираемости зубов выделяются формы, виды и степень поражения. Формы патологической стираемости зубов характеризуют протяженность патологического процесса. Различают генерализованную и локализованную формы.
Генерализованная форма патологической стираемости зубов в свою очередь может сопровождаться снижением окклюзионной высоты (рис. 88).
Виды патологической стираемости зубов отражают преимущественную плоскость поражения зубов: вертикальную, горизонтальную или смешанное поражение (рис. 89).
Степень патологической стираемости зубов характеризует глубину поражения: I степень — поражение не более 1/3 высоты коронки; II степень — поражение 1/3 — 2 /3 высоты коронки; III степень — поражение более 2 /3 коронки зуба.
Патологическим процессом могут быть поражены зубы одной или обеих челюстей, с одной или с обеих сторон. В практике встречаются случаи различной степени поражения зубов одной или обеих челюстей. Характер и плоскость поражения могут быть идентичными, но могут и различаться. Все это обусловливает многообразие клинической картины патологической стертости зубов, которая значительно усложняется при частичной адентии одной или обеих челюстей.

Рис. 88. Стираемость: генерализованная форма.
Для правильной постановки диагноза и выбора оптимального плана лечения при такой многообразной клинической картине патологической стираемости зубов необходимо очень внимательно обследовать больных для выявления этиологических факторов патологической стираемости зубов и сопутствующей патологии. Обследование необходимо проводить в полном объеме согласно традиционной схеме: 1) опрос больного, изучение жалоб, истории жизни и истории заболевания; 2) внешний осмотр; 3) осмотр органов полости рта; пальпация жевательных мышц, височно-нижнечелюстного сустава и др.; 4) аускультация височно-нижнечелюстного сустава; 5) вспомогательные методы: изучение диагностических моделей, прицельная рентгенография зубов, панорамная рентгенография зубов и челюстей, ЭОД, томография, электромиография и электромиотонометрия жевательных мышц.
Жалобы больных могут быть различны и зависят от степени патологической стираемости зубов, топографии и протяженности поражения, давности заболевания, сопутствующей патологии.
При отсутствии сопутствующих поражений челюстно-лицевой области больные с патологической стираемостью зубов жалуются обычно на косметический дефект в связи с прогрессирующей убылью твердых тканей зубов, иногда гиперестезию эмали и дентина, при кислотном некрозе — на чувство оскомины и шероховатость эмали.

Рис. 89. Виды патологической стираемости.
а — вертикальная; 6 — горизонтальная.
Изучая историю жизни больного, обращают внимание на наличие подобной патологии у других членов семьи, что может свидетельствовать о генетической предрасположенности, врожденной функциональной недостаточности твердых тканей зубов.
Следует иметь в виду, что патологическая стираемость зубов может наблюдаться у нескольких членов одной семьи и не только в результате наследственной патологии, но и вследствие общности питания, быта, а иногда и профессиональных вредностей. Все это может способствовать снижению функциональной ценности твердых тканей зубов и повышенному их абразивному износу.
При сборе анамнеза необходимо выявить сопутствующую общесоматическую патологию, врожденные дисплазии, эндокринопатии, нейродистрофические расстройства, заболевания почек, желудочно-кишечного тракта и др. Необходимо очень тщательно выявлять первопричину стираемости. Если из анамнеза и в результате клинического обследования выяснится, что патологическая стираемость зубов возникла на фоне функциональной недостаточности твердых тканей зубов эндогенного происхождения, то при выборе конструкции протеза надо предпочесть такие из них, которые бы минимально перегружали опорные зубы. В противном случае вследствие врожденной (особенно) или приобретенной недостаточности в остеогенезе может произойти рассасывание корней, сильная атрофия костной ткани с зубных альвеол.
Нередко при наследственных болезнях (мраморная болезнь, синдром Фролика и др.) корни стершихся зубов недоразвиты, корневые каналы искривлены и облитерированы. Поэтому в таких случаях сужаются показания к штифтовым конструкциям. Кроме того, выяснение в анамнезе наследственной патологии типа синдромов Фролика и Лобштейна, синдрома Капдепона позволяет предсказать с достаточной степенью вероятности прогноз состояния зубочелюстной системы и опорно-двигательного аппарата в целом у последующих поколений, так как изменения зубов при синдромах Фролика и Лобштейна наследуются как непостоянный доминантный признак, а при синдрома Капдепона — как постоянный доминантный признак.
Выясняя историю настоящего заболевания, обращают внимание на давность возникновения патологической стираемости зубов, характер ее прогрессирования, связь с протезированием зубов и челюстей, характером и условиями труда и быта больного.
При внешнем осмотре лица больного отмечают конфигурацию лица, пропорциональность и симметричность. Определяют высоту нижнего отдела лица в состоянии физиологического покоя и в центральной окклюзии. Внимательно изучают состояние твердых тканей зубов, устанавливая характер, протяженность, степень стертости. Обращают должное внимание на состояние слизистой оболочки рта и пародонта зубов для выявления сопутствующей патологии и осложнений.
Пальпация жевательных мышц позволяет выявить болезненность, асимметрию ощущений, отечность мышц, их гипертонус и предположить наличие парафункций у больного. В дальнейшем для уточнения диагноза необходимо провести дополнительные исследования: электромиографию и электромиотонометрию жевательных мышц, провести консультацию с невропатологом по поводу возможного бруксизма, тщательно расспросить больного и его родственников о возможном скрежетании зубами во сне. Это необходимо для профилактики осложнений и выбора оптимального комплексного лечения такого контингента больных.
Пальпация области височно-нижнечелюстного сустава, также как и аускультация этой области, позволяет выявить патологию, которая нередко встречается при патологической стираемое™ зубов, особенно при генерализованной или локализованной форме, осложненной частичной адентией. В этих случаях необходимы тщательный анализ диагностических моделей и рентгенологическое исследование; фронтальная и боковые томограммы при сомкнутых челюстях и при физиологическом покое.
Электроодонтодиагностика (ЭОД) является обязательным диагностическим тестом при патологической стираемости зубов, особенно II и III степени, а также при выборе конструкции несъемных протезов. Нередко патологическая стираемость зубов сопровождается бессимптомно протекающей гибелью пульпы.
В результате отложения заместительного дентина, частичной или полной облитерации пульповой камеры электровозбудимость пульпы бывает сниженной. При патологической стираемости зубов I степени, сопровождаемой гиперестезией твердых тканей, ЭОД обычно не позволяет выявить отклонения от нормы.
Также как и ЭОД, рентгенография (прицельная и панорамная) является обязательным методом диагностики, позволяющим установить величину и топографию пульповой камеры, топографию, направление и степень облитерации корневых каналов, выраженность гиперцементоза, наличие нередко встречающихся при функциональной перегрузке зубов кист, гранулем у стертых зубов. Все это без сомнения имеет большое значение для выбора правильного плана лечения.
Правильной диагностике и планированию лечения больных с патологической стираемостью зубов, равно как контролю хода и результатов лечения, способствует тщательное изучение диагностических моделей. На диагностических моделях уточняют вид, форму и степень патологической стираемости зубов, состояние зубных рядов, а при их анализе в артикуляторе — характер окклюзионных взаимоотношений зубов и зубных рядов в различные фазы всех видов окклюзии, что особенно важно при диагностике сопутствующей патологии височно-нижнечелюстного сустава и выборе плана лечения.
Лечение
Восстановление анатомической формы стертых зубов зависит от степени, вида и формы поражения. Для восстановления анатомической формы зубов при патологической стертости зубов I степени могут быть использованы вкладки, пломбы (в основном на передних зубах), искусственные коронки; II степени — вкладки, искусственные коронки, бюгельные протезы с окклюзионными накладками; III степени — культевые коронки, штампованные колпачки с окклюзионными напайками.
При патологической стертости зубов II и III степени нельзя применять обычные штампованные коронки, так как возможны осложнения, связанные с травмой маргинального пародонта краем коронки, глубоко продвинутой в десневой карман. Глубокое продвижение штампованной коронки может произойти при фиксации коронки цементом на сильно укороченный зуб. Кроме того, травма маргинального пародонта возможна и в процессе пользования коронкой, когда под действием жевательного давления разрушается толстый слой цемента между жевательной поверхностью стертого зуба и окклюзионной поверхностью коронки и коронка глубоко погружается в десневой карман. Поэтому при наличии показаний к лечению патологической стертости зубов искусственными коронками возможно несколько вариантов их изготовления (рис. 90, 91): 1) цельнолитые коронки; 2) штампованные колпачки с окклюзионными напайками; 3) культевые коронки (штампованные или литые коронки) с предварительным восстановлением высоты коронки зуба культевой вкладкой со штифтом.
При выборе материала для коронок следует учитывать его износостойкость. Если зубы-антагонисты с непораженной эмалью, можно применять металлические, металлокерамические, фарфоровые коронки. При антагонистах с I степенью патологической стертости предпочтительны пластмассовые коронки, металлические коронки из нержавеющей стали, сплавов драгоценных металлов; керамические и цельнолитые протезы из КХС.

Рис. 90. Коронки для лечения патологической стертости, а — каркас окончатой коронки из металла; б — штампованный колпачок с отверстиями на жевательной поверхности; в, г — на коронку и колпачок нанесена пластмасса; д — цельнолитой каркас металлопластмассовой коронки.

Рис. 91. Несъемные протезы типа штифтовых и колпачковыхс окклюзионной литой частью для восстановления формы зубов при патологической стертости.
Встречное протезирование вкладками и(или) коронками с использованием одинаковых по износостойкости конструкционных материалов показано при антагонистах со II — III степенью патологической стертости.
При патологической стертости зубов, возникшей в результате бруксизма и парафункций, следует отдавать предпочтение цельнолитым металлическим и металлопластмассовым (с металлической жевательной поверхностью) протезам из сплавов неблагородных металлов как более прочным на истирание. Металлокерамические протезы у таких больных следует применять ограниченно из-за возможного откола покрытия при непроизвольной нефункциональной чрезмерной окклюзионной перегрузке: ночное скрежетание зубами, спастическое сжатие челюстей и пр.
Выбирая план лечения патологической стертости зубов, осложненной частичной адентией (рис. 92), обязательно основываются на данных ЭОД и рентгенологического контроля опорных зубов. При возникновении патологической стираемости зубов на фоне врожденных нарушений амело- и дентиногенеза нередко наблюдаются несовершенство корней зубов, их функциональная неполноценность, что может приводить к рассасыванию корней таких зубов при использовании их в качестве опор мостовидных протезов. Таким больным показано восстановление стертых зубов искусственными коронками или вкладками с последующим изготовлением съемных (бюгельных или пластиночных) протезов (рис. 93).
Лечение патологической стертости зубов, осложненной снижением окклюзионной высоты. Лечение проводится в несколько этапов: 1) восстановление окклюзионной высоты временными лечебно-диагностическими аппаратами; 2) период адаптации; 3) постоянное протезирование.
На первом этапе проводят восстановление окклюзионной высоты с помощью пластмассовых назубных капп, зубонадесневых капп, съемных пластиночных или бюгельных протезов с перекрытием жевательной поверхности стертых зубов. Такое восстановление может быть одномоментным при снижении окклюзионной высоты до 10 мм от высоты физиологического покоя и поэтапным — по 5 мм каждые 1—1У 2 мес при снижении окклюзионной высоты более чем на 10 мм от физиологического покоя (рис. 94).
Для установления высоты будущего протеза изготавливают восковые или пластмассовые базисы с прикусными валиками, определяют и фиксируют общепринятым способом в клинике требуемое «новое» положение нижней челюсти, обязательно проводят рентгенологический контроль. На рентгенограммах височнонижнечелюстных суставов при сомкнутых зубных рядах в положении, зафиксированном восковыми валиками, должно быть «правильное» положение суставной головки (на скате суставного бугорка) равномерное с обеих сторон. Только после этого такое положение фиксируют временными лечебно-диагностическими аппаратами-протезами.
Второй этап — период адаптации продолжительностью не менее 3 нед — требуется для полного привыкания больного к «новой» окклюзионной высоте, которая возникает благодаря перестройке миотатического рефлекса в жевательных мышцах и височно-нижнечелюстном суставе.

Рис. 92. Мостовидный протез, применяемый при патологической стертости.
а — паяный каркас протеза; б — каркас облицован пластмассой; в — цельнолитой каркас протеза (слева) и каркас, облицованный пиропластом (справа).

В этот период больной должен находиться под динамическим наблюдением лечащего врача стоматолога-ортопеда (не реже 1 раза в неделю, а при необходимости: субъективные неприятные ощущения, боль, дискомфорт, неудобство при пользовании лечебно-диагностическими аппаратами — и чаще).
При использовании несъемных лечебно-диагностических аппаратов — пластмассовых капп — процесс адаптации протекает быстрее, чем при восстановлении окклюзионной высоты съемными конструкциями, особенно пластиночными. Это объясняется не только конструктивными особенностями протезов, но и тем, что несъемные каппы фиксированы цементом и больные ими пользуются постоянно. Наоборот, съемными аппаратами больные нередко пользуются лишь непродолжительное время суток, снимая их во время работы, еды, сна. Такое использование аппаратов-протезов следует расценивать не только как бесполезное, но как вредное, так как оно может привести к патологическим изменениям в височно-нижнечелюстном суставе, к мышечно-суставным дисфункциям.
Поэтому необходимо проводить с больными предварительные разъяснительные беседы с предупреждением о возможных осложнениях при непостоянном пользовании лечебным аппаратом и необходимости обязательного обращения к лечащему врачу стоматологу-ортопеду при возникновении неприятных ощущений в височно-нижнечелюстном суставе, жевательных мышцах, слизистой оболочке протезного ложа. В момент припасовки лечебно-диагностического аппарата и на контрольных осмотрах особо тщательно выверяют окклюзионные контакты во все фазы всех видов окклюзии, проверяют качество полировки протеза, отсутствие острых выступов и краев, которые могут травмировать мягкие ткани.
Если при одномоментном повышении окклюзионной высоты на 8—1 0 мм у больного возникают сильные боли, нарастающие в течение первой недели в области височно-нижнечелюстного сустава и (или) жевательных мышц, необходимо снизить высоту на 2—3 мм до исчезновения болей, а затем, через 2—3 нед, повторно повысить окклюзионную высоту до необходимой величины. Технически это легко выполнимо путем сошлифовывания слоя пластмассы на жевательной поверхности лечебно-диагностического аппарата или нанесения дополнительного слоя быстротвердеющей пластмассы.
Необходимо подчеркнуть, что период адаптации в 2—3 нед считается с момента исчезновения последних неприятных ощущений у больного в области височно-нижнечелюстного сустава или жевательных мышц.
Иногда из-за неприятных субъективных ощущений неоднократные попытки повысить окклюзионную высоту до желаемого оптимального уровня (на 2 мм ниже высоты физиологического покоя) так и остаются неудачными. Таким больным изготавливают постоянные протезы при максимальной окклюзионной высоте, к которой он смог адаптироваться. Обычно это наблюдается у больных, снижение окклюзионной высоты у которых произошло более 10 лет назад и в височно-нижнечелюстном суставе успели произойти необратимые изменения. Такая же картина наблюдается у больных с патологической стираемостью зубов, осложненной нарушениями психо-эмоциональной сферы, которые чрезмерно сосредотачиваются на характере, степени своих субъективных ощущений. Ортопедическое лечение патологической стертости зубов, осложненной снижением окклюзионной высоты, у такой категории больных чрезвычайно сложно, прогноз сомнителен, а лечение необходимо проводить параллельно с лечением у психоневролога.
Третий этап лечения — постоянное протезирование — принципиально не отличается по виду конструкций зубных протезов, применяемых при лечении патологической стертости зубов. Важно отметить лишь необходимость использования конструкционных материалов, гарантирующих стабильность установленной окклюзионной высоты. Недопустимо применение пластмассы на жевательной поверхности мостовидных протезов. В съемных протезах предпочтительно использовать фарфоровые зубы, литые окклюзионные накладки (рис. 95). Для стабилизации окклюзионной высоты применяют встречные вкладки, коронки.
Важное условие достижения хороших результатов постоянного протезирования — изготовление протезов под контролем временных лечебно-диагностических капп. Возможно поэтапное изготовление постоянных протезов. Сначала изготавливают протезы на одну половину верхней и нижней челюстей в области жевательных зубов, при этом во фронтальном участке и на противоположной половине обеих челюстей остаются фиксированными временные каппы.

Рис. 95. Патологическая стертость; смешанная форма (а). Бюгельный протез с окклюзионной накладкой в группе жевательных зубов (б) и металлокерамические коронки на переднюю группу зубов (в).
При припасовке постоянных протезов временные каппы позволяют точно установить окклюзионную высоту и оптимальные окклюзионные контакты в различные фазы всех видов окклюзии, к которым адаптирован больной. После фиксации постоянных протезов на одной половине челюстей снимают временные каппы и приступают к изготовлению постоянных протезов на остальной участок зубного ряда. На период изготовления протезов временно фиксируют лечебно-диагностические каппы.
Лечение патологической стертости зубов без снижения окклюзионной высоты. Лечение также проводится поэтапно. На первом этапе методом постепенной дезокклюзии перестраивают участок зубного ряда с патологической стертостью зубов и вакатной гипертрофией альвеолярного отростка, добиваясь достаточного окклюзионного пространства для восстановления анатомической формы стертых зубов (рис. 96). Для этого на зубы, антагонирующие с зубами, подлежащими «перестройке», изготавливают пластмассовую каппу. Соблюдают следующее правило: сумма коэффициентов выносливости пародонта зубов, включенных в каппу, должна в 1,2—1, 5 раза превышать сумму коэффициентов выносливости пародонта зубов, подлежащих «перестройке».

Рис. 96. Лечебная каппа из пластмассы на передние зубы нижней чалюсти при локализованной патологической стертости, а — до лечения; б — каппа на зубах; в — после лечения.
Каппу изготавливают таким образом, чтобы в области перестраиваемых зубов был плотный плоскостной контакт с каппой, а в группе разобщенных жевательных зубов зазор не превышал 1 мм (должен свободно проходить сложенный вдвое лист писчей бумаги). Для контроля и устранения возможных осложнений после фиксации каппы больного просят прийти на следующий день, а затем предлагают явиться на прием, как только больной определит возникновение плотного контакта в группе разобщенных жевательных зубов. Предварительно больного надо обучить контролировать наличие окклюзионного контакта зубов надкусыванием тонкой полоски писчей бумаги. После достижения контакта каппу корригируют быстротвердеющей пластмассой, добиваясь дезокклюзии в группе жевательных зубов до 1 мм, для чего между молярами прокладывают слои пластинки бюгельного воска. Вновь назначают на прием по достижении плотного контакта разобщенных зубов. Таким образом, способом постепенной дезокклюзии добиваются необходимой перестройки участка вакатной гипертрофии альвеолярного отростка.
Метод постепенной дезокклюзи и применим при лечении локализованной формы патологической стертости зубов без снижения окклюзионной высоты. При генерализованной форме такой патологии применяют метод последова тельно й дезокклюзии . Он заключается в постепенной дезокклюзии последовательно сначала во фронтальном участке, потом с одной стороны в области жевательных зубов, затем с другой. Учитывая большую длительность такой перестройки, лечение генерализованной формы патологической стертости зубов без снижения окклюзионной высоты следует считать наиболее сложным и трудоемким с сомнительным прогнозом, так как не всегда метод дезокклюзии позволяет добиваться желаемого результата. Кроме того, он противопоказан при патологии околоверхушечных тканей, атрофии костной ткани и в области зубов, подлежащих «перестройке», заболеваниях височно-нижнечелюстного сустава.
Второй этап — восстановление анатомической формы стертых зубов одним из рассмотренных ранее видов протезов. Прогноз при лечении патологической стертости зубов в целом благоприятный. Результаты лечения лучше улиц молодого и среднего возраста с начальной степенью стираемости. Однако необходимо отметить возможность рецидивов у больных с патологической стертостью зубов на фоне бруксизма и парафункций, что подтверждает мысль о недостаточности лишь ортопедических вмешательств без соответствующих психоневрологических коррекций.
Все больные с патологической стираемостью зубов должны состоять на диспансерном наблюдении.
Диагностика Патологической стираемости зубов:

| 
| 
|

| Для правильной постановки диагноза и выбора оптимального плана лечения при такой многообразной клинической картине патологической стираемости зубов необходимо очень внимательно обследовать больных для выявления этиологических факторов патологической стираемости зубов и сопутствующей патологии. Обследование необходимо проводить в полном объеме согласно традиционной схеме:
|