П - перліт; С - сорбіт; Т - тростит; Б - бейніт
Лекція№1
Тема: Класифікація металів і дефекти кристалічної будови.
1.1 Класифікація металів.
1.2 Кристалічна будова металів.
1.3 Дефекти кристалічної будови.
1.4 Методи дослідження структури металів.
1.1 Класифікація металів.
Матеріалознавство є наукою про будову, властивості та методи обробки металевих й неметалевих матеріалів.
Закон П. П. Аносова – головний закон матеріалознавства:
 Склад
Склад
 структура властивості.
структура властивості.
 Обробка
Обробка
Теоретичною основою матеріалознавства є відповідні розділи фізики та хімії. Жодна галузь сучасного виробництва не обходиться без конструкційних матеріалів, особливо без металів. Саме тому майбутній інженер повинен здобути у вищому навчальному закладі ґрунтові теоретичні знання не лише про склад, будову та властивості матеріалів, але й про новітні технології обробки матеріалів. У матеріалознавстві широко використовують структурні дослідження, фізичні та механічні випробовування. У наслідок матеріалознавчих досліджень в промислове виробництво запроваджуються нові матеріали (надтверді, жароміцні, порошкові, композитні, полімерні та інші).
Металами називають речовини, які мають кристалічну будову, добру пластичність, високу електро- й теплопровідність та специфічний металевий блиск. З 106 елементів періодичної системи Менделєєва 76 є металами. Найпоширеніші в природі метали – це Al (8,8 % маси земної кори) і Fe (4,6 %).
Метали поділяють на дві групи: чорні й кольорові. До чорних металів належить залізо і стопи на його основі – сталі та чавуни. Ці стопи займають важливе місце в машинобудівній промисловості завдяки порівняно невисокій вартості, добрим технологічним і механічним властивостям. Недоліками чорних металів є висока густина та низька корозійна тривкість. З огляду на це спостерігається стійка тенденція до широкого використання металевих стопів на основі Ti, Al, Mg. Кольоровими вважають всі інші метали, крім чорних. Для технічних потреб застосовують близько 70 кольорових металів. Серед них найбільше значення мають Al, Cu, Mg, Ti, Ni, Pb, Zn, Sn, Mo, W, Co, Ta, Zr, Nb. Cu і Al у чистому вигляді використовують для потреб електротехніки та теплотехніки. Здебільшого кольорові метали застосовують у вигляді стопів. Багато кольорових металів слугують легувальними елементами для стопів. Хімічно чисті метали майже не застосовують з огляду на відсутність необхідних механічних і технологічних властивостей. Якщо, наприклад, до даного рідкого металу додати або замінити в ньому деяку кількість хімічних елементів (переважно металів), то після кристалізації отримаємо нову речовину з певним комплексом властивостей, яка називається стопом цього металу ( лише на основі заліза створено більше як 10000 сплавів). Окремі властивості металевих стопів можна додатково поліпшувати, використовуючи відповідну термічну чи хіміко-термічну обробки.
Характерні фізичні, хімічні та механічні властивості, які відрізняють метали від інших елементів, визначаються електронною будовою їх атомів. Число електронів у електрично нейтральному атомі будь-якого елемента дорівнює його порядковому номеру в періодичній системі Менделєєва. Саме розподіл електронів на енергетичних рівнях і підрівнях є причиною періодичних змін валентності елементів і їх властивостей зі збільшенням атомного номера.
Тип зв’язку елементарними частинками в кристалі визначається електронною будовою атомів, які взаємодіють. Найважливіші зв’язки: іонний, ковалентний і металевий. Тип зв’язку істотно впливає на властивості матеріалу.
Іонній зв’язок виникає між різнорідними атомами, наприклад натрію і хлору, один з яких віддає свій валентний електрон і перетворюється у позитивно заряджений іон (Na+), а інший приймає електрон і стає негативно зарядженим іоном (Cl-). Такий зв’язок типовий для неорганічних сполук. У більшості випадків іонні кристали – діелектрики.
Ковалентний зв’язок створюється за рахунок об’єднання валентних електронів сусідніх атомів у одному енергетичному рівні зовнішній орбіті. Об’єднані електрони належать водночас обом атомам і перебувають на спільній орбіті. Ці електрони взаємодіють як два електромагніти. Ковалентний зв’язок утворюють як однорідні атоми (Si, C в кристалічній гранці алмазу), так і різнорідні (Fe – C у хімічній сполуці Fe3C, Al-N-AlN). Ковалентний зв’язок дуже міцний. Багато кристалів з таким зв’язком відзначаються високою температурою топлення, значною твердістю (карбіди, нітриди) і суттєвою зносостійкістю.
Металевий зв’язок реалізується за рахунок електростатичної взаємодії між позитивно зарядженими іонами та негативно зарядженими вільними електронами. Валентні електрони атомів металу порівняно легко втрачають зв’язок зі своїми ядрами, утворюючі так званий електронний газ. Металевий зв’язок не скерований в одному напрямку. Добра електро- і теплопровідність металів забезпечується вільними електронами.
1.2 Кристалічна будова металів.
Кристалічна будова металів характеризується закономірним, геометрично вірним розташуванням атомів (іонів) у просторі. Елементарною кристалічною коміркою називається такий найменший об’єм, який дає нам уявлення про взаємне розташування атомів у всьому кристалі. Переважна більшість металів має одну з перелічених нижче елементарних кристалічних комірок (стенд):
- ОЦК – об’ємноцентровану кубічну(Cr, Mo, W, V)
- ГЦК – гранецентровану кубічну(Al, Ni, Cu, Pb)
- ГПУ – гексагональну щільноукладену.(Cd, Be, Zn, Mg)
- Тетрагональну (мартенсит)
Усі метали та сплави у твердому стані є тілами кристалічними.
1.3 Дефекти кристалічної будови.
На відміну від ідеальних, реальні кристали мають багато різних дефектів – зон кристалу, де порушено правильне розташування атомів. За геометричною ознакою дефекти кристалічної будови поділяють на: точкові, лінійні, поверхневі, об’ємні.
Точкові дефекти ( нульвимірні ) дуже малі в усіх трьох вимірах у просторі: їх розміри не перевищують декількох параметрів кристалічної комірки. До таких дефектів належать вакансії, міжвузлови атоми, атоми домішок тощо.
Вакансією називається порожнє місце в кристалі, де мав би перебувати атом (рис. 1,а). Утворення вакансії за механізмом Шотткі бачимо на рис.2. Ос-
кільки атоми коливаються навколо положення рівноваги, то окремий атом,
наприклад, атом 1 з вищою ніж середня енергією, покидає вузол кристалічної ґратки й потрапляє на поверхню кристалу або на границю між зернами. На місці, де перебував атом 1, утворилась вакансія (рис.2,а), яку заповнює згодом атом 2 (рис.2,б), а потім атом 3 (рис.2,в). В результаті відбувається міграція вакансії в глибину кристалу.
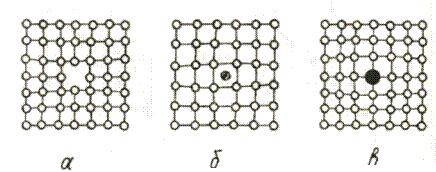
Рис.1. Точкові дефекти
а – вакансія, б - міжвузловий атом, в - атом домішки
Кожній температурі відповідає своя рівноважна концентрація вакансій. Що вища температура кристалу, то більше в ньому вакансій і частіше вони переходять від вузла до вузла. При температурі, близькій до температури топлення металу, кількість вакансій становить близько 1 % від числа атомів у кристалі. Пересичення вакансіями може наступити внаслідок раптового охолодження під час гартування, пластичної деформації або опромінення металу нейтронами. З часом пересиченість вакансіями зменшується за рахунок їх виходу на поверхню кристалу чи на границі зерен. Вакансії сприяють перебігу дифузійних процесів. Зі збільшенням кількості вакансій зменшується густина, електро- і теплопровідність кристалу.

Рис.2. Схема утворення вакансії за механізмом Шотткі.
Міжвузловим вважається атом, що вийшов із положення рівноваги і зайняв простір між вузлами (рис. 1,б). На його місці утворилась вакансія (на рисунку не показана). Перехід атомів у міжвузлове положення викликає опромінення нейтронами і значно менший вплив мають теплові коливання атомів.
Атоми домішок є навіть у найчистішому металі. Вони або заміщають атоми основного металу у вузлах кристалічної ґратки (рис.1,в) або розташовуються між вузлами (як на рис. 1,б). У близькому оточенні точкових дефектів кристалічна гратка викривляється. Такі спотворення суттєво не позначаються на механічних властивостях металу, зате вони позначаються на деяких його фізичних властивостях, наприклад, на електроопорі.
Лінійні порушення будови кристалу мають малі розміри в двох вимірах і велику довжину в третьому. Дуже важливими серед лінійних дефектів є крайові та гвинтові дислокації, їх назва походить від латинського слова dislocation, що в перекладі означає розміщення. Крайова дислокація — це лінія АВ (рис.3) на краю зайвої атомної півплощини АВЕС в кристалі. Одним із способів утворення крайової дислокації є зсув частини атомів кристалу відносно іншої частини атомів на ділянці площини ковзання АВСВ (рис.3,а) під дією прикладеної сили F. Внаслідок такого зсуву у верхній частині кристалу маємо на одну атомну площину більше, ніж у нижній. Зайва площина АВЕС, яка перпендикулярна до напрямку зсуву, називається екстраплощиною. Вона не має продовження у нижній частині кристалу. Екстраплощина ніби розклинює кристал, зближаючи атоми над дислокацією і розсуваючи їх під нею. Тому в невеликій спотвореній зоні — ядрі дислокації — міжатомні відстані менші або більші від нормальних, а поза межами ядра вони нормальні. Крайова дислокація АВ простягається на багато тисяч міжатомних відстаней. Пересування дислокації під дією сили може відбуватись доти, поки вона не вийде на поверхню кристалу, де утвориться сходинка (рис.3,в). Якщо екстраплощина є у верхній частині кристалу, то дислокація умовно вважається позитивною і позначається знаком _^_, а якщо екстраплощина лежить у нижній його частині, то — негативною і позначається Т.

Рис.3. Крайова дислокація АВ, яка виникає внаслідок зсуву:
F – прикладена сила
Дислокації можуть взаємодіяти як між собою, так і з іншими дефектами.
Оскільки над дислокацією існує локальна зона пружних деформацій стиснення,
то сусідні дислокації з однаковим знаком взаємно відштовхуються, а з протилежним знаком — взаємно притягаються. При цьому дислокації з різними
знаками, рухаючись на зустріч в одній площині ковзання, можуть взаємно
знищуватись (анігілювати), утворюючи з двох півплощин одну повну площину.

а б
Рис.4. Схема визначення вектора Бюргерса:
а – реальний кристал;
б – ідеальний кристал; в – вектор Бюргерса
В зону розсунутих атомів стікаються атоми домішок і розташовуються
вздовж краю екстраплощини. Таке скупчення домішкових атомів називається атмосферою Коттрелла. З підвищенням температури концентрація домішкових атомів біля дислокацій зменшується, а зі зниженням температури— зростає.
Спотворення кристалу в ядрі дислокації оцінюють вектором Бюргерса. Для знаходження вектора Бюргерса розглянемо два кристали: один — недосконалий із крайовою дислокацією (рис.4,а) і другий досконалий без дислокації (рис.4,6).Навколо крайової дислокації за межами спотвореного ядра, тобто в тих вузлах, де спотворень практично немає, проведемо від вузла А контур у вигляді вертикальних і горизонтальних відрізків АВ, ВС, СD і DА, що з'єднують сусідні вузли ґратки. Він замкнеться на відрізку ВА, який складається не з шести, а з п'яти міжатомних відстаней. Якщо такий самий помістить в собі шість міжатомних відстаней. Різниця довжин відрізка D'А' контуру в досконалому кристалі і відрізка DА контуру в кристалі з крайовою дислокацією називається вектором Бюргерcа й позначається буквою  . Вектор Бюргерcа дорівнює одній міжатомній відстані й у випадку крайової дислокації перпендикулярний до лінії дислокації АВ.
. Вектор Бюргерcа дорівнює одній міжатомній відстані й у випадку крайової дислокації перпендикулярний до лінії дислокації АВ.
Кількісною характеристикою дислокаційної структури є густина дислокацій ρ, яка дорівнює відношенню сумарної довжини дислокацій Σl до об'єму кристалу v:


Густина дислокацій помітно впливає на механічні властивості: з її збільшенням зростає міцність і знижується пластичність металів. Дислокації виникають під час кристалізації, пластичної деформації, фазових перетворень. Швидкість дифузії вздовж дислокацій значно вища, ніж в кристалах без дислокацій.

Рис.5. Схема гвинтової дислокації АВ:
F – прикладена сила
Гвинтова дислокація є лінією АВ (рис.5), що нею обмежена площина Q, в якій відбувся зсув сусідніх частин кристалу на одну міжатомну відстань в напрямку дії сил F. При цьому паралельні атомні площини в безпосередній близькості від лінії дислокації АВ трансформуються у гвинтову поверхню. В ядрі дислокації атоми зсунуті з положень рівноваги. Гвинтові дислокації, на відміну від лінійних, не притягують вакансій і міжвузлових атомів. Гвинтова дислокація вважається правою, якщо хід її гвинтової поверхні такий, яку правої різі, і лівою, якщо хід— яку лівої різі. Теорія дислокацій вперше була застосована в 30-х роках 20-го століття для пояснення процесу пластичної деформації в кристалічних тілах і для врахування величезної невідповідності між теоретичною і практичною міцністю металів.
Поверхневі дефекти малі в одному вимірі й значно більші в двох інших. До цих дефектів належать границі зерен, границі фрагментів і блоків. Конструкційні метали та їх стопи мають полікристалічну будову: вони складаються із безлічі дрібних кристаликів — зерен (риc.6). Сусідні зерна мають неоднакову орієнтацію кристалічних ґраток (рис.6,а). Між зернами існують вузькі перехідні зони шириною до декількох атомних діаметрів — границі зерен із нерегулярним розташуванням атомів (риа.6,б). На границях концентруються дислокації і домішки. Зерно не є кристалом ідеальної будови. Воно складається з фрагментів, а фрагменти — з блоків. Ґратки сусідніх фрагментів розорієнтовані на кут до кількох градусів, а ґратки сусідніх блоків — на кут менший за один градус. На границях фрагментів і блоків концентруються дислокації. Якщо розорієнтація сусідніх зерен становить декілька десятків градусів, то такі границі називають великокутовими, а при розорієнтації до 5° маємо малокутові границі. Малокутові границі властиві фрагментам і блокам; вони утворюються під час холодної деформації, рекристалізації й полігонізації.

Рис.6. Схема що ілюструє різну орієнтацію кристалічних граток зерен (а) і границі зерен (б):
о – атоми, розташовані всередині зерен і • - атоми на границях зерен
По границях зерен порівняно легко здійснюється дифузія. Границі зерен мають помітний вплив на механічні властивості металів. Що дрібніші зерна, то вища пластичність і міцність металів.

Рис.7. Міжблокова границя, утворена крайовими дислокаціями:
а – відстань між сусідніми атомами;
d – відстань між дислокаціями;
a – кут розорієнтування сусідніх блоків
До об’ємних дефектів можна зачислити локальні нагромадження точкових дефектів – вакансій, а також газові порожнини й неметалеві включення.
1.4 Методи дослідження структури металів.
Найбільш поширеними засобами дослідження кристалічної структури металів, залізовуглецевих сплавів та ін. є макро- та мікроаналіз.
Макроаналіз полягає в дослідженні будови металів та сплавів неозброєним оком або при незначному збільшенні /до ЗО разів/. Таке збільшення дозволяє вивчати великі перетини металів, робити висновки про їх будову та наявність певних дефектів, а також вибирати ділянки для подальших досліджень. Будова металів та сплавів, що визначена таким чином, називається макроструктурою.
За допомогою макроаналізу можна визначити:
- порушення суцільності металу /усадочна пухкість, центральна пористість, підкоркові пухирі, свищі/:
- будову литого та деформованого металів;
- хімічну неоднорідність /ліквацію/;
- вид зламу.
Макроаналіз литого металу. Травлення макрошліфа проводять в 15%-му водному розчині персульфату амонію при температурі 80-90°С на протязі 5-10 хвилин. Для литого металу характерні велика неоднорідність зерен за формою та розміром, наявність несуцільностей, неоднорідність хімічного складу. Ці особливості будови литого металу, які погіршують його властивості і тому належать до недоліків, обумовлені процесом кристалізації. Макроаналіз стального зливка показав, що в його структурі можна виділити три зони:
- дрібних дезорієнтованих кристалів:
- орієнтованих стовпчастих кристалів;
- великих дезорієнтованих рівновісних кристалів.
Мікроскопічний аналіз (мікроаналіз) полягає у вивченні мікроструктури металів за допомогою оптичного мікроскопа. Мікроструктурою називають внутрішню будову металу, яку спостерігають при збільшенні від 50 до 2000 разів. За допомогою мікроаналізу є можливість вивчати форми та розміри окремих зерен і фаз, з яких складається метал, виявляти, які зміни внутрішньої будови відбуваються під впливом різних факторів при термічній або хіміко-термічній обробці, а також виявляти розташовані в металі включення та мікродефекти.
Електронномікроскопичне дослідження металів створюється за допомогою швидкого потоку електронів при збільшенні від 30000 разів.
Рентгеноструктурний аналіз дозволяє визначити розташування атомів у кристалів і відстані між ними з використанням рентгенівських променів.
Питання для самоперевірки:
1. Чим відрізняється макроструктура від мікростроструктури і субструктури?
2. Чому дорівнює координаційне число для комірок ОЦК, ГЦК, і ГПУ?
3. Яка мета вивчення матеріалознавства?
4. Вкажіть типи зв’язку атомів .
5. Які площини ковзання в ОЦК та ГЦК комірках?
6. Вкажіть різні атомні площини ковзання в ОЦК комірці.
7. Вкажіть різні атомні площини ковзання в ГКЦ комірці.
8. Яку будову мають малокутові та великокутові кордони?
9. Перелічити точкові дефекти.
10. Вкажіть вплив вакансії на властивості металів
11. Перелічити лінійні дефекти
12. Чим відрізняється лінійна дислокація від гвинтової? Що характеризує вектор Бюргерса?
13. Вкажіть вплив дислокації на властивості металів
14. Що таке густина дислокацій ρ ?
15. Що характеризує вектор Бюргера?
16. Перелічити поверхневі дефекти
17. Яку будову мають мало кутові та велико кутові кордони?
18. Які існують методи для зміцнювання металів.
Лекція№2
Тема: Процес кристалізації металів. Ліквація
2.1 Енергетичні умови процесу кристалізації.
2.2 Криві Тамана.
2.3 Ліквація.
2.1 Енергетичні умови процесу кристалізації.
Неоднорідність будови литого металу обумовлена змінами умов кристалізації на протязі часу кристалізації. Відомо, що процес кристалізації можливий при певному переохолодженні рідкого металу, яке характеризується ступенем переохолодження ΔТ, і який в свою чергу дорівнює різниці температур кристалізації теоретичної Тs та фактичної Ткр: DT=TS-Tкр

рис. 1 Зміна вільної енергії G за температурою t.
2.2 Криві Тамана.
Процес кристалізації складається з двох стадій утворення центрів кристалізації твердої фази /зародки твердої фази/ та ріст кристалів твердої фази. Довільне виникнення центрів кристалізації твердої фази називають гомогенним. При цьому збільшення до певної міри переохолодження призводить до виникнення більшого числа центрів кристалізації /ч. ц. / та підвищення швидкості їх росту /ш. р./, що обумовлює зменшення розміру зерен (рис. 2).

Рис. 2. Залежність швидкості зародження та росту кристалів від ступеня переохолодження ΔТ
При кристалізації зливка найбільший ступінь переохолодження спостерігається безпосередньо на кордоні між рідким металом та холодними стінками виливниці /форма, в яку заливають метал/. На протязі кристалізації ступінь переохолодження на кордоні розділу рідина – тверда фаза зменшується за рахунок прогріву стінок виливниці та утворення зони твердого металу. Це призводить до зменшення кількості зародків твердої фази та швидкості їх росту. Наявність направленого відведення тепла стимулює формування зони стовпчастих кристалів, які ростуть перпендикулярно до стінок виливниці. У центральній частині зливка направлене відведення тепла відсутнє, що сприяє утворенню неорієнтованих кристалів. Вони досить великі, так як ступінь переохолодження в цій зоні незначний.
На процес кристалізації впливають також домішки, які знаходяться в рідкому металі у зваженому стані. Якщо частинки домішок мають однакову / або подібну / кристалічну решітку до решітки металу, що затвердіває, то вони можуть бути готовими центрами кристалізації. У цьому випадку спостерігається зменшення розміру критичних зародків, а кристалізація рідини починається при меншому переохолодженні. Таке утворення зародків твердої фази називається гетерогенним. Використання таких домішок /вони отримали назву модифікатори/ веде до підвищення якості металу, а операція їх введення в рідкий метал отримала назву модифікування. Другим недоліком литого металу є його несуцільність. Утворення несуцільностей обумовлено тим, що метал в твердому стані займає менший об'єм, ніж у рідкому. Усадка розподіляється або у вигляді раковини, яка зосереджується в верхній частині зливка, або у вигляді дрібних раковин, що розподіляються по всьому зливку. Розміри та форма усадочних раковин залежать від маси металу, форми виливниці, швидкості кристалізації. Серед всіх несуцільностей найбільший вплив на структуру та властивості металів має раковина в верхній частині зливка, поверхня якої вкрита шаром оксидів, до того ж у цій частині зливка сконцентрована найбільша кількість шкідливих домішок та пустот. Цю частину зливка відрізають.
2.3 Ліквація.
Третім недоліком зливка є його хімічна неоднорідність /ліквація/. Ділянки твердої фази, що виникають на початку кристалізації, будуть багатими на тугоплавкі компоненти. Периферійні ділянки дендрита /кристал, що за своєю формою нагадує дерево/ та міждендритний простір містять підвищену кількість легкоплавких елементів. Розрізняють дві групи ліквацій: макроскопічну, яку можна виявити неозброєним оком, та мікроскопічну, яку виявляють за допомогою спеціальних методів аналізу /металографічного, мікрорентгеноспектрального та ін./ До макроскопічних ліквацій відносять: нормальну зональну, зворотну зональну та ліквацію по густині. Для нормальної зональної ліквації характерна неоднорідність зливка по зонах. Найбільше вона проявляється в центральній частині зливка. При зворотній зональній ліквації ділянки з підвищеною концентрацією домішок розташовані на зовнішній поверхні. Ліквація по густині обумовлена різною питомою вагою твердих фаз. До мікроскопічних ліквацій відносять дендритну та внутрішньо-кристалічну ліквації. Перші ділянки дендрита багаті на тугоплавкі компоненти, а залишки рідини, багаті на легкоплавкі домішки, твердіють останніми і таким чином нашаровуються на дендрит. Ліквації спричиняють до утворення різних дефектів в литих металах та сплавах, ускладнюють їх обробку та знижують властивості.
Питання для самоперевірки:
1. Яка умова потрібна для протікання процесу кристалізації?
2. Чим відрізняється гомогенне утворення зародку від гетерогенного?
3. Як отримати дрібне зерно у литому металі?
4. Чи може відбуватися ріст кристалів без утворення двомірного зародку?
5. Коли процес кристалізації протикає швидше – при невеликій, великій і дуже великій ступені переохолодження?
6. Що таке поліморфне утворення і які необхідні умови для його протікання?
7. Перелічити стадії кристалізації.
8. Перелічити два механізми зародження кристалів.
9. Які дефекти сприяють процесу кристалізації?
10. Чим відрізняються дендритна ліквація та ліквація за щільністю? Як усунути ці види ліквації?
Лекція № 3
Тема: Діаграми стану подвійних стопів.
3.1 Поняття про діаграми стану.
3.2 Правило фаз Гібса.
3.3 Розгляд усіх типів діаграм.
3.4 Правила Курнакова.
3.1 Поняття про діаграми стану.
Діаграма стану є графічним зображенням рівноважного стану металевої системи в залежності від концентрації сплавів та температури. Для конденсованих систем, в яких газові фази відсутні, тиск вважається постійним, що дорівнює 1 атм. Діаграми стану подвійних систем будують на площині в координатах "концентрація температура". Конкретний вигляд діаграми визначається характером взаємодії її компонентів (утворення рідких і твердих розчинів, хімічних сполук та проміжних фаз), а також поліморфізмом компонентів та їх сполук. Спочатку розглянемо системи, компоненти яких мають необмежену взаємну розчинність у рідкому стані. Однією з найпростіших є діаграма стану системи, компоненти якої утворюють неперервний ряд рідких і твердих розчинів (рис. 4, а). Вона складається лише з двох ліній ліквідусу СLВ (початку кристалізації) та солідусу СМВ (кінця кристалізації). Обидві лінії перетинаються в точках С і В кристалізації чистих компонентів і ділять увесь простір діаграми на 3 області: однофазні рідкого (вище ліквідусу) і -твердого (нижче лінії солідусу) розчинів і двофазну між ними. Будь-який сплав цієї системи кристалізується у певному інтервалі температур.
3.2 Правило фаз Гібса.
Нонваріантні перетворення, при яких склади фаз і температура залишаються постійними, оскільки число ступенів системи за правилом фаз Гібса дорівнює нулю, тут неможливі.
С = К - Ф + 1
Як що Ф=3, С=2-3+1=0; Ф=2, С=2-2+1=1; Ф=1, С=2-1+1=2
3.3 Розгляд усіх типів діаграм.
Для певної кількості подвійних металевих систем взаємна розчинність компонентів у твердому стані настільки мала, що нею можна знехтувати. У цьому випадку діаграма стану має вигляд як на рис. 4,б. Тут лінія ліквідусу складається з двох ділянок СЕ та ЕD, кожна з яких показує граничну насиченість рідкого розчину відповідним компонентом і визначає, отже, початок його кристалізації. Рідина ж складу їх спільної точки Е граничне насичена обома компонентами відразу, внаслідок чого вони кристалізуються водночас і сумісно:
РЕ → (А + В)
Таке перетворення називається евтектичним, воно відбувається у нонваріантних умовах (с=0). Суміш кристалів двох твердих фаз, що утворюється при цьому, називається евтектикою.
Евтектична точка Е ділить усі сплави цієї системи на три групи. Першу з них становлять доевтектичні сплави, розташовані на діаграмі ліворуч від точки Е. Їхня кристалізація починається з утворення первинних кристалів компонента А. Склад рідини при цьому змінюється уздовж лінії ліквідусу СЕ до точки Е, після чого в усіх доевтектичних сплавах відбувається евтектичне перетворення рідини, що залишилася. Отже, остаточна структура їх складається з кристалів компонента А та ділянок евтектики (А+В).
Друга група представлена єдиним евтектичним сплавом, в якому уся рідина у точці Е кристалізується з утворенням евтектики (А+В). Нарешті, заевтектичними називаються сплави, розташовані праворуч від точки Е. На першому етапі їх кристалізації утворюються первинні кристали компонента В (область DEG діаграми), на другому знов-таки та сама евтектика (А+В).
Необмежена взаємна розчинність компонентів у твердому стані, а також її повна відсутність зустрічаються порівняно рідко. У переважної більшості подвійних систем компоненти розчиняються один в одному обмежено. У цьому випадку діаграма стану може мати вигляд, показаний на рис. 2,в. Порівняння його з попереднім (рис. 2,б) показує, що ліквідус при переході від системи з відсутністю розчинності компонентів у твердому стані до системи з обмеженою їх розчинністю не змінюється.

Рис. 2. Діаграми стану подвійних систем
Оскільки на базі компонентів утворюються тверді розчини ( та – фази відповідно) зі своїми областями гомогенності, кількість однофазних областей діаграми зростає до трьох. Це призводить до ускладнення лінії солідусу, яка тепер складається з трьох ділянок: похилих кривих СF і DG кінця кристалізації (a - та β-фаз і горизонтальної прямої FЕG, де утворюється евтектика:
РЕ → (aF + bG)
Області гомогенності твердих розчинів обмежені лініями сольвусу FН та GІ. Звичайно взаємна розчинність компонентів у твердому стані зменшується зі зниженням температури, як це і показано на рис. 2,в. Тому нижче цих ліній (a - і β- твердих розчинів, що стали пересиченими, виділяються вторинні кристали іншої фази. Отже, остаточними структурами сплавів цієї системи будуть:
- в інтервалі концентрацій А-Н кристали a-фази;
- в інтервалі Н-F первинні кристали a-фази та вторинні - β-твердого розчину у вигляді тонких прошарків по межах перших;
- в інтервалі F-Е (доевтектичні сплави) первинні кристали a і евтектика;
- для евтектичного сплаву Е евтектика (a + β );
- в інтервалі Е-G (заевтектичні сплави) первинні кристали β i евтектика;
- в інтервалі концентрацій G-І первинні кристали β - та прошарки
вторинних кристалів a - фази;
- в інтервалі І-В кристали β - твердого розчину.
Крім евтектичного, в системах з обмеженою взаємною розчинністю компонентів у твердому стані може відбуватися інше нонваріантне перетворення перитектичне. У цьому випадку рідкий розчин і кристали, які до цього утворилися з нього, взаємодіють між собою з утворенням нової твердої фази (рис.4,г). Тут ліквідусом є лінія СРD, солідусом СКМD, лініями сольвусу КL і МН. Система має, як і у попередньому випадку, 3 однофазні області гомогенності рідкого, a- та β –твердих розчинів. На лінії КМР відбувається перитектичне перетворення, але структурної складової перитектика не існує.
Рр + aК → bm
Остаточна структура сплавів цієї системи:
- в інтервалі концентрацій А-L кристали a - фази;
- в інтервалі L-К до них додаються прошарки вторинних кристалів β - твердого розчину;
- в інтервалі К-М зерна a - фази, що утворилися з рідини і вціліли при перитектичному перетворенні;
- в інтервалі М-N кристали β - твердого розчину з прошарками лінії FLG і називається синтектичним перетворенням, в результаті чого утворюється нестійка хімічна сполука:
PF + PG → x.c.L
В обох системах відбуваються також евтектичні перетворення (лінії FEG на рис. 2, е та DE1N i ME2I на рис. 2, ж).
При наявності обмеженої розчинності компонентів у рідкому стані в системі може відбуватися ще одне нонваріантне перетворення монотектичне, коли з обмеженого рідкого розчину певної концентрації утворюються, інший рідкий розчин та тверда фаза (лінія DFH діаграми, зображеної на рис. 2,з):
PF → PD + B
На цьому рисунку, як і раніше, зображена система з відсутністю взаємної розчинності компонентів у твердому стані. У ній відбувається також евтектичне перетворення (лінія LЕN діаграми).
Дуже рідко, але все ж зустрічаються подвійні системи, компоненти яких зовсім не розчиняються один в одному у рідкому стані. Оскільки у цьому випадку обов'язково відсутня і взаємна розчинність компонентів у твердому стані, діаграма має найпростіший вигляд (рис. 2, й) і складається з двох горизонтальних ліній. Вище верхньої з них ліквідусу СD існують два рідких компоненти РА та РВ у вигляді емульсії. Якщо на вказаній лінії відбувається кристалізація, наприклад, компонента А, нижче неї співіснують його кристали та рідкий компонент В. Останній закристалізується на нижній лінії діаграми FG. Отже, нижче цієї лінії структура будь-якого сплаву складається з кристалів обох компонентів.
Якщо у компонентах системи відбуваються поліморфні перетворення, діаграма стану суттєво ускладнюється. Важливе значення тепер має взаємодія поліморфних модифікацій компонентів між собою, що призводить до збільшення числа можливих варіантів діаграм. Характер же цієї взаємодії значною мірою визначається ізоморфністю решіток однією з умов утворення необмежених твердих розчинів. Так, якщо високотемпературні модифікації компонентів Аβ та Вβ ізоморфні одна одній, вони утворюють необмежений твердий розчин / (рис.2,і) як неізоморфні низькотемпературні модифікації Аa та Вa дають лише обмежені тверді розчини d і e на основі кожної з них. На діаграмі такої системи слід звернути увагу на такі її елементи, які раніше не зустрічалися. Перш за все, це точки поліморфних перетворень у компоненті А (точка К діаграми) та у компоненті В (точка L). Парні лінії, що виходять з цих точок КЕ і КМ та LЕ і вторинної - фази; в інтервалі N-В однофазна структура β - твердого розчину.
Аналогом перитектичного є так зване перитектоідне перетворення, у якому беруть участь лише тверді фази. Наприклад, у системі, показаній на рис.2,д, воно відбувається на лінії НІК за схемою:
aH + bK → gI
Отже, два твердих розчини - a та b - у взаємодії між собою утворюють нову тверду фазу проміжного складу g, яка є твердим розчином на основі хімічної сполуки. Інші лінії й області цієї діаграми додаткових коментарів не потребують.
У металевих системах часто утворюють хімічні сполуки та проміжні фази. Якщо при цьому склади рідкого розчину та хімічної сполуки збігаються, вона називається стійкою, або сполукою з конгруентним плавленням. На діаграмі стану (рис. 2, е) їй відповідає відкритий максимум точка дистектики D. Сама хімічна сполука виступає у ролі додаткового, третього компонента системи, що дозволяє поділити систему А - В на дві підсистеми і кожну з них аналізувати окремо, незалежно від іншої. Якщо при цьому тверді розчини не утворюються ні на основі компонентів, ні на базі хімічної сполуки, діаграма виглядає саме так, як на рис. 2,е. У кожній підсистемі є власна евтектика, до складу якої входять кристали одного з компонентів та хімічної сполуки: (А + х. с. ), (х. с. + В).
Якщо при утворенні хімічної сполуки її склад не збігається зі складом рідкого розчину, вона називається нестійкою, або сполукою з інконгруентним плавленням. Такі сполуки утворюються в результаті нонваріантних перетворень уже розглянутого вище перитектичного (рис. 2,є) або так званого синтектичного (рис. 2, ж). В обох випадках точка дистектики відсутня, а максимум на лінії ліквідусу не відкритий, а захований. Відсутня і розчинність у твердому стані.
Не зупиняючись на докладному аналізі системи з перитектикою (рис. 2,є), розглянемо ту, де нестійка хімічна сполука утворюється при синтектичному перетворенні (рис. 2, ж). Передумовою цього є обмежена взаємна розчинність компонентів у рідкому стані, яка призводить до розшарування однорідного рідкого розчину на два по лінії FKG так званій бінодалі. При цьому розчин Рх збагачений компонентом А, а інший Ру компонентом В. Саме їх взаємодія на LN - є лініями початку та кінця поліморфних перетворень у компонентах і називаються лініями трансусу. Нарешті, на лінії МЕN відбувається ще одне перетворення, яке раніш не зустрічалося. Це перетворення аналогічне евтектичному, але вихідною фазою є g -твердий розчин, з якого утворюється суміш двох інших твердих фаз d - e та :
gE → (dM + eN)
Таке перетворення називається евтектоїдним. Реальні діаграми стану подвійних систем, як правило, більш складні і є комбінаціями декількох розглянутих діаграм.
3.4 Правила Курнакова.
У залежності від складу та температури сплави можуть мати різні структури та властивості, тобто існує певний зв'язок між структурою та діаграмою стану.

Рис. 3. Кристали твердого Рис. 4 Однофазні області твердих
розчину розчинів
1. У системі із необмеженою розчинністю компонентів у твердому
стані в процесі кристалізації утворюється тільки одна фаза
необмежений твердий розчин заміщення. Кінцева структура кожного сплаву
такої системи у рівноважному стані являє собою кристали a- твердого
розчину (рис. 3), які мають поліедричну або дендритну форму.
Таку ж мікроструктуру мають сплави системи з обмеженою розчинністю компонентів у твердому стані, які знаходяться в однофазних областях твердих розчинів (рис. б), а також, чисті метали, хімічні з'єднання проміжні фази. Мікро структурно всі ці фази одна від одної майже не відрізняються.
2. Сплави, які утворюються в результаті кристалізації евтектики або евтектоїда, являють собою, як правило, дисперсну суміш двох фаз у вигляді пластин, сот або дрібних зерен. Ця обставина дозволяє легко відрізнити більш великі первинні кристали даної фази від евтектичної складової.
Як приклад розглядається формування сплаву з евтектикою, охолодженні рідини вище точки 1 (рис. 5) фазові перетворення в сплаві відсутні. В інтервалі температур 1-2 із рідини виділяються кристали /первинні/ чистого компонента А. Рідина, яка залишилась, має склад точки С та кристалізується із одночасним виділенням суміші кристалів А та В: Рс (А + В). Кінцева мікроструктура доевтектичного сплаву наведена на рис. 5. Принципової різниці у формуванні структур доевтектичних та заевтектичних сплавів нема. Але первинні кристали компонентів можуть мати різну форму, а під час травлення отримати різне забарвлення.
3. При формуванні сплавів у системі з обмеженою розчинністю компонентів у твердому стані можливе виділення кристалів іншої фази із пересиченого твердого розчину. Такі кристали отримали назву вторинних, а процес їх утворення - вторинної кристалізації. Приклади утворення вторинних фаз наведені на рис. 6. Надлишкова фаза може виділитись по границях зерен /виділення вторинного цементиту із аустеніту/. М. С. Курнаков встановив залежності між видом діаграми стану та властивостями сплавів, відомі як правила Курнакова /рис. 7/.
1. Якщо при сплавленні компонентів утворюється суміш двох фаз, властивості сплавів із зміною складу змінюються по лінійній закономірності, тобто аддитивно (рис. 7, а).
 |
Рис. 5. Мікроструктура Рис. 6 Утворення вторинних
доевтектичного сплаву фаз
 |
Рис. 7. Схема залежності між діаграмою стану та властивостями сплавів
2. Якщо компоненти при сплавленні утворюють необмежені тверді розчини, то властивості змінюються по параболічній закономірності із максимумом або мінімумом (рис. 7,б), яка відповідає приблизно еквіатомному складу, тобто 50% А + 50% В.
3. Якщо при сплавленні компонентів утворюються обмежені тверді розчин, то у тих частинах діаграми, де розташовані однофазні області твердих розчинів, властивості змінюються по закономірності ціпової лінії. У двофазних областях, де є евтектика, властивості змінюються аддитивно (рис. 7,в).
4. Якщо компоненти утворюють стійке хімічне з'єднання /або проміжну фазу/, то йому відповідає точка перегину на кривій зміни властивостей. Ця точка максимуму або мінімуму, яка відповідає складу хімічного з'єднання, називається сингулярною (рис. 7,г).
За діаграмами стану можна також визначити технологічні властивості сплавів. Чим більша відстань між лініями ліквідуса та солідуса, тобто чим більше інтервал кристалізації, тим більша схильність сплаву до ліквації та розсіяна пористість, а також схильність до утворення тріщин у відливках. Кращі ливарні властивості мають евтектичні сплави. Ці сплави мають кращу оброблюваність різанням та дають найбільшу чистоту поверхні. Однофазні сплави (тверді розчини) краще деформуються у гарячому та холодному станах.
Питання для самоперевірки:
1. Що таке твердий розчин?
2. Які умови існують для повної взаємної розчинності двох компонентів?
3. Що таке матрична структура?
4. Які види твердих розчинів Вам знайомі?
5. Що таке евтектоїд? Опишіть процес кристалізації евтектоїда?
6. Що таке евтектика? Опишіть процес кристалізації евтектики.
7. Визначити число фаз, їх склад і кількість при різних температурах між лініями ліквідус і солідус у двохкомпонентній системі з повною взаємною розчинністю в рідкому і твердому стані.
8. Що таке конода?
9. Чим відрізняються дендритна ліквація та ліквація за щільністю? Як усунути ці види ліквації?
10. Намалюйте схему структури твердого розчину і гетерогенну (матричну) структуру сплавів.
Лекція №4
Тема: Діаграма стану системи залізо-вуглець.
4.1 Компоненти діаграми стану системи залізо-вуглець.
4.2 Фази діаграми стану системи залізо-вуглець.
4.1 Компоненти діаграми стану системи залізо-вуглець.
При аналізі залізовуглецевих сплавів користуються двома діаграмами стану (рис. 1): метастабільною, що характеризує перетворення в системі залізо-цементит (суцільні лінії) та стабільною, яка характеризує перетворення в системі залізо-графіт (пунктирні лінії). Система залізо-графіт більш стабільна, ніж система залізо-цементит, тому що при нагріванні до високих температур цементит може розкластися на залізо та графіт, тобто переходить в більш стабільний стан. Ці діаграми є неповними (до 6,67%С). Це пояснюється тим, що на практиці використовуються сплави заліза з вуглецем (сталі та чавуни) із вмістом вуглецю до 5. . . 6 %.
Залізо, на основі якого формуються сплави, є поліморфним металом. В інтервалах температур від 1539°С (температура кристалізації заліза (т. А)) до 1392°С (т. N і нижче 911°С (т. G) існує a - Fe з ОЦК решіткою. В інтервалі температур від І392°С (т. N) до 911°С (т. G існує g - Fe з ГЦК решіткою.
4.2 Фази діаграми стану системи залізо-вуглець.
Вуглець може розчиняється в обох модифікаціях заліза. Твердий розчин вуглецю в a - Fe називається феритом (Ф). Максимальна розчинність (максимальний вміст вуглецю у високотемпературній модифікації d - Fe дорівнює 0,1%С (т. Н), а в низькотемпературній 0,02%С (т. Р). Твердий розчин вуглецю в g - Fe має назву аустеніт (А). Максимально можливий вміст вуглецю в аустеніті склалась 2,14% (т. Е). Залізо з вуглецем можуть утворювати хімічну сполуку карбід заліза Fe3С, що має назву цементит (Ц). Цементит вміщує 6,67%С, має складну орторомбічну гратку і на діаграмі йому відповідав вертикальна лінія DFKL. У рідкому стані залізо та вуглець утворюють необмежений рідкий розчин, область існування якого на діаграмі розташована вище лінії ліквідусу АВСD (АВС'D'). Лінія AHIECF (АНІЕ'С'F') - лінія солідусу, нижче якої всі сплави знаходяться в твердому стані.
У залізовуглецевих сплавах в залежності від їх складу та температури мають місце трифазні перетворення. Так, при температурі 1499°С (лінія НІВ) відбувається перитектичне перетворення, тобто рідина складу т. В взаємодіє з кристалами фериту складу т. Н з утворенням аустеніту складу т. І:
РВ + ФН → АI
При температурі 1147 °С (лінія ЕСF) має місце евтектичне перетворення, коли рідка фаза складу т. С кристалізується з утворенням одночасно двох твердих фаз аустеніту складу т. Е та цементиту:
Рс → Л ( АЕ + Цс)
Ця евтектична суміш аустеніту та цементиту, одержала назву ледебурит (Л). Нижче 727°С ледебурит складається з цементиту та перліту, тому що при температурі 727°С (лінія РSК) має місце евтектоїдне перетворення, коли аустеніт розкладається, утворюючи суміш фериту та цементиту, що зветься перлітом (П):
АS → П (Фр + Цк)
 |
Рис. 1. Діаграма стану залізо-цементит (вуглець).
У процесі первинної кристалізації, нижче лінії СD із рідкої фази, іде виділення цементиту, який називають первинним Ц. Лінії ЕS та РQ лінії сольвусу, тобто лінії граничної розчинності вуглецю в g - та a - Fе відповідно. Тому при температурах нижче цих ліній з аустеніту та фериту йде виділення відповідно вторинного цементиту ЦІІ та третинного цементиту ЦІІІ. В інтервалі температур між лініями GS та GР відбувається нижнє поліморфне перетворення: аустеніту на ферит (при охолодженні) чи фериту на аустеніт (при нагріванні), що пов'язано з перебудовою кристалічних решіток ГЦК в ОЦК. Подібне перетворення відбувається також в інтервалі температур між лініями NI та NН (верхнє поліморфне перетворення).
Питання для самоперевірки:
1. Чим можна пояснити велику розчинність вуглецю в g– залізі порівняно з a– залізом?
2. Які фази виникають в системі Fe–Fe3C і Fe–C?
3. Побудуйте криві охолодження для доевтектоідної і заевтектоїдної сталі і для доевтектоідного чавуну?
4. Як структурний і фазовий склад сталі і чавуну залежить від вмісту вуглецю і температури?
5. Вказати основні фактори, що впливають на процес графітизації.
6. Як впливає вуглець на конструктивну міцність сталі?
7. Чому сірка, фосфор, кисень і водень належать до шкідливих домішок в сталях.
Лекція №5
Тема:Вуглецеві сталі та чавуни.
5.1 Вплив вуглецю на властивості сталей.
5.2 Сталі конструкційні вуглецеві.
5.3 Сталі інструментальні.
5.4 Типи чавунів.
5.1 Вплив вуглецю на властивості сталей.
Залізовуглецеві сплави, що вмішують до 0, 02%С мають назву нічне залізо. Якщо вміст вуглецю складає від 0,02%С до 2,14%С, то такі сплави називаються сталями. Сплави, які мають вміст вуглецю вище 2,14%С звуться чавунами.
Технічне залізо, що вмішує менш, ніж 0,02%С, при кімнатній температурі буде мати структуру фериту. При збільшенні вмісту вуглецю до 0,02% в межах зерен з'являються прошарки третинного цементиту. Його поява знижує пластичність заліза. Цементит, як і ферит, після травлення розчином азотної кислоти у спирті залишається світлим, протравлюються тільки межі зерен. Для посилення контрасту між цементитом та феритом мікрошліф протравлюють пікратом натрію, який надає цементиту темного кольору. В залежності від вмісту вуглецю сталі поділяють на:
1)доевтектоїдні, що вміщують до 0,8%С. Структура цих сталей:
світлі зерна фериту та темні перліту. При великому збільшенні перліт
виглядає під мікроскопом як набір світлих пластин фериту та цементиту,
які чергуються і мають темні межі між собою, При невеликому збільшенні
(в 100-200 разів) межі таких пластин зливаються, що надає перліту
темного кольору. Разом із збільшенням вмісту вуглецю кількість перліту
збільшується, а фериту зменшується.
2) евтектоідну сталь, що вміщує 0,8%С. Структура сталі перлітна.
3)заевтоктоїдні сталі, що вмішують більше 0,8%С. Структура цих
сталей темні зерна перліту, на межі між ними світла сітка цементиту.
5.2 Сталі конструкційні вуглецеві.
За призначенням вуглецеві сталі поділяються на дві основні групи: конструкційні та інструментальні. Конструкційні вуглецеві сталі (вміст вуглецю до (0,07 - 0,85%) широко використовують в промисловості. Низьковуглецеві сталі 05, 08, 10 з 0,05 - 0,1%С використовують для штампованих та зварних виробів (баки, котли, кузова, крила автомобілів). Механічні властивості після нормалізації sтим = 340 МПа; s0,2 =200-210 МПа; d= 31-33%. Сталі 15, 20, 25 з 0,15-0,25%С використовують без термічної обробки або в нормалізованому стані для виготовлення цементованих виробів (вали, шестірні, кулачки). Сталі з таким вмістом вуглецю у вигляді кутиків, швелерів та балок застосовують для металоконструкцій (sтим = 380-460 МПа; s0,2 =230-280 МПа; d= 23-27%).
Більшість деталей в машинобудуванні (осі, вали, шестірні, втулки, болти) виготовляють із середньовуглецевих сталей 30, 40, 45, 50 з 0,3-0,55%С (sтим = 500-610 МПа; s0,2 = 300-360 МПа; d= 16-21%).
Конструкційні сталі 60, 65, 70, 80 і 85 з підвищеним вмістом вуглецю до 0,6-0,85%С використовують після гартування і відпуску (sтим = 800 МПа; HRC 40-45) головним чином як пружинно-ресорні.

Рис. 2 Залежність механічних властивостей сталей від вмісту вуглецю
5.3 Сталі інструментальні.
Сталі У7 (У7А), У10 (У10А), У11 (11А), У12 (У12А), що мають 0,7 – 1,3%С використовують для виготовлення різального та штампового інструменту (зубила, різці, свердла, фрези, плашки, пуансони, матриці і т.д.). Вуглецеві інструментальні сталі у відпаленому стані характеризуються невисокою твердістю (НВ 166-192) і доброю оброблюваністю різанням і тиском. Після гартування та низького відпуску твердість становить HRC 60-65, границя міцності при згині s = 250-350 МПа.
5.4 Типи чавунів.
Чавунами називають залізовуглецеві сплави, що містять в собі більше 2,14%С.
Білі чавуни. При підвищених швидкостях охолоджування одержують так звані білі чавуни. У них весь вуглець знаходиться у зв’язанному стані у вигляді хімічної сполуки з залізом – в цементиті, що надає зламам таких чавунів білого кольору. Білі чавуни, фазові перетворення в яких проходять згідно з метастабільною діаграмою Fe – Fe3C, поділяють на доевтектичні, евтектичні та заевтектичні.
Структура доевтектичних білих чавунів, тобто чавунів з вуглецем до 4,3%, складається з великих темних зерен перліту дендритної форми, світлого вторинного цементиту, що оточує ці зерна, та ледебуриту, що має плямисту структуру (темні невеликі зернятка перліту на тлі світлого цементиту).
Евтектичний чавун з 4,3%С має чисто ледебуритну структуру. У заевтектичних білих чавунах, що вмішують до 4,3%С до 6,67%С, окрім ледебуриту в структурі наявні великі світлі голки (пластини) первинного цементиту.
Через велику кількість цементиту білі чавуни дуже тверді та крихкі (НВ 450-550), тому для виготовлення деталей машин вони практично не використовуються. Обмежено застосовуються виливки з чавуну, які на поверхні мають структуру білого чавуну, а в серцевині – сірого з графітом пластинчастої форми. Проте така структура сприятлива для деталей, що працюють в умовах інтенсивного абразивного зношування (прокатні валки, кулі кульових млинів, колеса вагонеток та інш.). Виливки з білого чавуну підлягають відпалу для одержання структури ковкого чавуну. У цьому випадку хімічний склад сплаву, що заливається у форми, наступний: 2,4 – 2,9 %С; 1,0 – 1,6 % Si; 0,3 – 1,0 % Мn. Вміст вуглецю і кремнію підбирають з розрахунку Si + С = 3,8 %. При такому складі сплаву та прискореному охолодженні (для цього товщина стінок виливка не повинна перевищувати 20 мм, в окремих випадках 50 мм) формується структура білого доевтектичного чавуну П + Л (П + Ц) + ЦІІ.
Сірі чавуни. У чавунах весь вуглець або частина його може знаходитись у вільному стані у вигляді графіту. Графіт має темно-сірий колір, тому злам таких чавунів теж матово-сірий. За рахунок графіту чавуни мають знижену твердість, добре обробляються різанням, мають високі антифрикційні властивості як наслідок низького коефіцієнта тертя. Разом з тим включення графіту зменшують міцність та пластичність, тому що при накладанні зовнішніх навантажень вони відіграють роль концентраторів напруг. Структура металічної основи таких чавунів може бути феритна, феритно-перлітна або перлітна. Від структури металічної основи залежить головним чином межа міцності на стискування та твердість чавуну, причому різниця між цими властивостями та властивостями сталі невелика. У залежності від форми графітних включень розрізнюють такі чавуни: сірий чавун з пластинчастою формою графіту; високоміцний чавун з кулястим графітом; ковкі чавуни з графітом у формі пластівців. Структура його, як і білого чавуну, формується під час первинної кристалізації рідкого сплаву, але при більш повільному охолодженні. Перетворення, що при цьому мають місце, відповідають стабільній діаграмі залізо-графіт. Так, при температурах, що відповідають лінії С'D', починається кристалізація графіту. При температурі 1153 °С (лінія Е'С'F') утворюється графітна евтектика (аустеніт + графіт). При зниженні температури до 738°С(у відповідності з лінією S'Е') з аустеніту виділяється вторинний графіт, при 738 С (лінія Р'S'К') утворюється евтектоід, який складається з фериту та графіту. Більшість графіту в сірих чавунах з'являється під час первинної кристалізації із рідкої фази. Евтектичний, евтекіоїдний та вторинний графіти самостійних виділень не утворюють, а нашаровуються на первинний графіт. Окрім повільного охолодження сильною графітизуючою дією виділяється кремній, тому для формування структури сірого чавуну в нього додають до 3. . . 4% кремнію. Корисним в чавунах є фосфор, тому що він утворює легкоплавку фосфідну евтектику з низькою температурою плавлення. Вона суттєво збільшує рідкотекучість, що особливо важливо при виробництві тонкого та фасонного литва. Наявність в структурі чавуну включень фосфідної евтектики підвищує також антифрикційні властивості. Більшу міцність мають чавуни з невеликими за розміром графітними включеннями, якщо вони до того ж мають завихрену форму та ізольовані один від одного. Чавун з великою кількістю прямолінійних великих графітних пластин, гострі кромки яких виступають як активні концентратори напруги, має грубозернистий злам та низькі механічні властивості. Пластичність сірого чавуну практично нульова (d~0,5%). Незважаючи на низькі механічні властивості, сірі чавуни мають цілий ряд позитивних якостей, що і обумовлює їх широке застосування (як ливарні матеріали, які дешеві, добре обробляються різанням, мають високі антифрикційні та антикорозійні властивості, витримують стискальні навантаження, гасять вібрацію та малочутливі до зовнішніх концентраторів напруги (надрізи, виточки тощо). Із сірих чавунів виготовляють станини верстатів, блоки циліндрів, поршневі кільця, сантехнічні вироби, корпуси редукторів та ін.
Приклад маркування: СЧ 25 сірий чавун з межею міцності при розтягуванні приблизно 250 МПа.
 |
Рис. 3. Схема графітизуючого відпалу білого чавуну на ковкий
Високоміцні чавуни. Їх висока міцність пояснюється кульковидною формою графітних включень, які хоч і є концентраторами напруги, але значно менш активними, ніж графітні включення з пластинчастою формою в сірих чавунах. Щоб отримати кульковидний графіт, рідкий чавун перед розливкою модифікують, тобто вводять у нього магній у невеликій кількості (до 0,02% - 0,08%). Але у зв'язку з тим, що модифікування чистим магнієм супроводжується сильним піроефектом, часто замість магнію вводять так звані лігатури (наприклад, сплав магнію та нікелю).
Високоміцні чавуни ефективно замінюють сталь у багатьох виробах та конструкціях. Із них виготовляють колінчасті вали двигунів, поршні, шестірні, прокатні валки, корпуси парових турбін.
Приклад маркування: ВЧ 40 високоміцний чавун з межею міцності при розтягуванні 400 МПа.
Ковкі чавуни. Графітні включення у формі пластівців, що є характерною ознакою ковких чавунів, утворюються під час відпалу білих доевтектичних чавунів. Такий графіт, на відмінність від пластинчастого, менш знижує механічні властивості. Тому ковкий чавун, у порівнянні з сірим, більш міцний та пластичний. Відливки (тобто вироби готової кінцевої форми) з білого чавуну, що відпалюються на ковкий чавун, повинні бути тонкостінними з товщиною стінки не більше 50 мм, інакше всередині виробу за рахунок повільного охолодження буде утворюватися пластинчастий графіт як у сірому чавуні. В останньому випадку такий чавун непридатний до відпалу, так як не забезпечить потрібний рівень механічних властивостей готового виробу. З цієї ж причини первинні білі чавуни повинні мати знижений вміст графітизуючих елементів вуглецю та кремнію. Суть процесу графітизації при відпалі білих чавунів полягає в розпаді цементиту. На І стадії графітизації (вторинний Ц і той, що входить в ледебурит) розпадається на аустеніт та графіт у формі пластівців:
 Fe3C Feg ( C ) + C
Fe3C Feg ( C ) + C
 (Ц А + Г)
(Ц А + Г)
При прискореному охолодженні після першої стадії графітизації аустеніт перетворюється на перліт. Так отримують ковкий чавун на перлітній основі. Для одержання ковкого чавуну на феритній основі проводять II стадію графітизації або при дуже повільному охолодженні в евтектоїдному інтервалі температур, або при тривалій видержці (25-30год. ) Трохи нижче температури евтектоідного перетворення (720 740° С). В результаті цього має місце розпад вторинного цементиту (якщо він встиг утворитися) та цементиту перліту;
 Fe3C Fea ( C ) + C
Fe3C Fea ( C ) + C
 (Ц Ф + Г)
(Ц Ф + Г)
Такий режим термообробки призводить до отримання ковкого чавуну на феритній основі. Якщо II стадію графітизації до кінця не доводити, то можна одержати ковкий чавун на феритно-перлітний основі. Ковкі чавуни знайшли широке застосування. З них виготовляють картери редукторів, крюки, скоби, фланці, елементи карданних валів, гальмівні колодки і таке інше.
Приклад маркування: КЧ 35-10 ковкий чавун, що мав границю міцності при розтягуванні 350 МПа та відносне подовження 10%.
Питання для самоперевірки:
1. Яким вимогам повинна відповідати конструкційна вуглецева сталь?
2. Вкажіть сталі інструментальні для різального інструменту.
3. Вкажіть сталі інструментальні для штампів.
4. Вкажіть деталі машин, які виробляють з конструкційних вуглецевих сталей?
5. Вкажіть деталі машин, які виробляють з інструментальних вуглецевих сталей?
6. Яким вимогам повинна відповідати інструментальна вуглецева сталь?
7. Як маркують вуглецеві сталі?
8. Як впливає вуглець на властивості вуглецевих сталей?
9. Які форми графіта існують в чавунах?
10. Як впливає графіт на механічні властивості чавуна?
11. Для яких деталей рекомендується сірий чавун?
12. Яку структуру буде мати сірий чавун, котрий містить у собі 3,2% С і 1,5 Si?
13. Коли рекомендується застосовувати відбілений чавун?
14. Який чавун рекомендується для виготовлення підшипника ковзання, працюючого в парі з упорядкованим валом?
15. Який чавун рекомендується для відповідальних відливок (станини верстатів, поршнів, циліндрів та ін.)?
16. Як утворюється в чавуні кулястий графіт?
17. Чому чавуни з кулястим графітом називаються високоміцними?
18. Де використовуються високоміцні чавуни з кулястим графітом?
19. Як відрізняються по металевій основі ковкі чавуни?
20. Де використовуються ковкі чавуни?
21. Які чавуни використовують для лиття деталей, працюючих при високих температурах чи у корозійному середовищі?
Лекція № 6
Тема: Класифікація й маркування легованих сталей. Конструкційні та інструментальні леговані сталі.
6.1 Корозійнотривкі та хромонікелеві нержавні сталі.
6.2 Інструментальні леговані сталі.
Леговані сталі — це стопи на основі заліза та вуглецю, у складі яких є легувальні елементи. Легувальними називаються хімічні елементи які спеціально вводять у сталь щоб змінити η структуру та властивості Найчастіше використовують такі легувальні елементи як Сг, Ni, Мо, W, Со, Сu, Тi, Zr, Мb, Аl, а також Μn i Si, якщо масові частки двох останніх перевищують відповідно 0,8 І 0,5 % Легувальні елементи дорожчі від заліза, тому вартість легованих сталей більша, нерідко значно більша за вартість вуглецевих сталей. Поєднуючи легування з термічною обробкою, можна отримати бажану структуру, отже й механічні, технологічні, фізичні або хімічні властивості Як правило, застосування легованих сталей без термообробки економічно не виправдане. До структури легованих сталей входять фази, що утворились внаслідок взаємодії легувальних елементів із залізом і вуглецем. Легувальні елементи можуть перебувати в твердих розчинах фериту або аустеніту, у вигляді карбідів або у вигляді інших фаз.
Карбідотвірні елементив періодичній системі Менделєєва розташовані лівіше заліза. Вони можуть розчинятись у цементиті (Ре,С) або утворювати спеціальні карбіди. Ці елементи також частково розчиняються у фериті або в аустеніті. Що лівіше розташований карбідотвірний елемент, тобто що менше заповнений в його атомі енергетичний піддрівень d, то тривкіший металевий карбід. Карбідотвірні елементи можна розташувати у порядку наростання схильності до утворення карбіду та збільшення тривкості карбідної фази
Fе→Мn→Сr→Мо→W→Νb→V→Ζr→Τi.
Якщо в сталі концентрація Μn, Сг, Мо і W мала, то вони заміщають частину атомів заліза в цементиті. Тоді формула утвореного карбіду, що називається легованим цементитом,має вигляд (Fе, Мn)3С, (Fе, Сr)3С. Кожен елемент характеризується своєю граничною розчинністю у цементиті. Наприклад, марганець може замінити в цементиті всі атоми заліза, хром — до 25 % атомів, молібден — до 3 % атомів. Після перевищення легувальним елементом граничної розчинності в присутності надлишкового вуглецю утворюються спеціальні карбідитипу Сr7С3, ТіС, VС. Всім карбідам властиві висока твердість і висока температура топлення.
У карбідів типу VС, ТiС, ZrС, WС, ТаС, Мо2С, W2С відношення атомних радіусів вуглецю до легувального елемента менше, ніж 0,59. Ці карбіди мають просту кристалічну комірку й звичайно під час нагрівання майже не розчиняються в аустеніті. Легувальні елементи (Νi, Со, Si, Сu та iн), розташовані справа від заліза в періодичній системі Менделєєва, карбідів не утворюють, а лише розчиняються у фериті й аустеніті.
За призначеннямрозрізняють конструкційні, інструментальні (для різальних та вимірних інструментів, ш