Энергетические условия кристаллизации
Вопрос Металлическая связь.
Общность первых четырех свойств металлов обусловлена особым типом межатомной связи, называемой металлической связью.
Металлическая связь – это связь по средствам свободнодвижущихся электронов, возникающая в металле между катионами Ме находящимися в узлах кристаллической решетки и свободно движущимися электронами.
Известно, что атом состоит из положительного ядра и отрицательных частиц – электронов. Внешние (валентные) электроны металлов в отличие от неметаллов слабо связаны с ядром. Поэтому атомы металлов легко теряют валентные электроны, превращаясь в ионы, в освободившиеся электроны образуют так называемый электронный газ.
Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными атомами, а в одинаковой степени принадлежат всем ионам металла. Металл состоит из правильно расположенных в пространстве ионов и легко перемещающихся среди них обобщенных электронов.
Наличие металлической связи и легкоподвижных коллективизированных электронов объясняет характерные свойства металлов.
Благодаря ненаправленному характеру связи при пластической деформации, т. е. при смещении отдельных объемов металла, связь между ионами не нарушается и разрушения не происходит. Ионы как бы плавают в облаке электронного газа, что обусловливает высокую пластичность металлов.
Из рис. 1 видно, что при новом расположении ионов металла характер связи между ними сохраняется прежним.
 |
Наличие электронного газа объясняет высокую электро- и теплопроводность металлов. Под влиянием электрического поля свободные электроны имеют возможность ускоряться, что объясняет высокую электропроводность.
С увеличением температуры усиливаются колебания ионов и снижается электропроводность. Наоборот, при понижении температуры электропроводность растет и в ряде случаев может наблюдаться явление сверхпроводимости.
Высокая теплопроводность металлов объясняется участием свободных электронов, наряду с ионами, в передаче тепла.
Кристаллизация металлов
Энергетические условия кристаллизации
Всякое вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Переход из одного состояния в другое происходит при определенной температуре, называемой температурой плавления или кипения.
В газах отсутствует закономерность в расположении частиц, частицы движутся хаотически, причем газ стремится занять, возможно, больший объем. Твердые кристаллические тела имеют правильное строение, при котором атомы и ионы находятся в узлах кристаллических решеток (так называемый ближний порядок), а отдельные ячейки и блоки определенным образом ориентированы по отношению друг к другу (дальний порядок). В жидкостях определенная ориентировка распространяется не на весь объем, а лишь на небольшое число атомов, образующих сравнительно устойчивые группировки или флуктуации. С понижением температуры устойчивость флуктуации увеличивается и они проявляют способность к росту. Таким образом, для жидкостей характерен только ближний порядок расположения атомов.
По мере увеличения температуры твердого тела растет подвижность атомов в узлах решетки, амплитуда колебаний увеличивается и при достижении определенной температуры, называемой температурой плавления, атомы вырываются из узлов и решетка разрушается с образованием жидкой фазы. Температура плавления – важная константа и входит во все справочники: температура плавления ртути минус 38,9; свинца 327; цинка 419; алюминия 660; меди 1083; железа 1536°С и т.д.
Противоположная картина наблюдается при охлаждении жидкости и ее последующем затвердевании. При охлаждении жидкости, наоборот, подвижность атомов падает и вблизи температуры плавления образуются группировки атомов, в которых атомы упакованы, как в кристаллах. Эти группировки являются центрами кристаллизации или зародышами. При достижении температуры плавления – затвердевания, вновь образуется кристаллическая решетка и металл переходит в твердое состояние.
Переход металлов из жидкого в твердое состояние при определенной температуре называется кристаллизацией. Рассмотрим энергетические условия процесса кристаллизации.
Энергетическое состояние любой системы характеризуется определенным запасом внутренней энергии, которая складывается из энергии движения молекул, атомов, электронов, внутриядерной энергии, энергии упругих искажений кристаллической решетки и других видов энергии.
Свободной энергией является такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Свободная энергия изменяет свою величину при изменении температуры, плавлении, полиморфных превращениях и т. д. F = U – TS, где F – свободная энергия, U – полная внутренняя энергия системы, Т – температура, S – энтропия.
Согласно второму закону термодинамики, всякая система стремится к минимальному значению свободной энергии. Любой самопроизвольно текущий процесс идет только в том случае, если новое состояние более устойчиво, т. е. обладает меньшим запасом свободной энергии.
 |
Процесс кристаллизации подчиняется этому же закону. Металл затвердевает, если меньшей свободной энергией обладает твердое состояние, и плавится в том случае, когда меньшей свободной энергией обладает жидкое состояние.
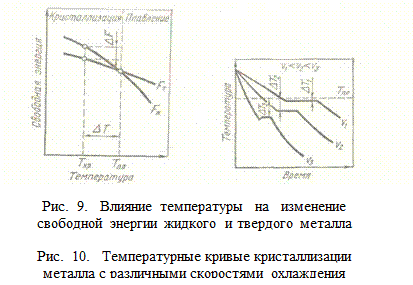
Изменение свободной энергии жидкого и твердого состояния при изменении температуры приведено на рис. 9. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояний вещества.
Различают теоретическую и фактическую температуру кристаллизации. Ts – теоретическая или равновесная температура кристаллизации, при которой Fж = Fтв.При этой температуре равновероятно существование металла как в жидком, так и в твердом состояниях. Реальная же кристаллизация начнется только тогда, когда этот процесс будет термодинамически выгоден системе, при условии ΔF = Fж– Ттв, для чего необходимо некоторое переохлаждение. Температура, при которой практически идет кристаллизация, называется фактической температурой кристаллизации Ткр. Разность между теоретической и фактической температурой кристаллизации называется степенью переохлаждения: ΔT = = Ts – Ткр. Чем больше степень переохлаждения ΔT, тем больше разность свободных энергий ΔF, тем интенсивнее будет идти кристаллизация.
Термические кривые, характеризующие процесс охлаждения с различными скоростями, приведены на рис. 10. При медленном охлаждении, соответствующем кривой иъ степень переохлаждения невелика и кристаллизация протекает при температуре, близкой к равновесной. Горизонтальная площадка на термической кривой объясняется выделением скрытой теплоты кристаллизации, которая компенсирует отвод тепла. С ростом скорости охлаждения (кривые υ2, υ3) степень переохлаждения растет и процесс кристаллизации протекает при все более понижающейся температуре. Помимо скорости охлаждения, степень переохлаждения зависит от чистоты металла. Чем чище металл, тем выше степень переохлаждения.