Гомеополярная (ковалентная) связь
ВВЕДЕНИЕ
Анализ свойств полупроводниковых материалов, технологические процессы полупроводникового производства базируются на основных представлениях и законах кристаллохимии и физической химии.
Кристаллохимия изучает закономерности расположения атомов в кристаллах, природу химической связи между ними, а также зависимость физических и химических свойств кристаллических веществ от их строения. Она основана на обобщении результатов экспериментальных методов исследования атомной структуры кристаллов, на классических и квантовых теориях химической связи, на расчете энергии кристаллических структур с учетом симметрии кристаллов.
Основные задачи кристаллохимии: систематика кристаллических структур и описание наблюдающихся в них типов химической связи; интерпретация кристаллических структур (выяснение причин, определяющих строение того или иного кристаллического вещества) и их предсказание; изучение связи физических и химических свойств кристаллов с их структурой и характером химической связи.
В современной кристаллохимии сформулированы основные категории этой науки: морфотропия, полиморфизм, политипия и изоморфизм. Сущность этих понятий будет рассмотрена ниже.
ЭНЕРГЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА
КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
Виды химической связи
При сближении атомов до расстояния порядка нескольких ангстрем между ними проявляются силы взаимодействия. В зависимости от характера движения электронов в соседних атомах эти силы могут быть силами отталкивания или притяжения. В последнем случае атомы могут соединяться с выделением энергии, образуя устойчивые химические соединения. Электроны внутренних полностью заполненных оболочек прочно связаны с ядром и не участвуют в образовании химических связей. Химические свойства атомов определяются строением внешней, не полностью заполненной электронами оболочки. Электроны, находящиеся во внешней оболочке, называют валентными.
Различают несколько видов химической связи.
Гомеополярная (ковалентная) связь
При этой связи у веществ объединение атомов в молекулу достигается за счет электронов, которые становятся общими для пар атомов. Плотность отрицательно заряженного электронного облака между положительно заряженными ядрами получается наибольшей.
Следует отметить, что перекрытие электронных облаков, приводящее к обобществлению электронов, не сводится к простому наложению друг на друга двух электронных орбит, а сопровождается существенным перераспределением электронной плотности и изменением энергии системы. При обобществлении электронов происходит втягивание электронных облаков в пространство между ядрами. Появление состояния с повышенной плотностью электронного заряда в межъядерном пространстве и приводит к возникновению сил притяжения.
В основе гомеополярной связи лежит обменное взаимодействие или обменный эффект, обусловленный обменом атомов электронами и имеющий чисто квантовую природу. Силы такого взаимодействия называют обменными силами, а их энергия — обменной энергией.
Важнейшей особенностью обменных сил является их сильная зависимость от направления спинов электронов, осуществляющих связь между взаимодействующими атомами. Связь будет сильной только в том случае, если спины антипараллельны. Гомеополярные связи определенным образом ориентированы в пространстве и образуются только между ближайшими соседними атомами.
Молекулы с гомеополярной связью бывают неполярными или полярными (дипольными) в соответствии с симметричным или асимметричным строением. Молекулы, в которых центры положительных и отрицательных зарядов совпадают, называют неполярными. Если же в молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называют полярными или дипольными.
Гомеополярная связь типична для органических молекул. Вместе с тем она может наблюдаться и у твердых веществ неорганического происхождения, если их кристаллические решетки состоят из атомов. Примерами подобных веществ являются алмаз, кремний, германий, карбид кремния (SiC) и др
Ковалентная связь характеризуется высокой прочностью. Подтверждением этому является высокая твердость и высокая температура плавления таких веществ как алмаз, карбид кремния.
1.1.2. Гетерополярная (ионная) связь
Ионная связь возникает вследствие перехода валентных электронов от металлического атома к металлоидному и электростатического притяжения разноименно заряженных ионов друг к другу. Этот вид химической связи реализуется в ионных кристаллах. Типичным примером ионных кристаллов являются галоидные соли щелочных металлов (NaCl, CsI, и др.). В ионном кристалле разноименно заряженные ионы чередуются в узлах решетки. Каждый ион испытывает сильное взаимодействие со стороны соседей.
Металлическая связь
Металлическая связь существует в системах, построенных из положительных атомных остовов, находящихся в среде свободных коллективизированных электронов (рис. 1.1 а). Притяжение между положительными атомными остовами и электронами обусловливает целостность металла.
Металлическую связь можно рассматривать до некоторой степени как ковалентную связь, поскольку в ее основе лежит обобществление внешних валентных электронов.
Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла, и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри всей решетки, образуя «электронный газ». Не имея локализованных связей, металлические кристаллы (в отличие от ионных) не разрушаются при изменении положений атомов, т.е. им свойственна пластичность (ковкость) при деформациях. Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью.
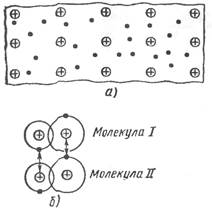
Рис. 1.1. Схема строения металлического проводника (а)
и образования межмолекулярной связи Ван-дер- Ваальса (б)
1.1.4. Молекулярнаясвязь
Молекулярная связь или связь Ван-дер-Ваальса, наблюдается у ряда веществ между молекулами с ковалентным характером внутримолекулярного взаимодействия. Наличие межмолекулярного притяжения в этом случае возможно при согласованном движении валентных электронов в соседних молекулах (рис. 1.1 б). В любой момент времени электроны должны быть максимально удалены друг от друга и максимально приближены к положительным зарядам (ядрам). Тогда силы притяжения валентных электронов ядром соседней молекулы оказываются сильнее сил взаимного отталкивания электронных оболочек этих молекул. Подобное притяжение между флуктуирующими электрическими диполями получило название дисперсионного взаимодействия. Связь Ван-дер-Ваальса является наиболее универсальной, она возникает между любыми частицами, но это наиболее слабая связь, энергия ее примерно на два порядка ниже энергии ионной и ковалентной связей. Поскольку дисперсионное взаимодействие оказывается очень слабым, молекулярные связи четко проявляются лишь в тех случаях, когда они возникают между атомами или молекулами. Молекулярная связь легко разрушается тепловым движением. Поэтому молекулярные кристаллы обладают низкими температурами плавления (например, у парафина Тпл = 50 – 52 °С).