Основні класи неорганічних сполук
ЗМІСТ
| Загальні методичні вказівки | |
| Основні класи неорганічних сполук | |
| Будова атома | |
| Хімічний зв’язок та будова молекул | |
| Термохімія | |
| Хімічна спорідненість | |
| Хімічна кінетика та рівновага | |
| Визначення концентрації розчинів | |
| Властивості розчинів | |
| Іонні реакції в розчинах електролітів | |
| Гідроліз солей | |
| Окисно-відновні реакції | |
| Гальванічний елемент | |
| Корозія металів | |
| Комплексні сполуки | |
| Твердість води | |
| Органічні сполуки. Полімери | |
| Додаток А. Електронегативність елементів | |
| Додаток Б. Термодинамічні константи деяких речовин | |
| Додаток В. Ступені та константи дисоціації електролітів у водних розчинах при 18 °С | |
| Додаток Г. Стандартні електродні потенціали при 18 ºС | |
Загальні методичні вказівки
Хімія відноситься до фундаментальних наук та є основою підготовки спеціалістів з охорони праці в галузі будівництва. Сучасний спеціаліст має розумітися в основних законах і теоріях хімії, знати будову та властивості хімічних елементів, їх сполук, а також речовин, з яких складаються сучасні будівельні матеріали, їх перетворення під час використання, та вплив цих речовин на навколишнє середовище.
Методичні вказівки – це основа для системної самостійної роботи студентів денної форми навчання напряму 6.170202 «Охорона праці» над учбовим матеріалом з курсу хімії.
Для виконання контрольних завдань рекомендована наступна література:
Базова
1. Глинка Н.Л. Общая химия. – Л., Химия, 1983.
2. Суворов А.В., Никольский А.Б. Общая химия. – С.-П., Химия, 1997.
3. Лучинский Г.П. Курс химии. – М., Высш.шк., 1985.
4. Коровин Н.В. Общая химия. – М., Высш.шк., 2000.
5. Ахметов Н.С. Общая и неорганическая химия. – М., Высш.шк., 2001.
6. Курс химии. Ч. 2., спец. для строительных вузов./ Под ред. Киреева В.А. – М., Высш.шк., 1974.
7. Глинка Н.Л. Задачи и упражнения по общей химии. – М., Интеграл – пресс, 2002.
8. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. – М., Высш.шк., 1991.
Допоміжна
1. Основи загальної хімії: Підручник/ В.С.Телегус, О.І.Бодак, О.С.Заречнюк та ін.; За ред. В.С.Телегуса. – Львів: Світ, 2000. – 424с: іл. – ІСБН 5-7773-0315-3.
2. Хімія. Задачі, вправи, тести. Навч.посібник. /Я.М.Каличак, В.В.Кінжибало, Б.Я. Котур та ін. – 2-ге вид., перероб. і доп. – Львів: Світ, 2001. – 176: іл. – ІСБН 966-603-108-6.
Основні класи неорганічних сполук
1. Які оксиди називають амфотерними? З перелічених нижче сполук виберіть амфотерні оксиди й назвіть їх: CuO, А12О3, ZnO, SnO2, CO2, ТiO2, BeO, SiO2, напишіть відповідні реакції.
2. Назвіть і охарактеризуйте оксиди Na2O, HgO, СO2, SO3, СrО3, СаО напишіть характерні реакції.
3. Чи всі основні оксиди взаємодіють з водою? Як взаємодіють з водою такі оксиди: Na2O, HgO, CaO, CrO, CuO? Запишіть рівняння реакцій.
4. Чи всі кислотні оксиди взаємодіють з водою? Вкажіть відношення до води таких оксидів: N2O5, N2O3, SiO2, CO2, NO2. Запишіть рівняння реакцій.
5. З перелічених сполук виберіть основи (а), кислоти (б), основні (в) та кислі солі (г), назвіть їx: HNO2, LiOH, H2SiO3, La(OH)3, Cа(OH)2, HOC1, HMnO4, H3PO4, NaHCO3, (CuOH)2CO3, KHSO4, A1(OH)C12.
6. З перелічених сполук виберіть луги, назвіть їх та запишіть рівняння їхньої дисоціації: Н3РО4, Сu(ОН)2, Са(ОН)2, НNO3, NaOH, Fe(OH)3, Ba(OH)2.
7. Що визначає силу кислот? З перелічених сполук виберіть сильні кислоти, назвіть їх та запишіть рівняння їхньої дисоціації: HNO2, Н3РО4, Н2СО3, НС1, НС1О4, HNO3, СН3СООН, H2SO4.
8. З перелічених сполук виберіть слабкі кислоти, назвіть їх та запишіть рівняння їхньої дисоціації: H2SeO4, H2SO3, HОBr, H3PO3, HBr, H2CrО4, H2CO3, HNO2.
9. Назвіть солі: Са(Н2РО4)2, Zn(ОH)NO3, Ca(OCl)Cl, Na2CrO4, KC1, A1(OH)SO4, KNaSO4, KHCO3. Які з них належать до середніх, кислих, основних, подвійних, мішаних?
10. Які з перелічених кислот утворюють кислі солі: НВr, H2Se, H2SeO3, CH3COOH, Н3РО4? Назвіть утворювані ними кислі солі з натрій гідроксидом і запишіть їхні формули.
11. Напишіть формули солей та формули й назви кислот, з яких вони утворені: а) плюмбум(ІІ) сульфід; б) натрій плюмбат(IV); в) амоній гідрогенфосфат; г) гідроксокупрум(ІІ) карбонат; д) натрій фосфід; е) натрій тіосульфат; ж) калій перхлорат.
12. Виконайте перетворення, записавши рівняння реакцій:
Ca→CaO→Ca(OH)2→CaSO4;
FeS2→SO2→SO3→H2SO4→NaHSO4→Na2SO4.
13. Виконайте перетворення, записавши рівняння реакцій:
Zn→ZnO→Zn(NО3)2→Zn(OH)2→Na2ZnO2→ZnCl2;
N2→NH3→NO→NO2→HNO3→NH4NO3.
14. Виконайте перетворення, записавши рівняння реакцій:
Сu→Cu(NO3)2→СuО→CuSO4→Сu(ОH)2;
С→СО→СО2→СаСО3→Са(НСО3)2.
15. Виконайте перетворення, записавши рівняння реакцій:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe2O3;
Ca3(PO4)2→P2O5→HPO3→H3PO4→Ca(H2PO4)2.
Будова атома
16. Запишіть електронні формули атомів елементів з порядковим номером 32 та 83, враховуючи, що у останнього відбувається “провал” одного 5s-електрона на 4d-підрівень. До якої електронної родини відноситься кожен з цих елементів? Наведіть значення всіх квантових чисел для електронів останнього підрівня атомів цих елементів.
17. Запишіть електронні формули елементів з порядковим номером 49 та 74. Укажіть період, групу, підгрупу та електронну родину кожного з цих елементів. Які орбіталі атома заповнюються раніше : 3d чи 4s; 5p чи 6s?
18. Яка максимальна кількість електронів може бути на s-, p-, d-, та f- орбіталях? Напишіть електронні формули елементів з порядковими номерами 40 та 50. Розподіліть електрони цих атомів по квантовим коміркам.
19. Які орбіталі атома заповнюються електронами раніше : 4d чи 5s; 6s чи 5p? Чому? Запишіть електронні формули елементів з порядковими номерами 51 та 67.
20. Які значення може мати магнітне квантове число mlпри орбітальному квантовому числі l=0, 1, 2, 3? Які елементи в періодичній системі носять назву s-, p-, d- та f- елементів? Наведіть приклади. Запишіть електронні формули елементів з порядковими номерами 35 та 92.
21. Укажіть значення всіх квантових чисел для електронів останнього електронного підрівня атомів елементів з порядковими номерами 52 та 72. Запишіть електронні формули цих елементів, укажіть період, групу, підгрупу, електронну родину.
22. Які значення можуть мати квантові числа n, l, mlіms, що характеризують стан електрона в атомі? Які значення вони мають для зовнішніх електронів атомів 42 та 82?
23. Сформулюйте принцип Паулі? Чи може бути на якомусь підрівні атома р7- чи d12- електронів? Чому? Складіть електронні формули елементів з по рядковими номерами 40 та 60, укажіть валентні електрони.
24. Значення якого квантового числа визначає кількість s-, p-, d- та f- орбіталей на енергетичному рівні? Скільки вільних d- орбіталей є в атомах елементів з порядковими номерами 45 та 63?
25. Які орбіталі атома заповнюються електронами раніше : 4s чи 3d; 5s чи 4p? Чому? Запишіть електронні формули елементів з порядковими номерами 34 та 85.
26. Сформулюйте правило Клечковського. Які орбіталі атома заповнюються раніше: 5s чи 4d ; 6s чи 5p? Чому? Запишіть електронні формули елементів з порядковими номерами 53 та 72.
27. Що таке ізотопи? Чому більшість елементів періодичної системи мають дробне число атомної маси? Складіть електронні формули елементів з порядковими номерами 46 та 82.
28. Запишіть електронні формули елементів з порядковими номерами 39 та 84. Укажіть період, групу, підгрупу, електронну родину. Зовнішні електрони зобразіть графічно, укажіть значення всіх квантових чисел для цих електронів.
29. Сформулюйте правило Хунда. Розмістіть шість d - електронів по квантовим коміркам 3d – підрівня. Чому дорівнює їх сумарне спінове число? Запишіть електронні формули елементів з порядковим номером 33 та 76.
30. Які значення квантових чисел n, l, mlіmsмають електрони останнього підрівня атомів з порядковими номерами 37 та 78? Запишіть електронні формули цих елементів, укажіть період, групу, підгрупу, електронну родину.
Хімічний зв’язок
На основі значень електронегативностей атомів (додаток А) визначте тип хімічного зв’язку в наступних молекулах. Який тип гібридизації спостерігається в молекулі останньої сполуки?
| 31. NH3, | BеO, | МgCl2 |
| 32. H2O, | N2, | AlCl3 |
| 33. Cl2, | KI, | SiH4 |
| 34. CaCl2, | H2, | BeF2 |
| 35. NaBr, | O2, | CF4 |
| 36. NO, | I2, | BCl3 |
| 37. NO2, | MgO, | CaF2 |
| 38. SO2, | NaI, | SiCl4 |
| 39. Br2, | KCl, | BeI2 |
| 40. SiF4, | MgBr2, | BH3 |
| 41. F2, | CaI2, | MgBr2 |
| 42. HCl, | Na2O, | CH4 |
| 43. CS2, | Н2S, | AlBr3 |
| 44. ВF3, | CaBr2, | BeCl2 |
| 45. CO2, | AlF3, | CCl4 |
Термохімія
Розрахуйте тепловий ефект реакції, яка відповідає наступному термохімічному рівнянню :
46. FeO(к) + CO(г) = Fe(к) + CO2(г)
47. 2H2S(г) + CO2(г) = 2H2O(г) + CS2(г)
48. CO2(г) + 4H2(г) = CH4(г) + 2H2O(г)
49. CH4(г) + 2H2S(г) = CS2(г) + 4H2(г)
50. NH3(г) + HCl(г) = NH4Cl(к)
51. CH4(г) +2O2(г) = 2H2O(р) + CO2(г)
52. CaO(к) + H2O(р) = Ca(OH)2(к)
53. C6H6(р) +7 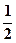 O2(г) = 6CO2(г) + 3H2O(г)
O2(г) = 6CO2(г) + 3H2O(г)
54. 3N2O(г) + 2NH3(г) = 4N2(г) + 3H2O(г)
55. 4NH3(г) + 5O2(г) =4NO(г) + 6H2O(г)
56. СH3OH(р) + 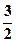 O2(г) = CO2(г) + 2H2O(р)
O2(г) = CO2(г) + 2H2O(р)
57. C2H6(г) +3 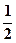 O2(г) = 3H2O(г) + 2CO2(г)
O2(г) = 3H2O(г) + 2CO2(г)
58. 2C2H5OH(р) + 7O2(г) = 4CO2(г) + 6H2O(г)
59. 4NH3(г) + 3O2(г) =2N2(г) + 6H2O(р)
60. 4NH3(г) + 7O2(г) = 4NO2(г) + 6H2O(г)
Хімічна спорідненість
На основі стандартних теплот утворення та абсолютних стандартних ентропій речовин (додаток Б) розрахуйте ∆G˚298 реакції, яка відповідає наступному рівнянню. Чи можливе протікання реакції за стандартними умовами?
61. CH4(г) + CO2(г) = 2CO(г) + 2H2(г)
62. CO(г) + H2O(р) = CO2(г) + H2(г)
63. Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г)
64. 4HCl(г) + O2(г) = 2H2O(г) + 2Cl2(г)
65. Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г)
66. C2H2(г) +  O2(г) = 2CO2(г) + H2O(р)
O2(г) = 2CO2(г) + H2O(р)
67. H2(г) + CO2(г) = CO(г) + H2O(р)
68. 2NO(г) + O2(г) = 2NO2(г)
69. NH3(г) + НСl(г) = NH4Cl(к)
70. CO(г) + 2H2(г) = CH3OH(р)
71. CH4(г) + 2O2(г) = CO2(г) + 2H2О(г)
72. 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
73. 4HCl(г) + O2(г) = 2H2O(г) + 2Cl2(г)
74. 2SO2(г) + O2(г) = 2SO3(г)
75. Fe2O3(к) + 3C(к) = 2FeO(к) + 3CO(г)