Для ответов на задания C1–C3 используйте отдельный лист. Запишите сначала номер задания (С1, C2 или С3), а затем развёрнутый ответ к нему.
Контрольных измерительных материалов для проведения в 2012 году государственной (итоговой) аттестации (в новой форме) по ХИМИИ обучающихся, освоивших основные общеобразовательные программы основного общего образования
Пояснения к демонстрационному варианту экзаменационной работы
При ознакомлении с демонстрационным вариантом 2012 г. следует иметь в виду, что задания, включённые в демонстрационный вариант, не отражают всех элементов содержания, которые будут проверяться с помощью вариантов КИМ в 2012 г. Полный перечень элементов содержания, которые могут контролироваться на экзамене 2012 г., приведён в кодификаторе элементов содержания экзаменационной работы для выпускников IX классов общеобразовательных учреждений по химии, размещённом на сайте: www.fipi.ru.
Демонстрационный вариант предназначен для того, чтобы дать возможность любому участнику экзамена и широкой общественности составить представление о структуре экзаменационной работы, числе и форме заданий, а также об их уровне сложности. Приведённые критерии оценивания выполнения заданий с развёрнутым ответом, включённые в демонстрационный вариант экзаменационной работы, позволят составить представление о требованиях к полноте и правильности записи развёрнутого ответа.
Эти сведения дают выпускникам возможность выработать стратегию подготовки к сдаче экзамена по химии.
Демонстрационный вариант 2012 года
Инструкция по выполнению работы
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 3 частей, содержащих 22 задания.
Часть 1 содержит 15 заданий (А1–А15). К каждому заданию даётся 4 варианта ответа, из которых только один верный. При выполнении задания части 1 обведите кружком номервыбранного ответа в экзаменационной работе. Если Вы обвели не тот номер, то зачеркните обведённый номер крестиком, а затем обведите номер правильного ответа.
Часть 2 состоит из 4 заданий (В1–В4), на которые нужно дать краткий ответ в виде набора цифр. Для заданий части 2 ответ записывается в экзаменационной работе в отведённом для этого месте. В случае записи неверного ответа зачеркните его и запишите рядом новый.
Часть 3 включает 3 задания (С1–С3), выполнение которых предполагает написание полного, развёрнутого ответа, включающего необходимые уравнения реакций и расчёты. Ответы на задания части 3 записываются на отдельном листе.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий Вы можете пользоваться черновиком. Обращаем Ваше внимание, что записи в черновике не будут учитываться при оценке работы.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
Часть 1
К каждому из заданий A1–A15 даны 4 варианта ответа, из которых только один правильный. Номер этого ответа обведите кружком.
| A1 |
На приведённом рисунке
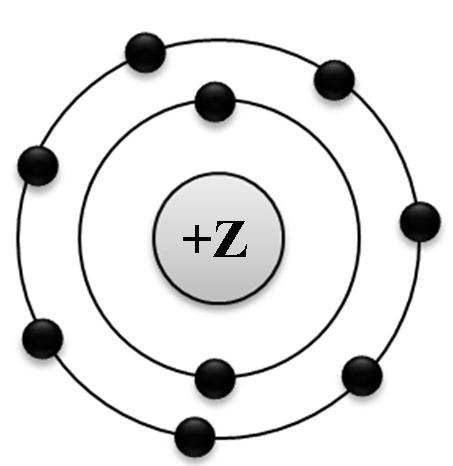
изображена модель атома
| 1) | хлора | 2) | азота | 3) | магния | 4) | фтора |
| A2 |
В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
| 1) | алюминий → фосфор → хлор |
| 2) | фтор → азот → углерод |
| 3) | хлор → бром → иод |
| 4) | кремний → сера → фосфор |
| A3 |
Какой вид химической связи в молекуле фтора?
| 1) | ионная |
| 2) | ковалентная полярная |
| 3) | ковалентная неполярная |
| 4) | металлическая |
| A4 |
В каком соединении степень окисления азота равна +3?
| 1) | Na3N |
| 2) | NH3 |
| 3) | NH4Cl |
| 4) | HNO2 |
| A5 |
Вещества, формулы которых – ZnO и Na2SO4, являются соответственно
| 1) | оснόвным оксидом и кислотой |
| 2) | амфотерным гидроксидом и солью |
| 3) | амфотерным оксидом и солью |
| 4) | оснόвным оксидом и основанием |
| A6 |
Признаком протекания химической реакции между оксидом меди и водородом является
| 1) | появление запаха |
| 2) | изменение цвета |
| 3) | выпадение осадка |
| 4) | выделение газа |
| A7 |
Ионы Br− образуются при диссоциации вещества, формула которого –
| 1) | AlBr3 |
| 2) | CH3Br |
| 3) | NaBrO |
| 4) | Br2 |
| A8 |
Газ выделяется при взаимодействии
| 1) | MgCl2 и Ba(NO3)2 |
| 2) | Na2CO3 и CaCl2 |
| 3) | NH4Cl и NaOH |
| 4) | CuSO4 и KOH |
| A9 |
Не реагируют друг с другом
| 1) | хлор и водород |
| 2) | кислород и кальций |
| 3) | азот и вода |
| 4) | железо и сера |
| A10 |
Оксид цинка реагирует с каждым веществом пары
| 1) | Na2O и H2O |
| 2) | SiO2 и Ag |
| 3) | NaOH и HCl |
| 4) | HNO3 и O2 |
| A11 |
В реакцию с соляной кислотой вступает
| 1) | нитрат серебра |
| 2) | нитрат бария |
| 3) | серебро |
| 4) | оксид кремния |
| A12 |
Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют)
| 1) | только Na2S |
| 2) | NaCl и Na2S |
| 3) | Na2S и Na2SO4 |
| 4) | NaCl и Na2SO4 |
| A13 |
Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А. Повышенное содержание в атмосфере оксидов азота является угрожающим фактором для здоровья человека.
Б. Наличие неорганических кислот в промышленных стоках положительно влияет на жизнедеятельность рыб в водоёмах.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
| A14 |
В приборе, изображённом на рисунке,

получают
| 1) | хлор |
| 2) | аммиак |
| 3) | кислород |
| 4) | хлороводород |
| A15 |
Массовая доля азота в нитрате алюминия равна
| 1) | 19,7% |
| 2) | 27,2% |
| 3) | 36,8% |
| 4) | 54,9% |
Часть 2
При выполнении заданий B1–B2 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов.
| B1 |
В каких рядах химические элементы расположены в порядке уменьшения кислотных свойств их высших оксидов?
| 1) | В → C → N |
| 2) | P → Si → Al |
| 3) | S → Se → Te |
| 4) | P → S → Cl |
| 5) | Ca → Mg → Be |
| Ответ: |
| B2 |
Для этанола верны следующие утверждения:
| 1) | в состав молекулы входит один атом углерода |
| 2) | атомы углерода в молекуле соединены двойной связью |
| 3) | является жидкостью (н.у.), хорошо растворимой в воде |
| 4) | вступает в реакцию со щелочными металлами |
| 5) | сгорает с образованием угарного газа и водорода |
| Ответ: |
При выполнении заданий B3–B4 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Выбранные цифры запишите под соответствующими буквами таблицы. Цифры в ответе могут повторяться.
| B3 |
Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
| СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ | |||||||||||||||||
|
|
| Ответ: | А | Б | В |
| B4 |
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ | |||||||||||||||
|
|
| Ответ: | А | Б | В |
Часть 3
Для ответов на задания C1–C3 используйте отдельный лист. Запишите сначала номер задания (С1, C2 или С3), а затем развёрнутый ответ к нему.
| C1 |
Дана схема превращений:
CaO → X  CaCO3 → CO2
CaCO3 → CO2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
| C2 |
170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли
в растворе нитрата серебра.
| C3 |
Для определения качественного состава неизвестной соли учащимся выдали белое кристаллическое вещество, хорошо растворимое в воде и известное как «нашатырь». Часть выданной соли смешали с твёрдым гидроксидом кальция и смесь нагрели. При этом выделился газ с резким запахом. Другую часть соли растворили в воде и к полученному раствору прилили прозрачный раствор нитрата серебра. Образовался белый осадок.
Запишите химическую формулу и название выданной соли. Составьте два уравнения реакций, которые были проведены в процессе её распознавания.