Известные данные о структуре и спектральных характеристиках аскорбиновой кислоты.
Введение.
На сегодняшний день способность человека успешно справляться с эмоциональным и физическим бременем стресса в большей степени зависит от того, какие витамины присутствуют в его рационе. Причем, она больше зависит от витамина С, чем от какого-либо другого витамина. Например, надпочечники, которые выделяют гормоны, необходимые, чтобы действовать в стрессовых ситуациях, содержат больше аскорбата, чем любая другая часть тела. Витамин С помогает выработке этих стрессовых гормонов и защищает организм от токсинов, образующихся в процессе их метаболизма.
Аскорбиновая кислота(витамин С) - водорастворимый витамин, содержащийся в продуктах растительного происхождения, имеющий важное значение для жизнедеятельности организма. Её важнейшая функция - антиоксидантная. Она ослабляет токсическое действие свободных радикалов - агрессивных элементов, образующихся в организме при заболеваниях, больших физических нагрузках, отрицательных воздействиях окружающей среды [2,c] .
В данной работе исследуются спектры вынужденного комбинационного рассеяния (ВКР) и инфракрасная спектроскопия поглощения (ИК-спектр) аскорбиновой кислоты. Это метод изучения поможет лучше понять строения молекулы аскорбиновой кислоты. Так как спектр ВКР и ИК-спектр поглощения не дублируют друг друга, то, сопоставляя частоты линий данных спектров одного и того же химического элемента, можно судить о симметрии молекулы. Т.е. получается реальная модель молекулы аскорбиновой кислоты, отвечающая закономерностям в наблюдаемых спектрах.
Исходя вышеизложенного, можно сказать, что целью данной курсовой работы является сравнительный анализ спектра вынужденного комбинационного рассеяния и инфракрасного спектра с помощью разных методов расчета.
В связи с поставленной целью, решаются следующие задачи:
1.Изучение теоретического материала в данном направлении.
2.Построение молекулы аскорбиновой кислоты.
3.Рассчет спектра ИК-поглощения и комбинационного рассеяния молекулы аскорбиновой кислоты с помощью разных методов.
4.Сравнение полученных данных.
В главе 1 данной курсовой работы рассматривается структура аскорбиновой кислоты: её свойства, спектральные характеристики и стабильность.
В главе 2 рассматривается колебательные спектры молекул и методы их расчета.
В главе 3 производится построение молекулы аскорбиновой кислоты: численный расчет структурных параметров и ее преобразование после оптимизации.
В главе 4 рассчитывается ИК-спектр и спектр комбинационного рассеяния с помощью нескольких методов; производится сравнительный анализ на основе полученных результатов.
Физико-химические свойства аскорбиновой кислоты.
Известные данные о структуре и спектральных характеристиках аскорбиновой кислоты.
По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса с температурой плавления 192С.Легко растворим в воде и спирте. Её общая структура показана на рисунке 1.

| Рисунок 1.Структура аскорбиновой кислоты. |
Аскорбиновая кислота образует четыре оптических изомера: L- и D-аскорбиновые кислоты и L- и D- изоаскорбиновые кислоты. Биологически активен только один из изомеров- L-аскорбиновая кислота, который называют витамином С.
Синтетически аскорбиновую кислоту получают из глюкозы. Синтезируется растениями из различных гексоз (глюкозы, галактозы) и большинством животных (из галактозы), за исключением приматов и некоторых других животных (например, морских свинок), которые получают её с пищей. Схема синтеза кислоты аскорбиновой показана на рисунке 2:
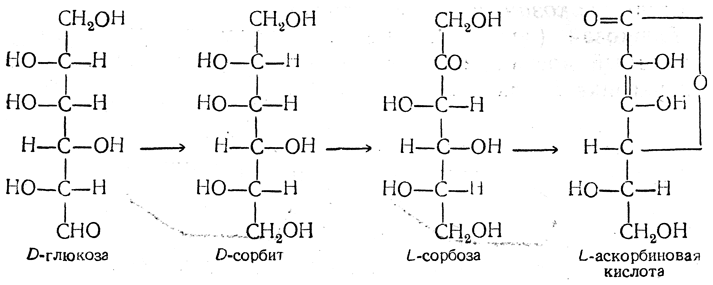
Рисунок 2.Схема синтеза аскорбиновой кислоты.
По химическому составу аскорбиновая кислота является лактоном 2,3 диспол-гулоиопой кислоты. Аскорбиновая кислота-окисленное производное шестиатомного спирта сорбита-характерна наличием дипольной группы  которая обуславливает способность витамина С легко подвергаться окислению с одновременным восстановлением других соединением. Т.е., можно сказать, что химические свойства обусловлены строением аскорбиновой кислоты:
которая обуславливает способность витамина С легко подвергаться окислению с одновременным восстановлением других соединением. Т.е., можно сказать, что химические свойства обусловлены строением аскорбиновой кислоты:
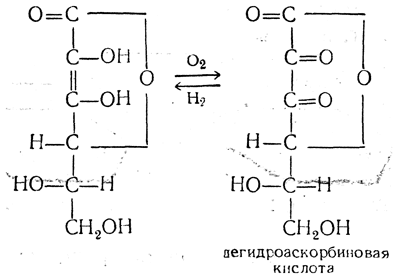
1. Окислительно - восстановительные свойства. Аскорбиновая кислота в мягких условиях легко окисляется в дегидроаскорбиновую (лактон2,3-дикетогулоновойкислоты), могущую столь же легко вновь восстанавливаться (рисунок 3):
| Рисунок 3.Процесс окисления аскорбиновой кислоты в дегидроаскорбиновую. |
2. Кислотнные свойства. Кислотные свойства используют для испытания подлинности. После добавления карбоната натрия в водном растворе происходит образование ионизированной формы кислоты аскорбиновой. К полученной натриевой соли прибавляют железа (II) сульфат. Появляется темно-фиолетовое окрашивание, обусловленное образованием железа аскорбината, исчезающего после добавления разведенной серной кислоты (рис.4.):

Рисунок 4.Пример проявления кислотных свойств аскорбиновой кислоты.
3. Кислота аскорбиновая имеет характерный спектр поглощения в УФ-области и ИК области.
· В ИК-спектре L-аскорбиновой кислоты имеется ряд интересных максимумов поглощения (рис.5).

Рисунок 5. Инфракрасный спектр L-аскорбиновой кислоты (в виде эмульсии в нуйоле).
Особенный интерес представляет область валентных колебаний О-Н от 4000 до 2000 см -1, которая в укрупненном масштабе приведена на рис. 6.

Рисунок 6.Инфракрасный спектр L-аскорбиновой кислоты (в таблетках NaCl).
Так как длины водородных связей (и соответственно прочность) в кристалле известны, можно провести корреляцию этих максимумов поглощения и характеристических валентных колебаний ОН-групп, участвующих в образовании водородных связей. Валентные колебания обозначаются О-Н. Очевидно, что четыре отчетливых пика в высокочастотном крыле спектра соответствуют спиртовым ОН-группам при С-5 и С-6 боковой цепи.
Что касается низкочастотных сигналов, сильное поглощение при 1754 см -1 было отнесено за счет валентных колебаний группы С=О пятичленного лактонного кольца, а интенсивный дублет при 1675 и 1660 см -1 — за счет валентных колебаний группы С=С (на которые накладываются колебания вдоль всей сопряженной системы). Сигнал при 1460 см -1 приписан ножничным колебаниям группы СН2 ,т.е. деформационным колебаниям С-Н .
Дополнительно можно сказать, что в данном спектре полосы около 2955, 2924, 2855 см1 соответствуют валентным колебаниям С-Н, 1462, 1378 и 722 см1 – деформационным колебаниям С-Н вазелиннового масла. Полосы с частотами около 2361, 2346, 2334 и 666 см1 соответствует колебаниям присутствующего в атмосфере углекислого газа.
На основании анализа спектров аскорбиновой кислоты были выделены следующие характеристических полосы поглощения: С=О в -бутиролактоне (1755 см1), С=С (1675 см1),as(С-О-С) (1322 см1) и s(С-О-С) (1026 см1).

Рисунок 7. ИК-спектр аскорбиновой кислоты в вазелиновом масле.
· УФ-спектр L-аскорбиновой кислоты при рН 2 имеет максимум поглощения при 243 нм (е = 10 000 моль-1 дм3 см-1-коэффициент экстинкции ), который при рН 7,0 сдвигается в красную область к 265 нм (е = 16 500моль-1 дм3 см-1) за счет депротонирования С3-ОН группы.
Спектры поглощения представляют собой зависимость интенсивности поглощения от длины волны. Характеристикой поглощающей способности вещества является коэффициент экстинкции:
= A/(l*c), []=дм3/моль*см;
l-длина поглощающего слоя, см;
с-концентрация, моль/ дм3;
Поглощение с >104 принято считать интенсивным, с <103- cлабым. Коэффициент экстинкции вещества постоянен и не зависит от концентрации.
Эти изменения соответствуют * электронному переходу в сопряженной двойной углерод-углеродной связи пятичленного лактонного кольца.
Т.к. спектр поглощения в ультрафиолетовой области в кислотной водной среде имеет максимум при 243 нм, в щелочной среде максимум сдвигается к 265 нм. (рис. 9).Это свидетельствует о наличии сопряженной системы двойных связей.

Рисунок 8. Предпочтительное строение молекулы L-аскорбиновой кислоты.

Рисунок 9.УФ-спектр поглощения кислоты аскорбиновой.