Принципы выбора наборов реактивов
В условиях рыночной экономики клинико-диагностические лаборатории имеют возможность широкого выбора готовых наборов реактивов отечественного и зарубежного производства. Достоверность результатов лабораторных исследований зависит от аналитической надежности метода (правильности, воспроизводимости, специфичности, чувствительности) и его практичности (время анализа, технологические требования, стоимость и т. п.).
Надежность и практичность могут вступать в конфликт в отношении стоимости. Всегда следует отдавать предпочтение надежности метода.
При выборе набора реактивов следует в первую очередь учесть принцип метода, положенный в основу набора, и его надежность. Если критерии аналитической надежности подтверждены, необходимо оценить практичность набора, особенно с точки зрения экономии времени анализа и сокращения числа этапов исследования.
Практичность зависит от:
— стоимости;
— времени анализа;
— числа пипетирований;
— необходимости депротеинизации;
— необходимости нагревания (времени инкубации);
— необходимости постановки холостой пробы, пробы на сыворотку;
— зависимости от типа оборудования;
— возможности автоматизации;
— наличия реактивов, их стабильности, необходимости в дополнительных реактивах;
— необходимости и наличия калибратора;
— объема исследуемого образца;
— безопасности (агрессивность веществ);
— линейности и диапазона определения;
— числа определений, на которое рассчитан набор;
— срока и условий хранения набора и рабочих реагентов.
РАСТВОРЫ: ИХ ПРИГОТОВЛЕНИЕ, СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ, ИСПРАВЛЕНИЕ
Переход химических веществ в состояние раствора является обязательным условием протекания различных метаболических процессов в организме и выполнения многих видов клинико-лабораторного исследования.
Раствор — это жидкая, газообразная или твердая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут быть произвольно изменены в довольно широких пределах.
Жидкие растворы бывают водные и неводные. Те и другие представляют собой однородную физико-химическую дисперсную систему, в которой равномерно по отношению друг к другу распределены частицы растворенного вещества, растворителя и продукты их взаимодействия. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если обе составные части системы до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается жидкость, взятая в большем количестве.
В зависимости от размера частиц распределенного вещества выделяют три класса дисперсных систем:
1) ионно-молекулярные (истинные растворы): размеры частиц распределенного в них вещества не превышают 1 нм;
2) коллоидные системы (коллоидные растворы) с размерами частиц до 100 нм; для такой системы характерно рассеивание проходящего через нее света — феномен Тиндаля;
3) грубодисперсные системы, содержащие частицы твердого (суспензии) и жидкого (эмульсии) вещества диаметром более 100 нм.
Все вещества обладают определенной, присущей им растворимостью в воде. Она выражается числом граммов вещества, которое, будучи растворенным при определенной температуре в 100 г растворителя, дает насыщенный раствор; иначе говоря, растворимость — это максимальное количество вещества (в г), которое может быть растворено в 100 г растворителя определенной температуры.
При нагревании растворимость твердых веществ в воде, как правило, повышается, а газов — уменьшается. На ухудшении растворимости с понижением температуры раствора основано выделение вещества (обычно в виде кристаллов определенной структуры) и очистка его от примесей. Этот процесс называется кристаллизацией. Началу кристаллизации способствует встряхивание раствора или внесение в него кристаллика растворенного вещества. Процесс кристаллизации идет тем быстрее, чем выше исходная концентрация раствора. Завершается кристаллизация установлением динамического равновесия между двумя противоположными процессами: растворения и перехода вещества из раствора в структуры кристаллов. После достижения такого состояния раствор является насыщенным (в нем не может быть растворено дополнительное количество вещества при данной температуре). В момент установления динамического равновесия между процессами растворения и кристаллизации количество вещества, перешедшего в раствор, не изменяется, и растворение практически прекращается.
Если в растворе вещества находится меньше, чем в насыщенном, он именуется ненасыщенным. При создании определенных условий могут быть получены пересыщенные растворы. Некоторые вещества особенно склонны к образованию пересыщенных растворов, что следует иметь в виду при выполнении биохимических исследований. Так, в процессе определения ионов калия химическим методом, основанным на реакции образования купрумгексанитрита калия свинца К2Рb [Cu(NО2)6], получается пересыщенный раствор, для осаждения из которого сформированной комплексной двойной соли требуется длительное потирание стеклянной палочкой о внутренние стенки пробирки (с целью образования центров кристаллизации). В противном случае могут возникнуть ложно заниженные результаты.
Понятия «насыщенный» и «ненасыщенный» не следует отождествлять с понятиями «концентрированный» и «разбавленный». Концентрированный раствор отнюдь не обязательно должен быть насыщен. Например, раствор, содержащий 20 г селитры KNO3 в 100 г воды, является концентрированным, но если температура его 20°С, то он еще далеко не насыщен. Для получения насыщенного раствора при этой температуре нужно было бы взять 31,5 г селитры на 100 г воды. С другой стороны, и насыщенный раствор может быть разбавленным (если вещество мало растворимо). Так, насыщенный раствор гипса при 20°С содержит всего лишь 0,21 г вещества в 100 г раствора. Представление о количественном содержании вещества в растворе выражается понятием концентрации.
Концентрацией раствора называется массовое (г, кг) или объемное (мл, л) содержание вещества в определенном количестве или объеме раствора.
В зависимости от способа выражения концентрации растворы делят на приблизительные и точные.
Согласно требованиям Международной системы единиц (SI), содержание вещества в приблизительных растворах в настоящее время выражается размерностью массовой концентрации, массовых и объемных отношений, заменивших соответствующие выражения отдельных видов процентной концентрации.
Под процентной концентрацией принято понимать определенное количество вещества (г или мл), содержащееся в 100 г или 100 мл раствора. Это общее определение включает несколько вариантов. В зависимости от размерности единиц объема или массы, используемой для обозначения количества растворенного вещества и раствора, различают массовую (весовую), массо-объемную (весо-объемную), объемную, объемно-массовую (объемно-весовую) процентную концентрацию.
Массовая (весовая) процентная концентрация (%) показывает, сколько граммов вещества содержится в 100 г раствора: % = 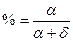 , где α — количество растворенного вещества, b — количество растворителя в граммах (в сумме составляют 100 г).
, где α — количество растворенного вещества, b — количество растворителя в граммах (в сумме составляют 100 г).
Например, 38% раствором соляной кислоты называют такой раствор, в 100 г которого содержится 38 г хлористого водорода и 62 г воды. Для получения раствора этого вида процентной концентрации навеску вещества вносят в химический стакан, в который затем вливают 62 мл воды (масса 1 мл воды комнатной температуры составляет примерно 1 г). При приготовлении растворов различных химических реагентов удобно использовать массовую концентрацию.
Массо-объемная процентная концентрация (г%) представляет собой отношение количества растворенного вещества в граммах к 100 мл раствора. Размерность этого вида процентной концентрации — г/мл (масса/объем). Например, 10 г% раствор хлористого натрия содержит 10 г соли в 100 мл раствора. Для его получения навеску соли (10 г) вносят в мерный цилиндр или мензурку и доливают водой до метки. В случае водных растворов одинаковой (по численному обозначению) массовой и массо-объемной процентной концентрации различия в количественном содержании вещества в единице объема практически не выявляются, или же ими можно пренебречь. Однако при использовании неводных растворов они могут быть весьма значительны. Так, в 10% растворе жира в тетрахлорметане, или, что то же самое, четыреххлористом углероде (жидкости плотностью 1,6 кг/л) на 10 г жира приходится около 90 мл растворителя, тогда как в 10 г% растворе значительно меньше: 56 мл.
Объемная процентная концентрация (об% или градус) есть отношение объема количества (мл) растворенного вещества к 100 мл раствора. Размерность этого вида процентной концентрации — мл/мл (объем/объем). Например, 5 об% (5°) раствор этилового спирта содержит 5 мл абсолютного (безводного) спирта и 95 мл воды. Следует, правда, иметь в виду, что при смешивании разных жидкостей, бесконечно растворяющихся друг в друге (как, например, в случае этилового спирта и воды), в силу явления контракции (т. е. взаимного проникновения молекул одного вещества в промежутки между молекулами другого) конечный объем раствора может составлять менее 100 мл.
Объемно-массовая процентная концентрация отражает количество (мл) вещества, содержащегося в 100 г раствора. Она редко используется в клинико-лабораторной практике.
Многие химические реактивы поступают в лабораторию (приобретаются) в виде кристаллогидратов. Растворы процентной концентрации приготовляют из них двумя способами: точным и условным.
Для приготовления раствора процентной концентрации требуется прежде всего рассчитать навеску кристаллогидрата, содержащую заданное количество вещества. Если необходимо получить 10% раствор сернокислой меди из кристаллогидрата соли состава CuSО4 x 5Н2О, для определения соответствующей навески кристаллогидрата исходят из того, что на одну молекулу сернокислой меди приходится пять молекул воды. Молекулярная масса кристаллогидрата сернокислой меди, составляющая 245 г, складывается из 155 г чистой соли и 90 г воды (18 х 5), где 18 — молекулярная масса воды. Путем решения пропорции:
245 г CuSО4 х 5Н2О содержат 155 г CuSО4
Х г CuSО4 х 5Н2О - 10 г CuSО4
находят требуемую навеску кристаллогидрата (X):
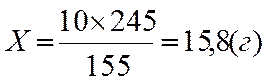
На этикетке бутыли, в которой хранится такой раствор, должно быть написано: «10% (или 10 г%) раствор CuSО4». Это значит, что в 100 г (или 100 мл) раствора содержится 10 г сернокислой меди, а не ее кристаллогидрата.
Условный способ выражения процентной концентрации базируется на использовании для получения раствора кристаллогидратов веществ. Например, для приготовления 10% раствора медного купороса (CuSО4 х 5Н2О) отвешивают 10 г кристаллической соли и приливают воду до объема 100 мл. Поскольку такой раствор не является десятипроцентным, на этикетке сосуда, в котором он хранится, должна быть надпись: «10% (или 10 г%) раствор CuSО4 х 5Н2О».
При использовании кристаллических солей важно быть уверенным в полном соответствии действительного (фактического) состава соли ее химической формуле. При неправильном хранении препаратов кристаллогидратов (в разгерметизированной посуде) может происходить частичная потеря кристаллизационной воды (выветривание), из-за чего часть вещества, особенно на поверхности кристаллов, переходит в аморфное состояние. Такой реактив не пригоден для приготовления растворов ни первым, ни вторым способом. В данном случае требуется предварительно перекристаллизовать его (т. е. восстановить кристаллическую структуру реагента) или, если это позволяют химические свойства вещества, прокалить, переведя его таким образом в аморфное состояние.
Поскольку в соответствии с требованиями международной системы единиц в качестве единицы массы и объема раствора используются «кг» и «л» (соответственно), для получения необходимых показателей размерности значения отдельных видов процентной концентрации требуется умножить на 10. При этом массовая и объемная процентные концентрации преобразуются в массовое и объемное отношения с размерностью г(кг)/кг, мл(л)/л, массо-объемная процентная концентрация — в массовую концентрацию с размерностью г(кг)/л.
Для приготовления неточных растворов используются технохимические (технические), аптекарские весы и неточная мерная посуда (цилиндры, мензурки). В случае, 1 если возникает потребность в получении приблизительных растворов путем разбавления более концентрированных, можно воспользоваться простым и быстрым способом, именуемым правилом «креста».
Если требуется получить 5% (50 г/л) раствор хлористого аммония из более концентрированного 15% (150 г/л), составляют первую запись:
где 15 — показатель концентрации взятого раствора, 0 — вода и 5 — требуемой концентрации. Из 15 вычитают 5 и полученное значение записывают в правом нижнем углу. Вычитая же 0 из 5, записывают цифру в правом верхнем углу. После этого схема принимает вид:
Это означает, что для получения 5% раствора нужно 5 объемов 15% раствора смешать с 10 объемами воды.
Если смешивать два исходных раствора одного и того же вещества для получения раствора промежуточной концентрации, то из схемы устраняется «О». Пусть смешиванием 35% и 15% раствора требуется приготовить 25%. В этом случае схема примет вид:
Следовательно, для приготовления 25% раствора нужно взять по 10 объемов обоих исходных растворов.
Приведенными схемами можно пользоваться только тогда, когда не требуется достижения особой точности приготовления растворов.
1. ТОЧНЫЕ РАСТВОРЫ
Характеризуются размерностью молярной (моль/л), моляльной (моль/кг), нормальной (гэкв/л) концентрации и титра. Для получения растворов точной концентрации применяют исходные вещества (т. е. реактивы квалификации «х. ч.», строго отвечающие своей химической формуле, устойчивые к воздействию света и воды, негигроскопичные, не взаимодействующие с углекислым газом воздуха, обладающие большой молекулярной массой, что позволяет свести к минимуму техническую ошибку взвешивания), фиксаналы, точную мерную посуду и весы для очень точного взвешивания (аналитические, полумикрохимические, микрохимические). Поскольку не всегда удается получить точный раствор нужной концентрации путем растворения приготовленной навески вещества или содержимого некоторых ампул (фиксаналов), его приходится проверять путем титрования, находить коэффициент поправки и при необходимости исправлять.