Уравнение Нобля-Абеля (Дюпре). Уравнения состояния газа
Уравнения состояния газа. Идеальный газ, реальный газ. Формы (виды) уравнений состояния для газов. Уравнение Нобля-Абеля (Дюпре), как следствие уравнения Ван-дер-Ваальса.
УРАВНЕНИЯ СОСТОЯНИЯ ГАЗА F(p, r ,T):
Частные случаи: F(r ,T) F(p, r) F(p, T).
Конкретная запись зависит от модели представления газа:
Идеальный газ
Реальный газ
Идеальный газ
1) Объемом, занимаемым молекулами, пренебрегается
2) Силами взаимодействия между молекулами пренебрегается
Связь между давлением, плотностью и температурой описывается уравнением Клапейрона-Менделеева: pW=wRT или p= rRT (1)
где p – давление; W – объем; R=nr; n =1000/M - число молей газа в 1 кг пороха; М=23-25 г/моль; r=8,3143 КДж/(кг.град) – универсальная газовая постоянная; Т – температура газа.
Формула (1) применяется для давлений до 50 МПа.
Реальный газ
1) Объем, занимаемый молекулами, учитывается
2) Силы взаимодействия между молекулами учитываются
Связь между давлением, плотностью и температурой описывается уравнениями Ван-дер-Ваальса, Нобля-Абеля (Дюпре) и вириальным.
Уравнение Ван-дер-Ваальса
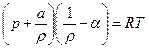 (2)
(2)
где a – коэффициент, учитывающий сцепление между молекулами; a – коволюм газов (дм3/кг), параметр, равный учетверенному собственному объему молекул.
Формула (1) применяется при давлениях в десятки тысяч МПа.
Уравнение Нобля-Абеля (Дюпре)
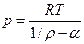 |
(3)
Это частный случай уравнения Ван-дер-Ваальса, в котором параметром и пренебрегается. Формула (3) применяется при давлениях от 50 до 2000 МПа.
 Вириальное уравнение состояния
Вириальное уравнение состояния
, (4)
 |
где (5)
Z – сжимаемость газа, B, C, D и Е – вириальные коэффициенты, зависящие от температуры газа.