Биологические функции белков
Содержание белка в органах и тканях человека
| Органы и ткани | Содержание белка, % | |
| от сухой ткани | от общего белка тела | |
| Скелетные мышцы | 34,7 | |
| Кожа | 11,5 | |
| Кости (твердые ткани) | 18,7 | |
| Пищеварительный тракт | 1,8 | |
| Мозг и нервная ткань | 2,0 | |
| Печень | 3,6 | |
| Сердце | 0,7 | |
| Легкие | 3,7 | |
| Селезенка | 0,2 | |
| Почки | 0,5 | |
| Поджелудочная железа | 0,1 | |
| Жировая ткань | 6,4 | |
| Остальные ткани: | ||
| жидкие | 1,4 | |
| плотные | 14,6 | |
| Все тело | 100,0 |
Аминокислотный состав.Белки состоят из аминокислот. Известно около 200 различных аминокислот, однако для построения белков в животных и растительных тканях используются только 20. Называются эти аминокислотыосновными.Наряду с основными в состав отдельных белков входят другие аминокислоты - неосновные.Каждая такая аминокислота происходит от одной из 20 основных аминокислот.
Простые и сложные белки.В зависимости от химического состава белки делятся на простые и сложные.Простые белкисостоят только из аминокислот, среди которых есть растворимые в воде (гистоны, альбумины, фибриноген) и не растворимые (глобулины, миозин, коллаген, осеин, кератин). Сложные белкисостоят из белковой и небелковой частей. Небелковая часть может быть представлена углеводами, нуклеиновыми кислотами, липидами, фосфорной кислотой, окрашенными (хромо-) веществами. В зависимости от природы небелковой части сложные белки делятся на гликопротеиды, нуклеопротеиды, липопротеиды, фосфопротеиды, хромопротеиды. Все они выполняют разнообразные функции в организме.
Биологические функции белков
Структурная(пластическая). В комплексе с липидами белки составляют структуру всех клеточных мембран и основу цитоплазмы клеток. Структурной основой соединительной ткани являются такие белки, как коллаген (входит в состав хрящей и сухожилий), кератин (входит в состав кожи), эластин (входит в состав связок и стенок сосудов).
Каталитическая.Эту функцию выполняют специфические белки-ферменты, регулирующие обмен веществ и энергии в организме. Если ферменты не работают в клетке, то биохимические реакции не протекают и живая клетка может погибнуть.
Сократительная.Все виды сокращения и движения скелетных мышц, миокарда и других сокращающихся тканей обеспечивают сократительные белки актин и миозин.
Транспортная.Белки способны связывать и транспортировать с током крови или через клеточные мембраны отдельные молекулы и ионы. Например, гемоглобин эритроцитов крови переносит кислород от легких к тканям и углекислый газ - от тканей к легким; миоглобин мышц переносит кислород в мышечной ткани к местам его использования. Отдельные белки крови транспортируют жирные кислоты, липиды, железо, некоторые гормоны.
Защитная.Белки иммунной системы гаммаглобулины "узнают" и связывают чужеродные вещества, поступающие в организм, защищая тем самым его от вирусов, бактерий и клеток других организмов. Защитную функцию выполняет также белок интерферон. Белки плазмы крови фибриноген и тромбин участвуют в процессах свертывания крови, предотвращая кровопотери при ранениях.
Гормональная,или регуляторная. Высокоспецифические белки-гормоны регулируют обмен веществ.
Рецепторная.Многие белки являются рецепторами гормонов, нейромедиаторов, других биологически активных веществ. Они осуществляют избирательное узнавание, связывание и передачу их регуляторного действия.
Передача наследственной информации.Белки входят в состав хромосом и участвуют в воспроизведении генетической информации, в регуляции процессов роста и размножения.
Опорная.Упругость и прочность костей скелета, кожи, сухожилий обеспечивают преимущественно белки коллаген и эластин.
Энергетическая.Около 10-15 % энергопотребления организма обеспечивается белками. При окислении 1 гбелков выделяется 17 кДж (4,1 ккал) энергии.
Аминокислоты- это производные органических (карбоновых) кислот, содержащие одну или несколько аминогрупп (-NH2). Аминогруппа в аминокислотах чаще находится в ?-положении углеродного атома по отношению к карбоксильной группе, т.е. присоединена к первому атому углерода, с которым связана карбоксильная группа. Каждая аминокислота может рассматриваться как вещество, у которого к атому углерода присоединены аминогруппа (-NH2), карбоксильная группа (-СООН), атом водорода (Н) и различная боковая углеродная цепь, обозначенная как радикал (А), что видно из общей формулы и пространственной модели аминокислоты:
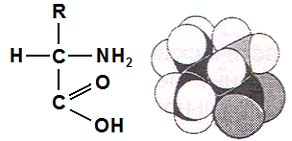
Все аминокислоты различаются химическим составом и строением боковой углеродной цепи либо радикалом. Особенности строения боковых цепей аминокислот, входящих в белки, характеризуют свойства белков, лежат в основе проявления их разнообразных функций и придают им биологическую индивидуальность.
Классификация аминокислот.Аминокислоты в зависимости от строения радикала делятся на ациклические,имеющие незамкнутый, и циклические,имеющие замкнутый углеродный радикал. В зависимости от количества функциональных групп (-NH2 и -СООН) ациклические аминокислоты делятся на моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые и диаминодикарбоновые кислоты. Отдельные ациклические аминокислоты могут содержать оксигруппу (-ОН) или сульфгидрильную группу (-SH). Они называются оксикислотами (серин, тирозин) или серосодержащими аминокислотами (цистеин, цистин, метионин).
Циклические аминокислоты делятся на гомоциклическиеи гетероциклические.Гомоциклические аминокислоты имеют в цикле только атомы углерода (фенилаланин, тирозин). В гетероциклических аминокислотах в цикле присутствуют и другие химические элементы, например азот (триптофан, гистидин, пролин).
Аминокислоты различаются особенностями своего метаболизма и обычно подразделяются на заменимые и незаменимые.
Заменимые и незаменимые аминокислоты.Большинство аминокислот синтезируются в клетках организма в процессе обмена веществ и называются заменимыми.Не поступление их с пищей не вызывает существенных изменений в обмене веществ. Другие аминокислоты не синтезируются в организме, поэтому называютсянезаменимыми.Эти аминокислоты обязательно должны поступать с пищей. Для взрослых людей незаменимыми являются девять аминокислот, а для детей необходима еще десятая - аргинин (суточная потребность для них варьирует в пределах. 0,5-6 г) (табл. 4).
Таблица 4.