Суточная потребность в аминокислотах
| Аминокислоты | |||
| Заменимые, г | Незаменимые, г | ||
| Аланин | 3,0 | Валин | 1,5 |
| Аргинин | 6,0 | Гистидин | 2,0 |
| Аспарагин | 3,0 | Лизин | 1,5 |
| Аспарагиновая кислота | 6,0 | Лейцин | 2,0 |
| Глицин | 3,0 | Изолейцин | 1,3 |
| Глутамин | 6,0 | Метионин | 2,0 |
| Глутаминовая кислота | 6,0 | Треонин | 0,9 |
| Пролин | 3,0 | Триптофан | 0,5 |
| Серин | 3,0 | Фенилаланин | 2,0 |
| Тирозин | 4,0 | Аргинин (для детей) | 6,0 |
| Цистеин | 3,0 |
Белки пищи, содержащие все незаменимые аминокислоты, называются полноценными.Такие белки содержатся в основном в продуктах животного происхождения и являются неотъемлемым компонентом рационального питания человека.
Свойства аминокислот.Химически чистые аминокислоты представляют собой белые со слабым запахом безвкусные порошки. Однако соли некоторых аминокислот имеют вкус и запах. Так, например, натриевая соль глутаминовой кислоты имеет вкус и запах куриного бульона, поэтому используется как пищевая приправа. Большинство аминокислот растворимы в воде и не растворимы в органических растворителях. Аминокислоты в водных растворах диссоциируют на ионы. В нейтральной среде они находятся в биполярной форме, имея положительный (-NH3+) и отрицательный (-СОО-) заряды.
Аминокислоты - амфотерные соединения, поскольку в водных растворах могут взаимодействовать как с кислотами, так и с основаниями.
В зависимости от количества амино- или карбоксильных групп аминокислоты могут иметь положительный заряд на молекуле и проявлять основные свойства (аргинин, лизин, гистидин) или отрицательный заряд и проявлять кислотные свойства (аспарагиновая и глутаминовая кислоты).
Амфотерные свойства аминокислот влияют на кислотно-основные свойства белков и их биологические функции, особенно на их буферное действие. Эффективным буфером в эритроцитах крови является белок гемоглобин, содержащий большое количество остатков аминокислоты гистидина, которая и придает этому белку значительную буферную емкость при нейтральных значениях рН.
Значение аминокислот.В клетках организма существует определенный метаболический уровень (пул) аминокислот, который включает аминокислоты, образовавшиеся при распаде белков пищи и тканевых белков, а также вновь синтезированные (заменимые) аминокислоты. В большей степени аминокислоты (400 г/сут) используются для синтеза белков тела, в меньшей (30 г/сут) - для синтеза других азотсодержащих соединений. Аминокислоты могут превращаться в углеводы или жирные кислоты, холестерин и кетоновые тела, а также окисляться до конечных продуктов СО2, Н2О, NН3 с выделением энергии.
Из отдельных аминокислот синтезируются многие биологически активные вещества: гормоны, коферменты, биогенные амины. Так, из фенилаланина и тирозина синтезируются гормоны катехоламины (адреналин и норадреналин) и тироксин. Аминокислота аланин входит в состав кофермента ацетилирования (КоА). Метионин используется для синтеза нейропередатчика ацетилхолина, который играет важную роль в функции нервной системы. Применяется он при лечении заболеваний нервной системы и для улучшения восстановительных процессов, в том числе и в спортивной практике.
При декарбоксилировании аминокислот образуются биогенные амины. Основными биогенными аминами являются ?-аминомасляная кислота (ГАМК), гистамин, серотонин и креатин. ГАМКобразуется в мозге из глутаминовой кислоты. Накопление ее в мозге приводит к развитию процессов торможения в моторных центрах ЦНС.Гистаминобразуется в различных тканях при декарбоксилировании гистидина и поэтому называется тканевым гормоном.Он вызывает расширение мелких кровеносных сосудов и сужение крупных, а также сокращение гладких мышц внутренних органов. Гистамин участвует в возникновении болевого синдрома, стимулирует образование соляной кислоты в желудке. Серотонинобразуется из триптофана. Он участвует в регуляции артериального давления, температуры тела, частоты дыхания, почечной фильтрации. В больших дозах серотонин стимулирует, а в малых - подавляет деятельность ЦНС. Креатинсинтезируется в тканях из заменимых аминокислот аргинина и глицина. Под действием креатинкиназы и АТФ он превращается в креатинфосфат,который используется для ресинтеза АТФ в мышцах. Количество креатинфосфата пропорционально мышечной массе. Креатин и креатинфосфат превращаются в креатинин,который выводится с мочой. Количество креатинина, выделяющегося из организма, пропорционально общему содержанию креатинфосфата и может использоваться для характеристики массы мышц. При уменьшении мышечной массы уменьшается также содержание креатинина в моче.
Структурная организация белков.Белки состоят из большого количества (не менее 50) аминокислот, соединенных между собой пептидной связью. Поэтому они называются полипептидами.
Пептидная связь- это прочная ковалентная связь между аминогруппой (-NH2) одной аминокислоты и карбоксильной группой (-СООН) другой аминокислоты. При этом образуется дипептид и высвобождается молекула воды:
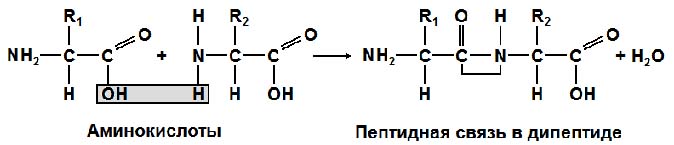
Название пептидов образуется от названия аминокислот, последовательно входящих в полипептид. При этом в названии аминокислот, за исключением последней аминокислоты, которая сохраняет свою карбоксильную группу, меняется суффикс "ин" на "ил": глицилаланин, аланилглицилтирозин.
Структура, или конформацuя белков.Аминокислотная последовательность в белках определяет их пространственную структуру (конформацию). Каждый белок уникален по своей структурной организации, от которой зависят его биологические функции, что будет рассмотрено далее на примере отдельных белков.
В образовании пространственной структуры белков участвуют различные типы химических связей. Основными химическими связями в белках являются ковалентные, дисульфидныесвязи (-S-S-), образующиеся между -SН-группами остатков цистеина, водородные,образующиеся за счет электростатических сил притяжения водорода и кислорода разных функциональных групп в белке, а также ионныесвязи, образующиеся между ионизированными карбоксильными (-СОО-) и аминными (-NH3+) группами аминокислотных радикалов. Выделяют четыре структуры белковых молекул: первичную, вторичную, третичную и четвертичную.
Первичная структура белка- это определенная последовательность аминокислот в полипептидной цепи, а также их количественный и качественный состав. Последовательность расположения аминокислот в отдельных белках генетически закреплена и обусловливает индивидуальную и видовую специфичность белка.
Расшифровка первичной структуры белка имеет большое практическое значение, так как открывает возможность синтеза его в лаборатории. Благодаря расшифровке структуры гормона инсулина (Сенгер, 1954) и иммуноглобулина (Эдельман и Портер, 1972) эти белки получают синтетически и широко применяют в медицине. Изучение первичной структуры гемоглобина позволило выявить изменения его структуры у людей при отдельных заболеваниях. В настоящее время расшифрована первичная структура более 1000 белков, в том числе ферментов рибонуклеазы, карбоксипептидазы, миоглобина, цитохромов и многих других.
Вторичная структура белка- это пространственная укладка полипептидной цепи. Выделяют три типа вторичной структуры: ?-спираль, слоисто-складчатая спираль (или ?-спираль) и коллагеновая спираль.
При образовании ?-спирали полипептидная цепь спирализуется за счет водородных связей таким образом, что витки пептидной цепи периодически повторяются. При этом создается компактная и прочная структура полипептидной цепи белка. ?-Спираль характерна для белков кератинов, которые являются основой кожи, волос, ногтей.
Слоисто-складчатая структура белка представляет собой линейные полипептидные цепи, расположенные параллельно и прочно связанные водородными связями. Такая структура является основой для фибриллярных белков (миозина, ?-кератина волос и др.).
Коллагеновая спираль белка выделяется более сложной укладкой полипептидных цепей. Отдельные цепи спирализованы и закручены одна вокруг другой, образуя суперспираль. Такая структура характерна для коллагена. Коллагеновая спираль имеет высокую упругость и прочность стальной нити.
Третичная структура белка- это пространственная укладка спирализованных и линейных участков полипептидной цепи в компактную структуру в виде глобулы(шарообразная или яйцевидная) или фибриллы(нитеобразная). Третичная структура обеспечивает биологическую активность каждого белка. Нарушение этой структуры приводит к частичной или полной потере его биологической функции.
Четвертичная структура белкапредставляет собой объединение нескольких одинаковых или разных полипептидных цепей (субъединиц) со своей третичной структурой в сложную молекулу, проявляющую биологическую активность. Субъединицы соединяются между собой нековалентными связями. Четвертичную структуру имеют многие ферменты (например, лактатдегидрогеназа, пируватдегидрогеназа), а также гемоглобин. Белки с четвертичной структурой называются олигомерными, или мультимерными.
Все четыре уровня организации белковой молекулы взаимосвязаны и обеспечивают нативную (естественную) конформацию каждого белка. В проявлении биологической активности белков особое место занимает третичная и четвертичная структуры, весьма чувствительные к изменению условий среды. Поскольку многие внутриклеточные ферменты имеют четвертичную структуру, то одним из механизмов регуляции их активности является изменение конформации белков.
Форма белковых молекул.В зависимости от третичной структуры белки могут иметь нитевидную(фибриллярную)и шарообразную (глобулярную)форму.
Фибриллярные белки являются структурным или сократительным материалом организма. Например, коллаген входит в состав сухожилий, хрящей, кожи и принимает участие в образовании скелета, а миозин является сократительным белком мышц. Эти белки не растворяются в воде.
Глобулярные белки способны легко передвигаться и проникать через стенки кровеносных капилляров. Они растворяются в воде и содержатся в жидких средах организма. Глобулярными являются белки иммунной системы (антитела), сократительный белок мышц актин, все ферменты, а также гемоглобин, миоглобин и многие другие белки.
Глобулярные белки могут превращаться в фибриллярные. Такое изменение формы белка влияет на его свойства (растворимость, специфическую функцию). Глобулярные белки при переходе в фибриллярные становятся нерастворимыми и плохо перевариваются, а ферменты теряют каталитическую функцию.
Свойства белков.Проявление биологической активности белков зависит не только от строения их молекул, но и от химических свойств. Основными физико-химическими свойствами белков являются: молекулярная масса, растворимость в воде, способность образовывать гели, денатурация, амфотерность, буферное действие и др.
Молекулярная массабелков колеблется от 6000 до нескольких миллионов дальтон. Так, молекулярная масса гормона инсулина составляет 5733, рибонуклеазы (фермента, расщепляющего РНК) - 12640, миоглобина (белка мышц) - 17 000, гемоглобина - 64 500, глобулина сыворотки крови - 176 000, миозина (белка мышц) - 493 000. Масса белковых молекул влияет на скорость их передвижения в биологических жидкостях.
Растворимостьбольшинства белков в воде осуществляется благодаря способности связывать воду: она увеличивается при небольших концентрациях нейтральных солей и уменьшается при их высоких концентрациях. Водные растворы белков представляют собой коллоиды.
Способность образовывать гели или сгусткиимеет большое физиологическое значение, поскольку придает им высокую упругость или эластичность (белки коллаген и эластин, актомиозиновый комплекс). Гели - это структурные объединения белков (сетки), в которых внутреннее пространство заполнено большим количеством воды.
Коагуляция(от лат. coagulatio - свертывание, сгущение) - это укрупнение частиц в коллоидных системах, которое может сопровождаться образованием коагулянта (плотного сгустка). Иногда это приводит к образованию сплошных объемных структур (желатинирование).
Денатурация- это нарушение нативной структуры белков под воздействием различных факторов, приводящее к потере его биологической активности. Денатурация наблюдается при нагревании, изменении рН среды, ультрафиолетовом и ионизирующем облучении, механическом воздействии солей тяжелых металлов, спирта, ацетона. При быстром удалении денатурирующих факторов белок может вернуться в нативное состояние (ренатурировать) с восстановлением его биологической функции.
Амфотерные свойства белковпроявляются благодаря наличию свободных –NH2 И -СООН групп. В кислой среде белки могут диссоциировать как основания, а в щелочной - как кислоты. При взаимодействии с кислотами и основаниями белки образуют солеподобные соединения, способные выпадать в осадок. На этом основан один из методов выделения белков осаждение путем высаливания. Амфотерность белков используют при разделении их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за изменениями функциональных состояний.
Буферное действие белков(поддержание в тканях организма постоянства рН) характерно для немногих белков. К таким, в частности, относится гемоглобин - сильный внутриклеточный буфер в эритроцитах, а также отдельные белки плазмы крови и дипептид карнозин.