Супервторичная структура белков.
В разных по первичной структуре и функциям белках иногда выявляются сходные сочетания и взаиморасположение вторичных структур,которые называются супервторичной структурой. Она занимает промежуточное положение между вторичной и третичной структурами, поскольку это специфическое сочетание элементов вторичной структуры при формировании третичной структуры белка. Супервторичные структуры имеют специфические названия, такие как «α-спираль-поворот-а-спираль», «лейциновая застежка молния», «цинковые пальцы» и др. Такие супервторичные структуры характерны для ДНК-связывающих белков.
Доменами называют области в третичной структуре белка с определенной структурной автономией. Домены составляют подуровень структурной организации белка на пути от вторичной к третичной структуре, и свертывание достаточно крупных белковых глобул при биосинтезе белка проходит, вероятно, через стадию формирования доменов. Как правило, домены могут независимо от других частей белковой молекулы поддерживать и даже формировать пространственную структуру. Удается выделить домены с помощью ограниченного протеолиза.
Наличие доменов создает структурные предпосылки для большей внутренней гибкости, динамики белковых молекул, достигаемой смещением доменов относительно друг друга.
«Лейциновая застежка-молния».Этот вид супервторичной структуры используется для соединения двух белков. На поверхности взаимодействующих белков имеются α-спиральные участки, содержащие не менее четырех остатков лейцина. Лейциновые остатки в α-спирали располагаются через шесть аминокислот один от другого. Так как каждый виток α-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка. Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка (гидрофобные взаимодействия), соединяя их вместе. Многие ДНК связывающие белки функционируют в составе олигомерных комплексов, где отдельные субъединицы связываются друг с другом «лейциновыми застежками».
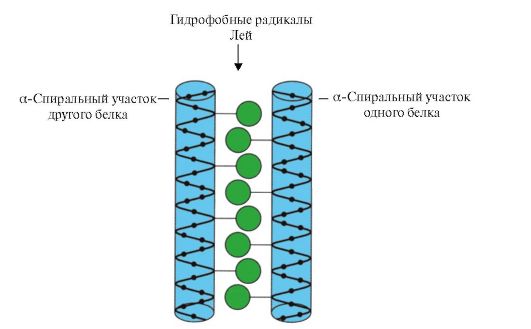
Рис. 1.«Лейциновая застежка-молния» между α-спиральными участками двух белков
Примером таких белков могут служить гистоны. Гистоны- ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот - аргинина и лизина (до 80%). Молекулы гистонов объединяются в олигомерные комплексы, содержащие восемь мономеров с помощью «лейциновых застежек», несмотря на значительный одноименный заряд этих молекул.
«Цинковый палец»- вариант супервторичной структуры, характерный для ДНК-связывающих белков, имеет вид вытянутого фрагмента на поверхности белка и содержит около 20 аминокислотных остатков. Форму «вытянутого пальца» поддерживает атом цинка, связанный с радикалами четыре аминокислот - двух остатков цистеина и двух - гистидина. В некоторых случаях вместо остатков гистидина находятся остатки цистеина. Два близко лежащих остатка цистеина отделены от двух других остатков Гисили Циспоследовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует α-спираль, радикалы которой могут специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность связывания индивидуального регуляторного ДНК-связывающего белка зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца». Такие структуры содержат, в частности, рецепторы стероидных гормонов, участвующих в регуляции транскрипции (считывание информации с ДНК на РНК).
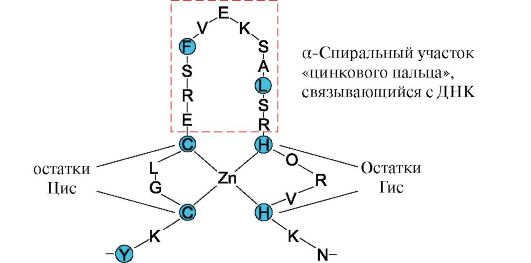
Рис. 2. Первичная структура участка ДНК-связывающих белков, формирующих структуру «цинкового пальца» (буквами обозначены аминокислоты, входящие в состав этой структуры).
Рассматривая третичную структуру белка, нужно сказать о таком процессе, как фолдинг белка.
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
В результате фолдинга в водных растворах у водорастворимого полипептида уменьшается свободная энергия, гидрофобные остатки аминокислот упаковываются преимущественно внутрь молекулы, а гидрофильные остатки располагаются на поверхности белковой глобулы. К факторам, стабилизирующим конформацию белка, относятся водородные связи, дисульфидные мостики, электростатическое взаимодействие и комплексообразование с ионами металлов.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами. Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков (более подробно это описано в статье Прионы).
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Шапероны - специальные белки, катализирующие укладку полипептидов. Шапероны связываются с гидрофобными участками неправильно уложенных белков и помогают им свернуться и достигнуть стабильной нативной структуры и, тем самым, предотвращают их включение в нерастворимые и нефункциональные агрегаты. В течение своей функциональной жизни, белок может подвергаться различным стрессам и денатурации. Такие частично денатурированные белки могут стать мишенью протеаз, агрегировать или укладываться в нативную структуру с помощью шаперонов.
В ряде случаев несколько белковых макромолекул соединяются друг с другом и образуют громадные агрегаты. Подобные полимерные образования, в которых в роли мономеров выступают макромолекулы белка, называют четвертичными структурами. Крепление четвертичной структуры осуществляется слабыми (водородными, гидрофобными) связями, а в некоторых случаях и –S–S– связями.
Примерами белков четвертичной структуры являются: гемоглобин.
Сейчас мы к нему подберемся!
Мы с вами уже знаем, что существуют как простые, так и сложные белки!
Вопрос в зал: Что такое простые белки?
Что такое сложные белки?
У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа – лиганд(лат. ligo - связываю), то есть молекула, связанная с белком. В случае если лиганд несет структурную и/или функциональную нагрузку, он называется простетической группой.
В роли лиганда могут выступать любые молекулы:
· молекулы, выполняющие в белке структурнуюфункцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы, какие-либо другие органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах, медь в церулоплазмине,
· переносимыебелками молекулы: железо в трансферрине, гемоглобин в гаптоглобине, гем в гемопексине,
· субстратыдля ферментов – любые молекулы и даже другие белки.
Узнавание лиганда обеспечивается:
· комплементарностьюструктуры центра связывания белка структуре лиганда, иначе говоря, пространственным и химическим соответствием белка и лиганда. Они подходят друг к другу как ключ к замку, например, соответствие фермента и субстрата,
· иногда узнавание может зависеть от реакционной способности атома, к которому присоединяется лиганд. Например, связывание кислорода железом гемоглобина, или жирной кислоты с альбумином.
Функции лигандав составе сложного белка разнообразны:
· изменяет свойства белков (заряд, растворимость, термолабильность), например, фосфорная кислота в фосфопротеинах или остатки моносахаридов в гликопротеинах,
· защищает белок от протеолиза вне и внутри клетки, например углеводная часть в гликопротеинах,
· в виде лиганда обеспечивается транспорт нерастворимых в воде соединений, например, перенос жиров липопротеинами,
· придает биологическую активность и определяет функцию белка, например, нуклеиновая кислота в нуклеопротеинах, гем в гемоглобине, углевод в рецепторных белках,
· влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и секрецию белков. Это выполняет, как правило, углеводный остаток.
Нуклеопротеины – это белки, связанные с нуклеиновыми кислотами. Они составляют существенную часть рибосом, хроматина, вирусов.
В рибосомах рибонуклеиновая кислота (РНК) связывается со специфическими рибосомальными белками. Вирусы являются практически чистыми рибо- и дезоксирибонуклеопротеинами.
В хроматине нуклеиновая кислота представлена дезоксирибонуклеиновой кислотой, связанной с разнообразными белками, среди которых можно выделить две основные группы – гистоныи негистоновыебелки. Начальный этап упаковки ДНК осуществляют гистоны, более высокие уровни обеспечиваются другими белками.
Фосфопротеины– это белки, в которых присутствует фосфатная группа. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу.
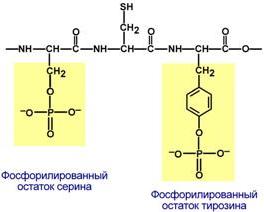
Фосфорная кислота может выполнять:
· Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине.
· Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированнуюили в дефосфорилированнуюформу, что играет регулирующую роль в его работе.
Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеины.Ионы металлов соединены координационными связями с функциональными группами белка.
Металлопротеины часто являются ферментами. Ионы металлов входят в состав активного центра фермента и здесь:
· участвуют в ориентации субстрата,
· формируют ковалентные связи с интермедиатами реакции,
· являются донорами или акцепторами электронов при взаимодействии фермента с субстратами.
К ферментативным металлопротеинам относятся белки, содержащие например:
· медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ,
· железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, каталаза, обезвреживающая перекись водорода,
· цинк– алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, карбоангидраза, образующая угольную кислоту из CO2 и H2O, щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений, α2-макроглобулин, антипротеазный белок крови, фермент кишечника карбоксипептидаза
· селен– тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы, антиоксидантный фермент глутатионпероксидаза,
· кальций– α-амилаза слюны и панкреатического сока, гидролизующая крахмал.
· молибден– ксантиноксидаза, отвечающая за последние реакции катаболизма пуриновых оснований.
· магний – гексокиназа, отвечающая за реакцию фосфорилирования глюкозы.
· марганец – супероксиддисмутаза, отвечающая за реакцию нейтрализации кислородного радикала супероксид-аниона О2•¯.
· никель – уреаза, отвечающая за распад мочевины.
К липопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды.
Однако традиционно к липопротеинам относят также надмолекулярные образования, переносящие липиды в плазме крови, включающие белки и молекулы всех классов липидов.
Концентрация и соотношение количества транспортных липопротеинов в крови играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз.
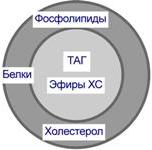
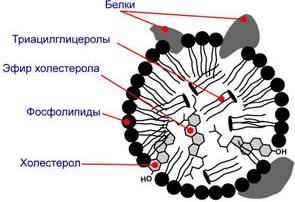
Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупаи ядро. "Скорлупа" липопротеина является гидрофильной, ядро – гидрофобное.
· ядро формируют неполярные эфиры холестерола(ХС) и триацилглицеролы(ТАГ), которые и являются транспортируемыми жирами. Их соотношение колеблется в разных типах липопротеинов.
· в поверхностном слое ("скорлупе") находятся фосфолипиды, холестерол, белки. Гидрофильность липидов поверхностного слоя призвана обеспечить растворимость гидрофобного ядра в плазме крови.
Белки в липопротеинах называются апобелками, их выделяют несколько видов: А, В, С, D.
В каждом типе липопротеинов преобладают соответствующие ему апобелки, которые несут либо структурную функцию, либо являются ферментами метаболизма липопротеинов.
| 
|
| Схема строения липопротеина | Строение липопротеина |
Выделяют четыре основных класса липопротеинов:
· липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП),
· липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
· липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
· хиломикроны (ХМ).
Функцией липопротеинов является перенос в крови триацилглицеролов и холестерола и его эфиров.
Свойства и функции липопротеинов разных классов зависят от состава, т.е. от соотношения триацилглицеролов, холестерола и его эфиров, фосфолипидов, белков:
| Типы липопротеинов | По направлению сверху вниз происходит изменение состава |
| Хиломикроны (до 90% липидов) ЛПОНП ЛПНП ЛПВП (до 80% белков) | Увеличение количества белка Увеличение количества фосфолипидов Уменьшение количества триацилглицеролов |
Класс под названиемгликопротеиныили, более корректно, гликоконъюгаты– это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе.
Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между этими подклассами имеются существенные отличия:
| Гликопротеины | Протеогликаны |
| · доля углеводов 15-20%, · не содержат уроновых кислот, · углеводные цепи содержат не более 15 звеньев, · углевод имеет нерегулярное строение. | · доля углеводов 80-85%, · имеются уроновые кислоты, · углеводные цепи крайне велики, · углевод имеет регулярное строение. |
Гликопротеины
Для собственно гликопротеинов характерно низкое содержание углеводов. Они присоединены либо N-гликозидной связью к амидному азоту аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина, треонина, гидроксилизина. Углевод имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, их аминопроизводные, N-ацетилнейраминовую кислоту.
