Химическая термодинамика. Химическая кинетика и равновесие
Вариант 11
1. Как должна изменится энтропия при эндотермическом процессе, чтобы он мог протекать самопроизвольно?
2. Определите стандартную теплоту образования сероуглерода CS2, используя тепловой эффект следующей реакции:
CS2 (ж) + 3О2 (г) ® СО2 (г) + 2SO2 (г); ΔrН˚298 = -1075 кДж.
3. Определите ΔrG˚298 реакции, протекающей по уравнению:
4NH3 (г) + 5О2 (г) ® 4NO (г) + 6Н2О (г).
Вычисления сделайте на основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция в стандартных условиях?
4. При определённых условиях реакция хлороводорода с кислородом является обратимой:
4HCl (г) + О2 (г) « 2Cl2 (г) + 2Н2О (г); ΔrН = -116,4 кДж.
Какое влияние на равновесие системы окажут:
– увеличение давления,
– повышение температуры,
– введение катализатора?
5. При температуре 30°С реакция протекает за 25 мин, при 50°С – за 4 мин. Рассчитайте температурный коэффициент скорости реакции.
6. При состоянии равновесия системы: СО (г) + Сl2 (г) « COCl2 (г) концентрация оксида углерода (II) равна 3  ; хлора – 0,3
; хлора – 0,3  ; фосгена – 2
; фосгена – 2  . Вычислите исходную концентрацию хлора и константу равновесия.
. Вычислите исходную концентрацию хлора и константу равновесия.
Контрольная работа 1
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 12
1. Сформулируйте закон Гесса и следствия из него. Приведите примеры использования закона Гесса.
2. Определите тепловой эффект реакции: CaO (кр) + СО2 (г) ® СаСО3 (кр), если при взаимодействии 140 г оксида кальция с углекислым газом выделяется 444 кДж теплоты.
3. Укажите, будет ли процесс 2Al (кр) + Fe2O3 (кр) ® 2Fe (кр) + Al2O3 (кр) протекать самопроизвольно. Значения ΔfH˚298 и S˚298, необходимые для расчёта ΔrG˚298 найдите в справочнике.
4. Каким из указанных ниже способов можно увеличить выход водяного пара в реакции:
СО2 (г) + Н2 (г) « СО (г) + Н2О (г); ΔrН = -0,8 кДж
а) увеличить давление,
б) уменьшить давление,
в) увеличить концентрацию водорода,
г) уменьшить концентрацию углекислого газа.
5. Энергия активации реакции: 2HI (г) ® Н2 (г) + I2 (г) равна 186,4 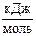 . Рассчитайте константу скорости этой реакции при 700 К, если при 456 К константа скорости равна 0,942×10-6
. Рассчитайте константу скорости этой реакции при 700 К, если при 456 К константа скорости равна 0,942×10-6  .
.
6. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции: 2NO2 « 2NO + O2 установилось при концентрации диоксида азота, равной 0,8  ; оксида азота – 2,2
; оксида азота – 2,2  ; кислорода – 1,1
; кислорода – 1,1  . Вычислите константу равновесия реакции для этой температуры и исходную концентрацию диоксида азота.
. Вычислите константу равновесия реакции для этой температуры и исходную концентрацию диоксида азота.
Контрольная работа 1
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 13
1. Уменьшится или увеличится энтропия при переходе кислорода в озон, воды в лёд? Почему? Определите DS° для каждого превращения.
2. Найдите теплоту образования оксида серы (IV), если известно, что при сжигании серы выделилось 74,225 кДж теплоты, и образовалось 0,016 кг оксида серы (IV).
3. Восстановление Fe3O4 оксидом углерода (II) идёт по уравнению:
Fe3O4 (кр) + СО (г) ® 3FeO (кр) + CО2 (г)
Вычислите ΔrG˚298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему ΔrS˚298 равно в этом процессе?
4. При определённых условиях реакция хлороводорода с кислородом является обратимой:
4HCl (г) + О2 (г) « 2Cl2 (г) + 2Н2О (г); ΔrН = -116,4 кДж.
Какое влияние на равновесие системы окажут:
– увеличение давления,
– повышение температуры,
– введение катализатора?
5. Во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70°С, если температурный коэффициент реакции равен 2?
6. При синтезе аммиака при некоторых условиях в равновесии находятся 0,1  N2; 0,2
N2; 0,2  Н2; 0,8
Н2; 0,8  NH3. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода.
NH3. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода.
Контрольная работа 1