Ксантопротеиновая реакция
Принцип метода: ароматические аминокислоты свободные, а также входящие в состав пептидов и белков при нагревании с азотной кислотой образуют нитросоединение желтого цвета, переходящего в оранжевый при добавлении щелочи.
Материальное обеспечение: пробирки, пипетки, штатив, растворы белков, концентрированная азотная кислота, 20% раствор едкого натра.
Ход работы:
1. Возьмите 3 прибирки.
В первую налейте 1 мл раствора яичного альбумина.
Во вторую налейте 1 мл раствора пепсина.
В третью налейте 1 мл раствора амилазы.
2. Во все пробирки добавьте по 5 капель концентрированной азотной кислоты.
3. Осторожно нагрейте растворы и наблюдайте окраску.
4. Охладите пробирки, добавьте по 0,5 мл 20% раствора NаОН и наблюдайте изменение окраски.
При наличии ароматических аминокислот появляется желтое окрашивание, которое после охлаждения раствора и добавления раствора едкого натра переходит в оранжевое.
Полученные результаты занесите в таблицу.
Результаты реакций:
| № пробирки | Исследуемый р-р | Окраска растворов в реакциях | ||
| биуретовой | нингидриновой | ксантопротеиновой | ||
| Яичный белок | ||||
| Пепсин | ||||
| амилаза |
ВЫВОДЫ:
Подпиись преподавателя:
Приложение 1
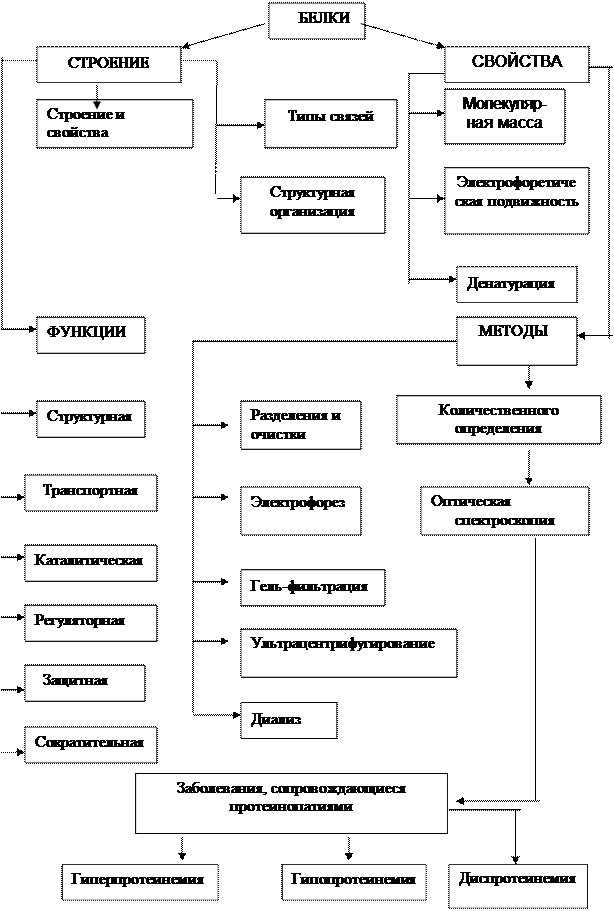
Граф логической структуры

ТЕМА 1.2. ИССЛЕДОВАНИЕ СТРУКТУРЫ И ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ ФЕРМЕНТОВ
Актуальность темы
Ферменты - это биологические катализаторы белковой природы, которые контролируют практически все химические процессы, протекающие в живых организмах. В том числе они катализируют сотни многостадийных реакций, в ходе которых образуется и превращается энергия, расщепляются молекулы питательных веществ, строятся различные макромолекулы.
Медицинская энзимология является важным разделом клинической биохимии. По определению активности ферментов, изоферментов в жидких средах организма, биоптатах, изучаются особенности течения ферментативных реакций в условиях патологии. Полученная информация может быть использована как в диагностике, так и во время лечения.
Знание основ ферментологии необходимо студентам для изучения таких предметов, как патологическая физиология, патологическая анатомия, фармакология, а также для освоения ряда клинических дисциплин.
Теперь ознакомьтесь с целью занятия.
Общая цель:
Уметь интерпретировать свойства и функции ферментов для диагностики и лечения болезней, связанных с нарушением функционирования ферментов.
Достижение этой цели обеспечивается решением конкретных задач, повторением базисных знаний, полученных на предыдущем курсе химии.
Конкретные цели Цели исходного уровня:
Уметь:
| 1. Интерпретировать структуру ферментов как простых и сложных белков. | 1.Интерпретировать структуру аминокислот как компонентов простых и сложных белков (каф. медицинской и фарм.химии). |
| 2. Интерпретировать качественные реакции на субстраты или продукты ферментативных процессов для оценки свойств ферментов. | 2.Интерпретировать качественные реакции на крахмал и глюкозу для оценки степени гидролиза крахмала (каф. медицинской и фарм.химии). |
| 3. Интерпретировать свойства энзимов: а) термолабильность, б) зависимость от pH в) специфичность на основе анализа их структуры. | 3.Интерпретировать структуры и конформации белков и их свойства (каф. медицинской и фарм.химии). |
| 4. Интерпретировать свойства изоферментов, как “индикаторных” ферментов для диагностики заболеваний. |
Для проверки исходного уровня Вам предлагается выполнить ряд заданий.
Задания для самопроверки и самокоррекции исходного уровня.
Задание 1. При исследовании аминокислотного состава гидролизата белка, применяемого в клинике для парентерального белкового питания, был использован хроматографический метод. По результатам хроматографии аминокислоты были разделены на кислые и основные.
1.1. Назовите аминокислоты, попавшие во фракцию кислых аминокислот.
А. Аспартат
В. Лизин
С. Глутаминовая кислота
D. Аргинин
Е. Триптофан
1.2. Назовите аминокислоты, попавшие во фракцию основных аминокислот
А. Аспартат
В. Лизин
С. Глутаминовая кислота
D. Аргинин
Е. Триптофан
Задание 2. Вам даны 4 пробирки с неизвестными растворами. Проделав реакцию с реактивом Люголя, получили следующие окраски: 1) синяя; 2) бурая; 3) желтая; 4) фиолетовая.
2.1. В какой пробирке произошел полный гидролиз крахмала?
А. В первой пробирке
В. Во второй пробирке
С. В третьей пробирке
D. В четвертой пробирке
2.2. Какое вещество образовалось при неполном гидролизе крахмала?
А. Глюкоза
В. Декстрины
С. Олигосахариды
Задание 3. Для определения аминокислотной последовательности в белках применяют частичный гидролиз, используя ферменты (например, пепсин или трипсин) или химические реагенты, специфично действующие на пептидные связи между определенными аминокислотами.
3.1. Какую структуру белка можно установить такими методами?
А. Первичную
В. Вторичную
С. Третичную
D. Четвертичную
3.2. Дайте определение этой структуре.
А. Способ укладки полипептидной цепи в виде альфа-спирали или бета-структуры
В. Пространственная укладка полипептидной цепи, содержащей альфа-спираль и
бета-структуру.
С. Определенная последовательность аминокислот в полипептидной цепи,
фиксированная пептидными связями
D. Объединение двух и более протомеров в молекуле олигомерного белка.
Задание 4. Изучение третичной структуры белка. необходимое для выяснения строения активного центра “сериновых протеиназ” (трипсин, химотрипсин) было проведено с помощью метода специфической модификации функциональных групп.
4.1. Укажите связи, которыми стабилизируется эта структура белка?
А. Дисульфидные
В. Пептидные
С. Связи между амино- и карбоксильными группами аминокислот.
D. Ионные
Е. Эфирные
Задание 5. Для изучения конформации белка был применен метод рентгеноструктурного анализа. Дайте определение понятию “конформация белковой молекулы”.
А. Пространственная укладка полипептидной цепи, обеспечивающая его функции.
В. Пространственная укладка полипептидной цепи, содержащей альфа-спираль и
бета-структуру.
С. Определенная последовательность аминокислот в полипептидной цепи
D. Полипептидная цепь, фиксированная пептидными связями
Е. Объединение двух и более протомеров в молекуле олигомерного белка.
Задание 6. Белок, состоящий из шести субъединиц, обработали раствором восстановителя, в результате чего произошло изменение его физико-химических свойств.
6.1. Какие связи между субъединицами могли разрушиться в результате восстановления?
А. Водородные
В. Гидрофобные
С. Дисульфидные
D. Ионные
Е. Пептидные
6.2. Назовите аминокислоту, участвующую в образовании этих связей.
А. Метионин
В. Цистеин
С. Глутаминовая кислота
D. Аргинин
Е. Гистидин
6.3. Как называется разрушение структур белка (кроме первичной), сопровождающееся изменением физико-химических свойств и утратой функции?
А. Гидролиз
В. Денатурация
D. Высаливание
Д. Диализ
Е. Протеолиз
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению заданий для самопроверки и самоконтроля исходного
уровня:
1.1 - А, С; 2.1 - С; 3.1 - А; 4.1 - А, D; 5 - А; 6.1 - С.
Информацию для восполнения исходных знаний можно найти в следующей литературе:
1.Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.: Медицина, 1991.–С. 355- 377
2.Лекции по биоорганической химии.
Основные теоретические вопросы, позволяющие выполнить целевые виды деятельности:
1. Химическая природа ферментов.
2. Структура ферментов.
2.1. Понятие об активном центре.
2.2. Понятие об аллостерическом центре.
3. Свойства ферментов.
3.1. Зависимость от pН.
3.2. Термолабильность.
3.3. Специфичность.
4. Методы изучения свойств ферментов.
4.1. Изоферменты.
5. Применение ферментов в диагностике.
Найти материал для освоения этих вопросов можно в одном из следующих источников:
Обязательная литература
1. Губський Ю.Г. Біологічна хімія.- Київ-Тернопіль: Укрмедкнига, 2000.-С. 86-87, 89-91,
98-103, 106, 109, 114
2.Тестовые задания по биологической химии/ Под ред.Б.Г.Борзенко.-Донецк, 2000. - С.5 –
3. Лекции по биохимии
4. Граф логической структуры (Приложение 1)
5. Инструкция к практическому занятию
Дополнительная литература
1 Березов Т.Т., Коровкин Б.Ф. Биологическая химия.-М.: Медицина,1998.-С.114-129,
139-143, 163-165
2.Березов Т.Т., Коровкин Б.Ф. Биологическая химия.- М.: Медицина,1990.-С.92-108, 112-
115, 124-125, 129-132
3.Николаев А.Я. Биологическая химия. -М.: ООО «Медицинское информационное агентство»,
1998. - С. 53 - 61, 76-78, 81-92
4. Пустовалова Л.М. Практикум по биохимии.- Ростов-на-Дону.: Феникс, 1999.-С.90-95,
101-102, 108-111
После изучения вышеперечисленных вопросов для самопроверки усвоения материала по изучаемой теме предлагается решить следующие целевые обучающие задачи.
Целевые обучающие задачи
Задача 1.Выберете из предложенных вариантов, что является наиболее существенным доказательством белковой природы ферментов?
А. Высокая молекулярная масса.
В. Получение кристаллических форм.
С. Возможность лабораторного синтеза.
D. Гидрофильность.
E. Разрушение протеолитическими ферментами.
Задача 2.Фермент, состоящий из четырех субьединиц, обработали b - меркаптоэтанолом, восстанавливающим дисульфидные связи, что привело к потере каталитической активности. С чем связана инактивация фермента?
А. С потерией нативной структуры - денатурацией.
В. С разрушением только четвертичной структуры.
С. С утратой только третичной структуры.
D. С распадом только вторичной структуры.
E. С гидролизом пептидных связей.
Задача 3. Согласно теории Кошленда, субстрат способен индуцировать в ферменте изменения конфигурации молекулы в соответствии со своей структурой. Вследствие этого в активном центре ензима происходит связывание с молекулой субстрата. Что не относится к функциям активного центра?
А. Отвечает за специфическое соединение с субстратом.
B. Участвует в образовании фермент- субстратного комплекса.
C. Осуществляет каталитическое превращение субстрата.
D. Отвечает за взаимодействие с эффекторами.
Задача 4. АТФ является эффектором для регуляторного фермента гликолиза – гексокиназы. Вследствие их взаимодействия у гексокиназы отмечаются структурные изменения, и она теряет свою каталитическую активность. С какой структурной единицей фермента связывается АТФ?
А. С апоферментом
B. С аллостерическим центром.
C. С якорным участком активного центра.
D. С каталитическим участком активного центра
Задача 5. У гастроэнтерологического больного понижена кислотность желудочного сока, вследствие чего нарушено переваривание белков в желудке. Какое свойство ферментов, переваривающих белки (в частности, пепсина) проявляется в данном случае?
A. Зависимость активности ферментов от pН.
B. Специфичность ферментов.
C. Термолабильность ферментов.
D. Денатурация ферментов.
E. Влияние ингибиторов на активность ферментов.
Задача 6. При моделировании биохимического процесса смесь, содержащую субстрат реакции, буферный раствор и фермент, инкубировали при 80ºС в течение 30 минут. Качественная реакция на продукт отрицательна. Какое свойство ферментов привело к прекращению реакции?
A. Относительная специфичность.
B. Абсолютная специфичность.
C. Стереоспецифичность.
D. Зависимость от pН.
E. Денатурация ферментов.
Задача 7. Нормальные клетки способны превращать аспсрсгиновую кислоту в аспарагин. Некоторые лейкозные клетки лишены этой способности. Добавление аспарагиназы (фермента, расщепляющего аспарагин) в кровь больных лейкозом может привести к гибели раковых клеток. Какой вид специфичности проявляет этот фермент?
A. Относительную
B. Абсолютную
C. Стереоспецифичность
D. Пространственную
Е. Групповую
Задача 8. При изучении физико-химических свойств лактатдегидрогеназы (ЛДГ), выделенной из сердечной мышцы и из скелетных мышц, определили их различную электрофоретическую подвижность, различные рН оптимумы. При этом оба белка-фермента катализировали одну реакцию. Чем обусловлены различия в свойствах изоферментов?
A. Различиями в первичной структуре.
B. Различиями во вторичной структуре.
C. Различиями в третичной структуре.
D. Различиями в четвертичной структуре.
Задача 9. Распределение изоферментов лактатдегидрогеназы (ЛДГ) в различных органах неравномерно: в сердечной мышце преобладает ЛДГ1, в скелетных мышцах - ЛДГ5. В норме активность этих изоферментов в сыворотке крови низкая, при деструкции ткани активность соответствующих изоформ в крови резко возрастает, поэтому такие ферменты называются “индикаторными”. Как изменится активность в крови ЛДГ1 при инфаркте миокарда?
A. Увеличится значительно
B. Уменьшится незначительно
C. Не изменится
D. Увеличится незначительно
Е. Уменьшится значительно
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению целевых обучающих задач:
1 -А, 5 -А, 7 -В, 9 - А.
Этапы практического занятия отражены в технологической карте.