Участие газов в парниковом эффекте
АТМОСФЕРА
Состав атмосферы
Примерный состав атмосферы (без учета Н2О) приведен в табл.1. Дополнительно к N2 и О2 в атмосфере содержатся H2O, Ar, Xe, SO2, O3, NO2, CO2 и другие газы.
Таблица 1
Химический состав атмосферы Земли
| Газ | Объем, % | Газ | Объем, % |
| N2 | He | 5·10-4 | |
| O2 | CH4 | 2·10-4 | |
| Ar | 0,9 | NH3 | 1·10-4 |
| CO2 | 3·10-2 | Kr | 1·10-4 |
| Ne | 2·10-3 | N2O | 5·10-5 |
Одним из важных компонентов атмосферы является водяной пар. На экваторе его концентрация достигает 3%, а в Антарктиде падает до 3·10-5 %. Как и другие 3-х и более атомные молекулы H2O являются основным поглотителем теплового излучения земной поверхности и несет ответственность за «парниковый эффект» (ПЭ). Понижение температуры в атмосфере с высотой и наличие в ней вертикального градиента температуры связано с уменьшением по высоте концентрации воды в атмосфере.
Озоновый экран биосферы

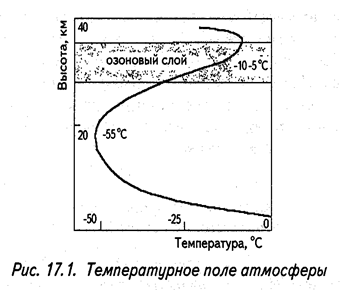 |
Повышение температуры с высотой (рис. 2) обусловлено наличием озонового слоя.
Рис. 2. Температурное поле атмосферы
В результате поглощения ультрафиолетового излучения выделяется тепловая энергия, нагревающая эти слои атмосферы. Максимальная температура от –10 до –5 ºС находится на высоте озонового слоя. Следует отметить, что количество солнечной радиации, поступающей в атмосферу, зависит от угла падения солнечных лучей на земную поверхность. Чем больше угол к 90º, тем сильнее идет нагрев поверхности Земли и тем больше в этом месте происходит нагрев атмосферы. Поэтому атмосфера разных участков земной поверхности нагрета по-разному. Эта неравномерность нагрева служит главной причиной циркуляции атмосферы.
Парниковый эффект
ПЭ - увеличение температуры приповерхностного слоя атмосферы за счет поглощения теплового излучения поверхности Земли молекулами газов, содержащих в своем составе три и более атомов. Он вызван присутствием в атмосфере следующих компонентов: H2O, CH4, NO2, фторхлоруглероды (ФХУ) и фторхлоруглеводороды (FСC); SO2, H2S и некоторые другие, относительный вклад которых в ПЭ (без учета H2O) представлен в табл. 2.
Таблица 2
Участие газов в парниковом эффекте
| Газы | Участие в парниковом эффекте, % |
| СO2 | |
| CH4 | |
| СFC | |
| NOх | |
| SO2 |
Из таблицы 2 видно, что основной вклад в парниковый эффект вносит СO2, значительная часть которого имеет антропогенное происхождение.
Парниковые свойства газов различаются по степени поглощения теплового излучения Земли и по нестабильности во времени. Так, например, молекулы СO2 относятся к наиболее сильным поглотителям теплового излучения, а молекулы CH4 в силу своей относительной устойчивости в атмосфере сохраняют парниковые свойства на протяжении десятков лет. Каждый из газов в атмосфере имеет характерное время жизни, в течение которого он или продукты его превращений могут вызвать ПЭ. По времени парникового воздействия газы можно расположить в следующий ряд:
СO2< NOх< СFC.
Смог
Большая часть химических превращений органических веществ в атмосфере протекает под воздействием солнечного излучения, при взаимодействии с высокоэнергетическими частицами или озоном в присутствии аэрозолей-катализаторов. Особенностью таких превращений является протекание их при атмосферных температуре и давлении.
Одним из продуктов фотохимических превращений органических соединений является смог (от англ. smoke – дым и fog - туман). Главный токсичный компонент смога – ПАН – пероксиацилнитрат:
O


CO3-C-O-O-NO2.
Образование ПАН из этана, озона и NO2, можно представить следующей последовательностью из 3-х реакций:
CH3-CH3+O3→ CH3-CHO+O2,
CH3-CHO+ O3→ CO3-C(O)-O-O˙ +HO˙,
CН3-C(O)-O-O˙+˙NO2→ CН3-C(O)-O-O-NO2.
ПАН тяжелее воздуха, обладает относительно высокой устойчивостью к разложению и поэтому накапливается вблизи земной поверхности. Опасность появления ПАН в нижних слоях атмосферы состоит в том, что по токсичности для человека он существенно превосходит соединения (C6H6, O3 и NO2), из которых может протекать его синтез.
Кислотные дожди
Кислотные дожди известны более ста лет. Однако проблема их возникла так остро в последние 20 лет. Источниками таких осадков служат газы, содержащие S и N ( SO2 , NOх , H2 S ). Возникают они вследствие неравномерного распределения этих газов в атмосфере и растворения в каплях воды.
SO2 + hg1→ SO2 *
SO2 * + O→ SO4 *
SO4 *+ O →SO3 +O3
SO3 + H2O → H2 SO4
2NO+O2 → 2NO2
NO2 + OH- → HNO3
Кислотные осадки могут оказывать прямое и косвенное воздействие, последнее более опасно, т.к. меняет рН поверхностных водоемов.
Цикл Чемпена
Верхние слои атмосферы защищает поверхность Земли от излучения, гибельных для всего живого. Главным барьером на пути высокоэнергетических излучений является озоновый экран. Однако не стоит считать, что озоновый экран состоит только из молекул О3. Общее содержание озона меняется в довольно широких пределах от 120 до 760 е.Д., где единица Добсона – количество молекул озона в атмосферном столбе с площадью основания 1 см2, равное 2,7·1016 молекул озона/см3. При высоте атмосферного столба, равной 35 км, что соответствует верхней границе озонового слоя, в 1 см3 атмосферного воздуха в среднем содержится от 9·1011 до 6·1012 молекул озона. Для сравнения в 1 см3 атмосферного воздуха содержится около 2,7·1019 молекул. Из этой оценки видно, что молекулы озона в атмосфере также редки, как золото среди речного песка. Количество озона в атмосфере подвержено циклическим изменениям. В северном полушарии Земли максимум содержания озона приходится на февраль-март, минимум – на сентябрь-октябрь.
Рассмотрим механизм образования озона (цикл Чемпена). Он состоит из четырех стадий.
1. Стадия зарождения частицы О˙
О2+hg1→2 О˙
Реакция протекает в сильно разряженной атмосфере на высоте около 250 км под действием жесткого ультрафиолетового излучения hg1=175-240нм.
2. Стадия образования возбужденной молекулы О3*
О˙+ О2→ О3*
Реакция протекает на высоте 25-35 км, где присутствует достаточное количество молекул О2.
3. Образующаяся молекула О3* обладает избытком энергии и поэтому нестабильна. Взаимодействуя с другими молекулами (например, N2), она стабилизируется:
О3*+ N2→ О3+ N2*→… N2+ hg3
и постепенно в результате последовательных соударений происходит диссипация (рассеивание) энергии hg3.
4. Защитная реакция озонового слоя
О3+ hg4 → О2+ О˙
На этой стадии происходит поглощение ультрафиолетового излучения, hg4=310 нм, губительного для белковых организмов. В результате существования цикла Чемпена жесткое ультрафиолетовое солнечное излучение не достигает поверхности Земли.
К числу наиболее опасных ЗВ, разрушающих озоновый слой, относят фторхлоруглероды (ХФУ) и фторхлоруглеводороды (CFC-фреоны), а также оксиды азота. До недавнего времени промышленность в большом количестве вырабатывала фреоны: CFCl3 (фтортрихлорметан - фреон F-11) и CF2Cl2 (дифтордихлорметан – фреон F-12), которые используются в качестве хладоагентов, химических средств защиты растений, рабочих жидкостей для дезодорантов, лаков и красок. Попадая в атмосферу, под действием солнечного излучения молекула F-11 разлагается на два радикала CFCl2˙иCl˙, которые, взаимодействуя с озоном, разрушают его:
CFCl3+ hg5→ CFCl2˙ + Cl˙
О3+ Cl˙→ + ClО˙
Аналогичное разрушающее действие на озоновый слой оказывают оксиды азота NO и NO2.
NO+ О3→ NO2+ О2
В результате частичного разрушения «озонового щита» образуются «озоновые дыры», через которые на поверхность Земли поступают увеличенные дозы УФ-излучения, опасного для человека и других живых организмов. В настоящее время имеется ряд международных документов, регламентирующих производство и распространение озоноразрушающих и озонопоглощающих веществ. Кроме того, сегодня ХФУ заменяют безопасными веществами (например, галогенами, один атом которых замещен на водород, или гидрофторуглеродами, которые быстро разрушаются в тропосфере, не добираясь до «озонового экрана»).