Часткове окиснення етанолу
Лабораторна робота №1
Тема:Хімічні властивості розведеної сульфатної кислоти
Мета:Закріпити та узагальнити знання про хімічні властивості сульфатної кислоти
Обладнання та матеріали:розчини сульфатної кислоти (1:5), гідроксидів натрію та кальцію, сульфату натрію, нітрату натрію, карбонату натрію, фосфату натрію, сульфіту натрію, хлориду натрію, хлориду барію, гідрокарбонату натрію, сульфату купруму (ІІ), фенолфталеїну, метилового оранжевого, лакмусу. Шматочки цинку, заліза, міді, порошкоподібні оксид міді(ІІ) і оксид заліза (ІІІ). Пробірки, газовідвідна трубка.
Теоретичні основи
Розбавлена сульфатна кислота виявляє всі властивості характерні для кислот.
1. Дисоціація кислот.
2. Взаємодія з основами.
3. Взаємодія з оксидами металів.
4. Взаємодія з солями.
5. Взаємодія з металами.
Порядок виконання роботи
Дослід 1. Дія кислоти на індикатори.
Випробуйте дію розведеної сульфатної кислоти на розчини індикаторів лакмусу і метилового оранжевого. Що спостерігаєте? Зробіть висновок.
Будьте обережні із сульфатною кислотою, бо вона руйнує шкіру, тканини і спричиняє опіки.
Дослід 2. Взаємодія кислоти з металами.
У три пробірки з розведеною сульфатною кислотою покладіть по шматочку цинку, заліза та міді. Що відбувається у кожній з пробірок? Зробіть висновок і запишіть відповідні рівняння реакцій у молекулярній та іонних формах. Зазначте, що окиснюється і що відновлюється.
Дослід 3. Взаємодія кислоти з основними оксидами.
У дві пробірки налийте розведеної сульфатної кислоти і додайте в одну з них трохи порошкоподібного оксиду купруму (ІІ), у другу – порошкоподібного оксиду заліза (ІІІ). Підігрійте пробірки. Що спостерігаєте? Запишіть рівняння реакцій у молекулярному та іонному виглядах. Зробіть висновок про дію сульфатної кислоти на основні оксиди.
Дослід 4.Взаємодія кислоти з основами.
а) У пробірку з лугом добавте 2-3 краплі фенолфталеїну. Потім у цю ж пробірку долийте розчину сульфатної кислоти до зміни забарвлення індикатору. Зробіть висновки із спостережень, напишіть рівняння реакцій у молекулярній та іонній формах.
б) Добудьте нерозчинний гідроксид взаємодією розчинної солі купруму з лугом. До осаду гідроксиду купруму (ІІ) долийте розчин сульфатної кислоти. Які ознаки реакції? Напишіть рівняння реакцій у молекулярній та іонній формах. Зробіть висновок про взаємодію розведеної сульфатної кислоти з розчинними та нерозчинними основами й про умови проведення зазначених реакцій.
Дослід 5. Взаємодія кислоти з солями.
До концентрованого розчину гідрокарбонату натрію долийте розчин сульфатної кислоти, закрийте пробірку пробкою з газовідвідною трубкою, кінець якої опустіть у пробірку з вапняною водою. Що відбувається з вапняною водою? Напишіть рівняння реакцій у молекулярній та іонній формах.
Дослід 6.Якісна реакція на сульфати.
Налийте у пробірки по 1мл розчинів таких солей: сульфату натрію, нітрату натрію, карбонату натрію, фосфату, натрію, сульфіту натрію, хлориду натрію. Добавте в кожну пробірку по краплині розчинної солі барію (хлориду або нітрату). Що спостерігаєте? Долийте у пробірки розчину нітратної або хлоридною кислот. Що спостерігаєте в кожній з пробірок? Запишіть рівняння відповідних реакцій у молекулярній та іонній формах. Зробіть висновки про властивості сульфатної кислоти , спільні з іншими кислотами, та про відмінність її та сульфатів від інших кислот та їх солей.
Лабораторна робота №2
Тема:Добування аміаку та досліди з ним.
Мета:закріпити та узагальнити знання про лабораторний метод добування аміаку та його основні хімічні властивості.
Обладнання та матеріали:розчин хлоридною, сульфатної, нітратної кислот, метилового оранжевого, лакмусу, фенолфталеїну, тверді хлорид амонію, натронне або гашене вапно, концентровані хлорид на та нітратна кислоти, пробірки (одна суха), газовідвідна трубка, кристалізатор з водою, ступка з товкачиком, штатив металевий з лапкою, скляна паличка, піпетка, скляна пластинка.
Теоретичні основи
Молекула аміаку NH3 являє собою диполь: спільні електронні пари дуже зміщені до атома Нітрогену (Чому?).
Аміак – безбарвний газ з різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (при 20ºС в 1 об’ємі води – 700 об’ємів NH3, при температурі нижчій за
-33,4 ºС переходить у рідкий стан. Дуже уражує слизові оболонки очей і дихальних шляхів.
Для аміаку характерні реакції окиснення (горіння в кисні) і приєднання (взаємодія з водою та кислотами).
У лабораторії аміак добувають із суміші твердих речовин – нашатирю NH4Cl і гашеного вапна Ca(OH)2.
Порядок виконання роботи
Дослід 1. Добування аміаку.
Для добування аміаку візьміть суміш приблизно рівних об’ємів (по половині чайної ложки) дрібнокристалічного хлориду амонію і натронного NaOH × Ca(OH)2 або гашеного Ca(OH)2 вапна. Розмішайте суміш у ступці або на аркуші паперу. Обережно понюхайте суміш! Напишіть рівняння реакції.
Дослід 2. Збирання аміаку та розчинення його у воді.
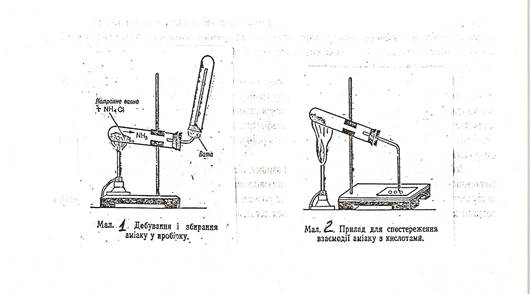
Добуту суміш насипте у пробірку, яку закріплено похило, отвором донизу, і закрийте пробкою з газовідвідною трубкою, зігнутою під прямим кутом, кінець якої розміщений отвором догори (див. мал.1).На кінець газовідвідної трубки надіньте догори дном суху пробірку і закрийте її отвір жмутком вати.
Обережно нагрійте спочатку всю пробірку, а потім нагрівайте в тому місці, де міститься суміш. Як тільки пробірка , надіта на газовідвідну трубку, заповниться аміаком (його запах відчуватиметься у повітрі біля приладу) нагрівання припиніть. Пробірку, в яку збирали аміак, закрийте пальцем і опустіть у кристалізатор з водою так, щоб під водою було зручно відкрити пробірку. Що спостерігається при цьому? Запишіть рівняння реакції у молекулярному, повному та скороченому йонному виглядах.
Зверніть увагу на швидкість розчинення аміаку. Незважаючи на те, що, як вам відомо, розчинність аміаку у воді значно більша, ніж хлороводню, заповнення пробірки водою відбувається повільніше. Чому? (Пригадайте, що розчин аміаку порівняно з розчином хлороводню легший за воду). Вбирання аміаку прискорюється легким струшуванням пробірки.
Дослід 3. Дія розчину аміаку на індикатори.
Під водою закрийте пальцем пробірку і вийміть її з води. Вміст пробірки розділіть на три частини. Випробуйте одну частину лакмусом, другу – фенолфталеїном, третю – метиловим оранжевим. Що спостерігається? Поясніть спостереження.
Дослід 4. Взаємодія аміаку з концентрованими кислотами.
Зберіть такий самий прилад для добування газів, який описано в дослідах 1 і 2 та наповніть його на 1/3 місткості пробірки тією ж сумішшю? Хлориду амонію та натронним або гашеним вапном.
Чистою скляною паличкою або піпеткою нанесіть на скляну пластинку по одній краплі концентрованих хлоридною та нітратної кислот. Після кожної кислоти паличку ретельно промийте водою.
Нагрійте суміш у пробірці і переміщуйте пластинку так, щоб краплі одна за одною були підведені до отвору газовідвідної трубки (див. мал.2). що являють собою білі тверді речовини, які утворюються на скляній пластинці на місці крапель? Напишіть рівняння реакцій. Чим пояснити появу білого диму над краплями хлоридною та нітратної кислот?
Дослід 5. Взаємодія аміаку з розчинами кислот.
У пробірки налийте по 1-2 мл розчинів кислот: хлоридною, сульфатної, нітратної та помістіть в них по краплі розчину метилового оранжевого. У кожну пробірку послідовно опустіть газовідвідну трубку з приладу для добування аміаку, але так, щоб вона не занурилась у розчин кислоти, а була на 0,5см вище над рідиною. Продовжіть нагрівання суміші хлориду амонію і гашеного вапна. Які зміни відбуваються з індикатором? Чим це можна пояснити? Напишіть рівняння відповідних реакцій.
Запитання до захисту
1. Чому пробірку з сумішшю треба закріплювати в лапці штатива похило у бік отвору?
2. Чому для добування аміаку беруть сухі речовини, а не їх розчини?
3. Чому аміак збирають у пробірку, перевернуту догори дном?
4. Про які властивості водного розчину аміаку свідчить його дія на індикатори?
5. Як це можна пояснити на підставі уявлень про електролітичну дисоціацію?
Лабораторна робота №3
Тема:Добування оксиду карбону (IV) і вивчення його властивостей. Розпізнавання карбонатів.
Мета:закріпити та узагальнити знання на основі дослідів про лабораторний метод добування оксиду карбону (IV) та основні його хімічні властивості; навчитися на практиці використовувати якісну реакцію на карбонати.
Обладнання та матеріали:розчини нітратної та хлоридною кислот (1: 2), гідроксидів кальцію та натрію, лакмусу, метилового оранжевого та фенолфталеїну, карбонату натрію, хлориду барію, нітрату аргентум. Тверді карбонати натрію, калію, кальцію та магнію; сульфат , хлорид та силікат натрію; вапняк, мармур або крейда, скіпки, тигельні щипці, , пальник, пробірки, газовідвідні трубки.
Теоретичні основи
Оксид карбону (IV) має склад CO2 , молекула його лінійна C = O = C
В лабораторних умовах вуглекислий газ добувають дією розбавленої (1:3) хлоридною кислоти на мармур, вапняк або крейду: CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
В промисловості вуглекислий газ добувають як побічний продукт при прокалюванні вапняку: CaCO3 = CaО + CO2↑
Оксид карбону (IV) – газ без кольору та запаху, кислуватий на смак. 1л його важить 44/22,4 = 1,977г, він важче за повітря в 1,507 раз. Оксид карбону (IV) можна збирати у відкритому посуді і переливати як рідину з однієї посудини в іншу.
Молекули його неполярні, тому він має низькі температури кипіння та плавлення і невелику розчинність у воді. При атмосферному тиску вуглекислий газ кипить при -78ºС. Під тиском 60атм за звичайної температури оксид карбону (IV) переходить в рідину, яку зберігають в стальних балонах під таким же тиском.
Оксид карбону (IV) не горить і не підтримує горіння звичайних горючих речовин, тому його застосовують для гасіння пожеж.
Оксид карбону (IV)має загальні хімічні властивості кислотних оксидів: взаємодія з водою з утворенням слабкої карбонатної кислоти: CO2 + H2O ↔ H2CO3; взаємодія з лугами з утворенням карбонатів Ca(OH)2 + CO2 = CaCO3 + H2O; а при пропусканні надлишку вуглекислого газу з утворенням гідрокарбонатів: CaCO3 + CO2 + H2O = СаН(CO3)2.
Вуглекислий газ застосовують для газування води та напоїв, в рідкому вигляді – у вогнегасниках та пожежних машинах. Пресований твердий оксид карбону (IV) під назвою «сухий лід» використовується в якості охолоджувача. Переваги сухого льоду над звичайним полягають в тому, що він підтримує в оточуючому середовищі значно нижчу температуру і випаровується, не переходячи в рідкий стан.
Кількість вуглекислого газу складає 0,03% за об’ємом. Повітря, що видихається людиною, вміщує до 4% CO2, тому в приміщеннях, де знаходиться багато людей, кількість вуглекислого газу збільшується. Перебування на повітрі, в якому міститься 10% вуглекислого газу, швидко призводить до втрати свідомості та смерті.
Порядок виконання роботи
Дослід 1. Добування оксиду карбону (IV).
Складіть прилад для добування газів (мал.1 б ) і випробуйте його на герметичність. Замість колби можна взяти велику пробірку (мал1 а). Покладіть у неї кілька шматочків вапняку, мармуру або крейди. Прилийте розчину хлоридною кислоти. Швидко закрийте реагуючі речовини газовідвідною трубкою, кінець якої опустіть у порожній стакан або велику пробірку. Час від часу запаленою скіпкою перевіряйте рівень заповнення посудини вуглекислим газом. Коли посудина наповниться ним, спробуйте його перелити в іншу таку ж посудину так, як переливають воду. За допомогою запаленої скіпки перевірте, чи вдалася вам ця спроба.
Дослід 2. Взаємодія оксиду карбону (IV) з водою.
Наступну порцію вуглекислого газу пропустіть у велику пробірку, що на третину заповнена холодною водою, періодично збовтуючи її. Добутий розчин розлийте на дві порції. До кожної з них долийте розчину лакмусу або метилового оранжевого, а потім до першої – вапняної води, а другу порцію злегка підігрійте. Опишіть і поясніть спостереження. Складіть рівняння відповідних реакцій у повній та скороченій іонних формах.
Дослід 3.Взаємодія оксиду карбону (IV) з лугами.
Продовжіть пропускання вуглекислого газу, але вже крізь розчин вапняної води. Чому спочатку з’являється каламуть, а потім відбувається розчинення зависі? Аналогічно пропустіть оксид карбону (IV) крізь розведений розчин гідроксиду натрію, до якого добавлено кілька крапель фенолфталеїну. Що спостерігаєте? Напишіть рівняння реакцій у молекулярній, повній та скороченій іонних формах.
Дослід 4. Якісна реакція на карбонати.
Дослідіть дію розчину хлоридною кислоти на карбонати натрію, калію, кальцію, магнію. Для цього на дно пробірки насипте потроху солей і прилийте краплями кислоту. Після характерного «скипання» опустіть у пробірку запалену тонку скіпку. Повторіть дослід, але замість хлоридною кислоти візьміть нітратну. Поясніть спостереження, зробіть висновок про відношення карбонатів до дії кислот. Напишіть рівняння відповідних реакцій у молекулярній, повній і скороченій іонних формах.
Дослід 5.Розклад карбонатів.
Візьміть шматочок крейди і розламайте його так, щоб один з уламків був плоский із гострими кутами. Другий уламок опустіть у пробірку з водою, в яку добавте краплю фенолфталеїну. Чи змінився його колір?
Плоский уламок затисніть тигельними щипцями і прожарте його в полум’ї протягом 7-8 хвилин. Після охолодження опустіть уламок в пробірку з водою і добавте кілька крапель фенолфталеїну. Чи змінився його колір? Поясніть спостереження. Напишіть рівняння відповідних реакцій.
Лабораторна робота №4
Тема:Виявлення Карбону, Гідрогену та Хлору в органічних речовинах.
Мета:На практиці навчитися виявляти основні складові елементи органічних сполук за допомогою розробленої методики.
Обладнання та матеріали:парафін – 0,5г, порошок оксиду купруму (ІІ) – 1-2г, вапняна вода – 2-3мл, безводний сульфат купруму (ІІ) – 2г, пробірка з газовідвідною трубкою, пробірка для вапняної води, нагрівальний прилад, штатив, хлоровмісна органічна сполука (хлороформ, дихлоретан – 1мл), мідний дріт товщиною 1-2мм.
Теоретичні основи
Хлороформ – безбарвна рідина з характерним запахом; tкип = 61,15 ºС.
Дихлоретан – безбарвна рідина з сильним запахом; tкип = 83,5 ºС.
Парафін – суміш твердих високомолекулярних насичених вуглеводнів білого або жовтого кольору; tпл = 50 - 55 ºС.
Порядок виконання роботи
Дослід 1. Визначення Карбону та Гідрогену.
Збирання приладів. Дослід можна проводити у приладі для збирання газів (мал1а) або у спеціальному приладі для визначення Карбону та Гідрогену (мал1б).
Суміш досліджуваної речовини з оксидом купруму (ІІ) помістіть у суху пробірку (мал1а) і закріпіть її у штативі у горизонтальному положенні. Обережно внесіть безводний сульфат купруму (ІІ) і закрийте пробірку пробкою з газовідвідною трубкою, кінець якої опустіть в пробірку з вапняною водою.
Обережно нагрівайте пробірку з досліджуваною речовиною. Спостерігайте зміни, що відбуваються з оксидом купруму (ІІ), сульфатом купруму (ІІ), вапняною водою, після цього дослід припиніть.
З метою уникнення розтріскування пробірки слідкуйте, щоб після припинення нагрівання рідина не перекидалася по трубці у прилад.
Яку роль відіграє у даному досліді оксид купруму (ІІ)? З якою метою використовується вапняна вода? Напишіть рівняння реакцій, що відбуваються.
Дослід 2. Виявлення хлору.
Кінець мідного дроту зігніть петелькою або у вигляді спіралі діаметром 1-2мм. Прожарюйте дротину у полум’ї до тих пір , поки полум’я не перестане забарвлюватись, охолодіть її. Внесіть дротину в речовину, що досліджується, і знову в полум’я(мал2). Зелене забарвлення полум’я свідчить про наявність хлору у сполуці, виданій для аналізу.
Легкозаймисті органічні сполуки тримайте далі від вогню!
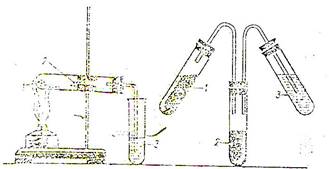

| Мал.1 Виявлення Карбону та Гідрогену в органічній сполуці. 1 – Суміш речовини, що досліджується з оксидом купруму (ІІ); 2 – безводний сульфат купруму (ІІ); 3 – вапняна вода | Мал 2.Виявлення галогену в органічній сполуці (проба Бейльштейна) |
Лабораторна робота №5
Тема:Добування та хімічні властивості ненасичених вуглеводнів.
Мета: Добути етилен та ацетилен в лабораторії та вивчити їх властивості.
Обладнання та матеріали:штатив з пробірками, стакан з водою, штатив фізичний, сірники, нагрівальний прилад, пробка з газовідвідною трубкою, вата, карбід кальцію, розчин перманганату калію, йодна або бромна вода, етанол, концентрована сульфатна кислота, подрібнене скло.
Теоретичні основи
В лабораторії етилен добувають нагріванням етанолу при температурі більше 140 ºС в присутності концентрованої сульфатної кислоти як водовідбираючого засобу, а ацетилен – при взаємодії карбіду кальцію з водою. Етилен та ацетилен є ненасиченими сполуками і вміщують в своїй будові подвійний і потрійний зв’язки відповідно. Завдяки наявності негібридних π – зв’язків дані речовини легко вступають в реакції приєднання та часткового окиснення взагалі і, як приклад, з бромною водою та перманганатом калію безпосередньо, що є якісними реакціями на ненасичені сполуки. Також дані речовини легко піддаються повному окисненню, тобто горінню. Етилен горить жовтим полум’ям, а ацетилен – жовтим кіптявим через великий процентний вміст карбону в сполуці.
Порядок виконання роботи
Дослід 1. Добування і властивості етилену.
Збирання приладів. Дослід можна проводити у приладі для добування газів (мал1а з лабораторної роботи № 2).
Приготуйте дві пробірки: одну з розчином перманганату калію, другу – з розчином йодної води. В пробірку – реактор внесіть 6-8 краплин заздалегідь приготовленої суміші етанолу та концентрованої сульфатної кислоти і насипте на дно подрібнене скло для рівномірного кипіння. Закрийте пробірку пробкою з газовідвідною трубкою і закріпіть в штативі за допомогою зажиму. Підігрійте суміш (обережно!) і пропустіть газ, що виділяється, у пробірки з перманганатом калію і йодною водою по черзі. Що спостерігаєте? Після характерних змін підніміть газовідвідну трубку догори і підпаліть газ, що виділяється. Якого кольору полум’я спостерігаєте? Після цього дослід припиніть.
З метою уникнення розтріскування пробірки слідкуйте, щоб після припинення нагрівання рідина не перекидалася по трубці у прилад.
Запишіть відповідні рівняння реакцій, спостереження та зробіть висновки
Дослід 2. Добування і властивості ацетилену.
Збирання приладів. Дослід можна проводити у приладі для добування газів (мал1а з лабораторної роботи № 2).
Приготуйте дві пробірки: одну з розчином перманганату калію, другу – з розчином йодної води. В пробірку з газовідвідною трубкою налийте 1-2мл води, опустіть невеликий шматочок карбіду кальцію, вставте нещільний жмуток вати і швидко закрийте пробірку пробкою з газовідвідною трубкою. Пропустіть газ, що виділяється у пробірки з перманганатом калію та йодною водою по черзі. Що спостерігаєте? Після характерних змін підніміть газовідвідну трубку догори і підпаліть газ, що виділяється. Якого кольору полум’я спостерігаєте? Після цього дослід припиніть. Запишіть відповідні рівняння реакцій, спостереження та зробіть висновки
Лабораторна робота №6
Тема:Хімічні властивості спиртів та фенолу.
Мета: вивчити хімічні властивості спиртів та фенолу; зробити висновок про шкідливий вплив алкоголю на організм людини; звернути увагу на охорону оточуючого середовища.
Обладнання та матеріали:штатив з пробірками, тигельні щипці, етанол, гліцерин, фенол, дихромат калію, концентрований розчин сульфатної кислоти, мідна дротина, вата, гідроксид натрію, сульфат купруму(ІІ), хлорид феруму (ІІІ), розчин яєчного білка.
Теоретичні основи
Спирти і феноли – це органічні речовини, що містять Оксисен, молекула яких має вуглеводневий радикал, з’єднаний з однією або кількома гідроксильними групами. В залежності від кількості гідроксильних груп є одно-, двох- та багатоатомні спирти. Феноли – це ароматичні спирти, одна або декілька гідроксильних груп яких з’єднана з відповідним радикалом – похідним бензолу.
Типовим представником одноатомних спиртів є етанол – спирт, що має характерний запах, змішується з водою в будь-яких співвідношеннях. Гідроксильний гідроген в молекулі етанолу легко заміщується на натрій, утворюючи етилат натрію, але тільки при взаємодії з чистим металом, а не з гідроксидом. Чим більше таких атомів гідрогену, тим вони більш рухомі. Тобто багатоатомні спирти є більш хімічно активними речовинами, ніж одноатомні. Хімічна активність спиртів зменшується зі збільшенням їх молекулярної маси.
Фенол має в своєму складі бензольне кільце, і через взаємний вплив гідроксильної групи та бензольного кільця виявляє ряд специфічних властивостей:
1. Виявляє слабкі кислотні властивості, тому може взаємодіяти не тільки з лужними металами, подібно до одноатомних та багатоатомних спиртів, але й з їхніми гідроксидами з утворенням фенолятів.
2. Хромується легше, ніж бензол.
3. Якісним реактивом на фенол є хлорид феруму (ІІІ) та бромна вода.
Порядок виконання роботи
Дослід 1.Окиснення етанолу.
Часткове окиснення етанолу.