Гипофункция паращитовидных желез (гипопаратиреоидизм)
Причины возникновения гипопаратиреоидизма – ошибочное удаление паращитовидных желез при операции на щитовидной железе или аутоиммунные процессы. Основные симптомы:
– гипокальциемия;
– повышение нейромышечной возбудимости, приводящее к развитию приступов тетании, которая проявляется судорожными сокращениями скелетных и гладких мышц. Особенно опасен для больных спазм мышц гортани, приводящий к асфиксии.
БИЛЕТ
1)Гормоны передней доли гипофиза, строение, механизм действия.
Гипофизарные гормоны представляют собой группу белково-пептидных гормонов. В передней доле гипофиза вырабатываются адренокортикотропный гормон (АКТГ), тиреотропный гормон (ТТГ), лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), пролактин (ПРЛ) и соматотропный гормон (СТГ) или гормон роста.
Очень быстро исчезают из крови, так как не имеют специфических белков-переносчиков. Период их полураспада несколько минут. Инактивация происходит в печени под действием специфических пептидаз.
Соматотропный гормон(гормон роста) наиболее важный гормон для достижения нормального роста. СТГ вырабатывается в передней доле гипофиза и представляет собой белок, состоящий из 191 аминокислотного остатка. Характерна видовая специфичность гормона.
Секреция гормона роста возрастает во сне, при физических упражнениях, стрессе и гипогликемии, стимулируется соматолиберином. Соматостатин и соматомедины ингибируют секрецию гормона. Гормон роста также ингибирует свою секрецию через стимуляцию высвобождения соматостатина из гипоталамуса.
Действие гормона роста.
1.Прямое действие гормона роста:
а) вызывает гипергликемию, активируя глюконеогенез в печени и снижая утилизацию глюкозы внепеченочными тканями (диабетогенный эффект);
б) активирует липолиз в жировой ткани;
в) стимулирует синтез белков в мышцах;
г) в печени вызывает образование соматомединов С и А (инсулиноподобных факторов роста I и II), которые обуславливают некоторые биологические эффекты гормона.
2. Действие гормона роста через соматомедины (непрямое действие).
а) повышают синтез белков в хондроцитах и увеличивают рост тела в длину;
б) стимулируют синтез белков в мышцах и большинстве внутренних органов, что приводит к увеличению их размеров.
Инсулиноподобные факторы роста (ИФР) I и II – это белки, содержащие 70 и 67 аминокислотных остатков. В то время как гормон роста обладает прямым антиинсулиновым действием, многие эффекты ИФР-Iподобны инсулину, т.к. ИФР-I по аминокислотному составу гомологиченпроинсулину.
ИФР-I через связывание со специфическими рецепторами увеличивает транспорт глюкозы в клетки, скорость гликолиза и синтеза гликогена в мышечной ткани. В противоположность прямому действию гормона роста ИФР-I стимулирует липогенез и ингибирует липолиз в жировой ткани. ИФР-II действует только внутриутробно и на первом году жизни, сохраняя влияние в последующем онтогенезе лишь в отношении роста зубов.
Недостаток гормона роста в организме приводит к задержке роста скелета, органов и тканей (гипофизарная карликовость). Рост больных не превышает 130 см, телосложение – пропорциональное, умственное развитие нормальное. Синдром Ларона, - генетически обусловленная нечувствительность клеток к гормону роста. Это связано с наследственным дефектом рецепторов к гормону роста, что делает невозможным синтез ИФР-I.
Избыток гормона роста в детском возрасте приводит к развитию гигантизма (рост более 200 см), а у взрослых к развитию акромегалии. У больных акромегалией отмечается увеличение надбровных дуг, скуловых костей, верхней и нижней челюстей, носа, ушных раковин, языка, кистей и стоп.
Тиреотропный гормон, лютеинизирующий гормон и фолликулостимулирующий гормоны являются членами одного семейства гликопротеинов, каждый из которых имеет α и β-субъединицы. В то время как их α-субъединицы идентичны, β-субъединицы ответственны за уникальную активность каждого гормона. ТТГ – основной регулятор развития и функционирования щитовидной железы, процессов синтеза и секреции тиреоидных гормонов. Избыточная секреция ТТГ приводит к развитию вторичного гипертиреоза, а недостаток ТТГ – вторичного гипотиреоза.
ФСГ способствует созреванию фолликулов в яичниках и стимулирует сперматогенез. ЛГ вызывает у женских особей разрыв фолликула с образованием желтого тела и стимулирует секрецию эстрогенов и прогестерона. У мужских особей ЛГ стимулирует секрецию тестостерона. Избыток ФСГ и ЛГ обуславливает преждевременное половое созревание, а недостаток – вторичную гипофункцию половых желез и бесплодие.
Изолированное повышение или понижение секреции какого-либо гормона гипофиза явление довольно редкое. Более часто встречается сочетанный избыток либо недостаток этих гормонов, что получило название гиперпитуитаризм или гипопитуитаризм.
АКТГ, меланоцитстимулирующий гормон, β-липотропин и β-эндорфин происходят из одного белкового предшественника проопиомеланокортина. АКТГ – полипептид, состоящий из 39 аминокислотных остатков, который синтезируется в передней доле гипофиза Физиологический эффект полностью обеспечивается отрезком с 1 по 24 аминокислотные остатки. АКТГ стимулирует синтез стероидов в коре надпочечников, усиливая превращение холестерина в прегненолон. Стимулами секреции АКТГ являются кортиколиберин, стресс, снижение в сыворотке крови уровня кортизола. Ингибируют высвобождение АКТГ – кортизол и опиоиды, а также синтетическиеглюкокортикоиды, например, преднизолон. Секреция АКТГ идет неравномерно: с максимумом в ранние утренние часы и минимумом в середине ночи (суточный ритм). Этот ритм повторяет секреция кортизола корой надпочечников. Период полужизни АКТГ в плазме крови не превышает 15 минут. Ключевым моментом в действии гормона является активация аденилатциклазного механизма. АКТГ обладает незначительной меланоцитстимулирующей активностью, активирует липолиз в жировой ткани, оказывает трофическое действие на кору надпочечников. Присущая АКТГ меланоцитстимулирующая активность при выраженном избытке гормона является причиной развития гиперпигментации кожи. Избыток секреции АКТГ приводит к развитию болезни Иценко-Кушинга, а недостаток его секреции – к вторичной недостаточности коры надпочечников.
β-липотропин содержит 93 аминокислотных остатка в виде одной полипептидной цепи. Главная его функция заключается в том, что он является предшественником природных опиатов эндорфинов. Кроме того, β-липотропин обладает липолитической активностью, однако этот эффект намного менее выражен, чем у других липолитических гормонов.
Эндорфины(эндогенные морфины) – группа пептидов, которые в ЦНС выполняют роль нейромедиаторов. Эндорфины присутствуют в сенсорных нейронах, воспринимающих чувство боли, и в нейронах, регулирующих эмоции. Они связываются с опиоидными рецепторами и обладают мощной анальгетической активностью.
Пролактин или лактотропный гормон – образуется в передней доле гипофиза и состоит из 198 аминокислотных остатков. Секреция пролактина ингибируется пролактостатином гипоталамуса. Известными физиологическими стимулами секреции пролактина являются сон, физическая нагрузка, стресс, гипогликемия, раздражение сосков молочных желез, половой акт и эстрогены. Пролактин участвует в развитии молочных желез, инициации и поддержании лактации. Секреция пролактина при грудном вскармливании ингибирует функции яичников, что обьясняет отсутствие овуляции и инфертильность в этот период. Пролактин активно влияет на гормональную и сперматогенную функции семенников. В физиологических условиях пролактин стимулирует синтез тестостерона. Однако длительно существуюшаягиперпролактинемия, например, при пролактиноме, нарушает образование тестостерона в яичках. Главными симптомами гиперпролактинемии у женщин являются аменорея и галакторея, а у мужчин – импотенция.
2)Глюкагон, всё про него.
Глюкагон – гормон альфа-клеток островков Лангерганса. Пептид, состоящий из 29 аминокислотных остатков. Синтезируется в виде проглюкагона. Регуляция синтеза: 1)ингибируется – повышенным уровнем глюкозы, 2) стимулируется низким уровнем глюкозы, аминокислотами и адреналином, поэтому его концентрация возрастает после приема пищи, богатой белками и при голодании. В крови не имеет специального транспортного белка, период полужизни 5-10 минут. Механизм: по аденилатциклазному, связываясь с рецепторами (печень, жировая ткань и миокард).
Метаболические эффекты: активация аденилатциклазы и повышение концентрации цАМФ обуславливают усиление распада гликогена в печени. В отличие от адреналина, глюкагон не влияет на гликогенолиз в скелетных мышцах. Высокий уровень цАМФ обуславливает активацию транскрипции гена фосфоенолпируват-карбоксикиназы – ключевого фермента глюконеогенеза. Накопление цАМФ приводит к активации фруктозо-1,6-бисфосфотазы – второго ключевого фермента глюконеогенеза. В печени угнетает синтез белков и облегчает их катаболизм.Высвобождающиеся АК используются в реакциях глюконеогенеза. Центральный эффект – гипергликемия – обеспечивается 2 механизмами: 1)быстрый – распад гликогена, 2)медленный – стимуляция глюконеогенеза. Глюкагон – мощный липолитический агент за счет активации гормоночувствительной липазы жировой ткани. Высвобождающиеся ЖК используются как источник энергии для скелетных мышц и миокарда. Он является мощным стимулятором синтеза кетоновых тел в печени.
БИЛЕТ
Все про адреналин
Синтез и секреция
Последовательность синтеза катехоламинов включает в себя 4 ферментативные реакции: 1) гидроксилирования кольца; 2) декарбоксилирования; 3) гидроксилирования боковой цепи и 4) N-метилирования.
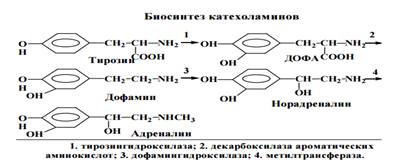
Ферменты реакций синтеза катехоламинов:
1. Тирозингидроксилаза (кофермент – тетрагидробиоптеридин); 2. Декарбоксилаза ароматических аминокислот (кофермент витамин В6); 3. Дофамингидроксилаза (для реакции в качестве кофактора необходима аскорбиновая кислота); 4. N-метилтрансфераза (донором метильных групп является S-аденозилметионин). Синтез этого фермента активируется глюкокортикоидами.
Катехоламины подавляют свой собственный синтез по принципу обратной отрицательной связи, ингибируя активность тирозингидроксилазы.
Конечные продукты превращения тирозина в тканях различны: в мозговом слое надпочечников процесс протекает в основном до адреналина, в окончаниях симпатических нервов – до норадреналина, в некоторых нейронах ЦНС синтез завершается образованием дофамина. На долю адреналина приходится 80% всех катехоламинов мозгового слоя надпочечников.
Адреналин секретируется мозговым слоем надпочечников в ответ на гипогликемию и стрессорные стимулы (страх, сильное волнение, кровотечение и др.). При этом функционирует парагипофизарный путь регуляции секреции гормона в кровь.
Транспорт
В плазме крови катехоламины циркулируют в слабоассоциированном с альбумином виде и только 5-10% в свободном виде. Период их полужизни крайне мал – 10-30 сек.
Инактивация
Большая часть катехоламинов (около 90%) инактивируется путем активного обратного захвата в депо-гранулы (нейрональная инактивация). Остальные 10% подвергаются инактивации в эффекторных клетках и в печени под действием ферментов – моноаминооксидазы (МАО, катализирует реакцию дезаминирования) и катехол-О-метилтрансферазы (КОМТ, катализирует реакцию метилирования по 3-ОН-группе)– с образованием множества неактивных продуктов, удаляемых с мочой. Основным продуктом инактивации является 3-метокси-4-гидроксиминдальная кислота, называемая также ванилилминдальной кислотой. По ее содержанию в моче судят о секреции адреналина в кровь.
Механизм действия
Катехоламины действуют через 2 класса адренорецепторов – α и β. Каждый из них в свою очередь подразделяется на подклассы: α1 и α2; β1, β2 и β3. Адреналин связывается и активирует как α-адренорецепторы, так и β-адренорецепторы. Катехоламины, которые связываются с β-адренорецепторами ак-тивируют аденилатциклазу, в то время как связывание их с α2-рецепторами ингибирует аденилатциклазу. Связывание с α1-адренорецепторами активирует фосфолипазу С и запускает Са2+/фосфатидилинозитоловый механизм.
В ЦНС, почках и мезентериальных сосудах имеются дофаминовые рецепторы, ответственные за вазодилатацию. Биологическая реакция каждого органа зависит от типа присутствующих на его клетках адренорецепторов.
Биологические эффекты
Главным местом метаболического действия катехоламинов являются печень, мышечная и жировая ткани. Эффекты:
1. Стимуляция распада гликогена до глюкозы (гликогенолиза) в печени (посредством активации α1 и β2-адренорецепторов) и мышцах (через β2-рецепторы). В быстросокращающихся скелетных мышцах глюкоза метаболизируется до лактата. В тоже время глюкоза, образуемая в печени, поступает в кровоток. Это приводит к повышению уровня глюкозы и лактата в плазме крови.
2.Активация глюконеогенеза (через β2-рецепторы) из лактата и глицерола.
3. Стимуляция липолиза в жировой ткани (посредством β1-рецепторов). Жирные кислоты используются мышцами в качестве источника энергии, и, кроме того, активируют глюконеогенез. В печени возможно усиление синтеза кетоновых тел. Высвобождающийся при липолизе глицерол захватывается главным образом печенью, где используется в реакциях глюконеогенеза.
4. Активация β3-адренорецепторов в бурой жировой ткани способствует факультативному термогенезу в ответ на действие холода.
5. Стимуляция синтеза холестерина через активацию ключевого фермента 3-гидрокси-3-метилглутарил-КоА-редуктазу.
6. Снижение протеолиза в скелетных мышцах (β2-рецепторы).
7. Ингибирование секреции инсулина (через α2-рецепторы). Это снижает утилизацию глюкозы скелетными мышцами и жировой тканью, сберегая ее для ЦНС.
Физиологические эффекты:
1. Повышение потребления кислорода на 30%.
2. Сужение сосудов кожи и желудочно-кишечного тракта (α-рецепторы).
3. Повышение силы и частоты сердечных сокращений (β1-рецепторы).
Увеличение силы сердечных сокращений при действии адреналина обьясняется усилением притока Са2+ в кардиомиоциты: адреналин → β1 -рецептор →активация аденилатциклазы → ↑ цАМФ → активация протеинкиназы А → фосфорилирование Са2+ -каналов L-типа → ↑ потока Са2+ в кардиомиоцит.
При очень высокой концентрации адреналина в крови повышается опасность развития аритмий и развития стенокардии.
4. Повышение системного артериального давления (α-рецепторы сосудов и β1-рецепторы сердца).
5. Расширение сосудов скелетных мышц и коронарных артерий (β2-рецепторы).
6. Расслабление гладких мышц бронхов, ЖКТ, мочевого пузыря (β2-рецепторы), но сокращение сфинктеров ЖКТ и мочевого пузыря (α1-рецепторы).
7. Расширение зрачка (α1-рецепторы)
8. Усиление потоотделения (α1-рецепторы).
9. Увеличение секреции гастрина слизистой оболочкой желудка (α2-рецепторы).
10. Усиление агрегации тромбоцитов (α2-рецепторы).
11. Реакция ЦНС - страх, тревога, бодрость (α2-рецепторы)
Все перечисленные реакции, в первую очередь, направлены на повышение способности организма расходовать энергию во время стресса (реакции борьбы или бегства.