Выберите правильное(ые) утверждение(я) или определение(я). Ваш выбор обоснуйте путем критики всех остальных утверждений или определений
2.1.В соответствие с законом сохранения и превращения энергии
1) работа может быть полностью превращена в теплоту.
2) теплота может быть полностью превращена в работу.
3) в топливном элементе (что такое топливный элемент?) вся энергия выделяется в виде теплоты.
4) в топливном элементе вся энергия выделяется в виде работы электрического тока.
5) в топливном элементе часть энергии выделяется в виде работы электрического тока.
2.2.Энтальпия образования вещества — это энтальпия реакции образования
1) вещества.
2) 1 моль вещества.
3) 1 моль вещества из простых веществ.
4) 1 моль вещества из простых веществ, взятых в стандартном состоянии.
5) вещества из атомов.
6) 1 моль вещества из атомов.
2.3.Стандартное состояние вещества — это
1) выбранное нами состояние вещества, с характеристиками которого мы сравниваем характеристики вещества в других состояниях.
2) наиболее стабильное состояние вещества в данных условиях.
3) выбранное нами состояние вещества при стандартных условиях, с характеристиками которого мы сравниваем характеристики вещества в других состояниях.
4) выбранное нами состояние вещества при данной температуре и давлении 1 атм, с характеристиками которого мы сравниваем характеристики вещества в других состояниях.
2.4.Энтальпия химической связи — это энтальпия реакции образования
| 1) вещества. | 2) 1 моль вещества. |
| 3) вещества из простых веществ. | 4) 1 моль вещества из простых веществ, взятых в стандартном состоянии. |
| 5) вещества из атомов. | 6) 1 моль вещества из атомов. |
2.5.Энтальпия химической реакции — это
1) теплота реакции, выделяющаяся при образовании вещества.
2) тепловой эффект реакции, измеренный при постоянном давлении.
3) тепловой эффект реакции, измеренный при постоянном объеме.
4) энтальпия реакции образования 1 моль вещества.
5) тепловой эффект реакции, измеренный при постоянных давлении и температуре.
6) тепловой эффект реакции, измеренный при постоянных объеме и температуре.
Задачи и вопросы
2.6.Что такое (ответ "единица теплоты" не принимается)
| 1.калория? | 2.Джоуль? |
2.7.Что такое стандартное
| 1.состояние вещества? | 2.значение энтальпии реакции? |
2.8.Выберите правильный(ые) ответ(ы). Ваш выбор обоснуйте.
Стандартное состояние воды —
| 1) газ. | 2) жидкость. |
| 3) лед. | 4) зависит от температуры. |
2.9.Укажите интервал, в котором в большинстве случаев заключена величина энтальпии химической реакции (в расчете на 1 моль продукта):
| 1) 1 — 10 Дж | 2) 10—100 Дж | 3)100—1000 Дж |
| 4) 1— 10 кДж | 5) 10—100 кДж | 6) 100—1000 кДж |
| 7) 1 — 1000 Дж | 8) 1— 1000 кДж | 9) 10 — 500 кДж |
2.10.Вычислите абсолютное значение энтальпии 1 моль вещества при комнатной температуре для следующих веществ и укажите (приблизительно) ошибку полученной величины в процентах (в скобках указаны неправильные ответы):
1.воды (–285,83 кДж/моль).
2.углекислого газа (–393,51 кДж/моль).
3.водорода (0).
2.11.Укажите реакцию, энтальпия которой является энтальпией образования
1.воды
| 1) 2H2 + O2 = 2H2O | 2) H2 + 1/2O2 = H2O |
| 3) 2H + O = H2O | 4) CH4 + 2O2 = 2H2O + CO2 |
2.оксида кальция
| 1) Са + О = СаО | 2) 2Са + O2 = 2CaO |
| 3) Ca + 1/2O2 = CaO | 4) CaCO3 = CaO + CO2 |
3.гидроксида железа (II)
| 1) FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl | 2) FeO + H2O = Fe(OH)2 |
| 3) Fe + 2O + 2H = Fe(OH)2 | 4) Fe + O2 + H2 = Fe(OH)2 |
2.12.Вычислите изменение стандартной энтальпии в одной из реакций предыдущего задания, используя справочные данные.
2.13.С помощью энтальпийной диаграммы, или используя закон Гесса, рассчитайте энтальпию образования указанного вещества по энтальпиям приведенных реакций (тепловые эффекты указаны при постоянном давлении).
1.ацетилена
2С2Н2 + 5О2 = 4СО2 + 2Н2Ож + 2610 кДж
С + О2 = СО2 + 394 кДж
2Н2 + О2 = 2Н2Ож + 572 кДж
2.карбида вольфрама WC
Сгр + O2,г = CO2,г + –393,5
2WCкр+5O2=2WO3,кр+2CO2,г + –2391,6
2Wкр + 3O2 = 2WO3,кр + –1675,0
2.14.Используя данные таблицы, вычислите, сколько теплоты должно быть затрачено, чтобы
1.расплавить 1 г водяного льда.
| Вещество | Агрегатное состояние | DfH°298, кДж/моль |
| Вода | газ | –241,8 |
| жидкость | –285,8 | |
| кристалл | –291,8 | |
| Оксид углерода (IV) | газ | –393,5 |
| жидкость | –401,9 | |
| кристалл | –418,7 |
2.испарить 1 г воды.
3.возогнать 1 г сухого льда.
2.15.Среди нижеприведенных реакций (допишите их уравнения) укажите экзотермические.
1.
| 1) CH4 + O2® | 2) CaCO3®CaO+... | 3) CuSO4·5H2O®CuSO4+ ... |
| 4) CaO + CO2 ® | 5) SO2 + O2 ® | 6) SO3® SO2 + ... |
2.
| 1) C + O2® | 2) Ca(OH)2 ®CaO+... | 3) H2O + CaO ® |
| 4) CO2 ® CO+O2 | 5) Fe+O2® | 6) Zn + HCl® |
3.
| 1) HCl + H2O® | 2) Mg + HCl® | 3) NH3 ® ... + N2 |
| 4) H2O + Na2O ® | 5) H2 + Cl2® | 6) Na2CO3 + H2O® Na2CO3·10 H2O |
2.16.Зависит ли и почему энтальпия химической реакции от
| 1.температуры? | 2.давления? |
2.17.На какую величину повысилась температура, если на рисунке (слева и справа, соответственно) показаны начальное и конечное положения ртутного мениска в термометре.
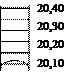 |  | ||
2.18.При нейтрализации некоторой одноосновной кислоты раствором гидроксида натрия тепловой эффект, измеренный при постоянном давлении, составил 53,1 кДж/моль.
1.Сильная или слабая кислота взята?
2.Чему равна энтальпия диссоциации этой кислоты?
2.19.При нейтрализации некоторого однокислотного основания раствором соляной кислоты тепловой эффект, измеренный при постоянном давлении, составил 51,9 кДж/моль.
1.Сильное или слабое основание было взято?
2.Чему равна энтальпия диссоциации этого основания?
Энтропия
Определения и утверждения