Раздел 5. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
Государственное образовательное учреждение
Высшего профессионального образования
«Нижегородская государственная медицинская академия
Минздравсоцразвития РФ»
Кафедра биохимии им. Г.Я. Городисской
Сборник тестов и упражнений
по биохимии
Рекомендовано Учебно-методическим объединением по медицинскому и фармацевтическому образованию ВУЗов России в качестве учебного пособия для студентов Медицинских ВУЗов
Нижний Новгород, 2009
УДК 577. 1:612.015
Сборник тестов и упражнений по биохимии. – Нижний Новгород: издательство Нижегородской государственной медицинской академии (издание 4-е, дополненное) - 2009.
Предлагаемые тесты и упражнения составлены по форме, рекомендованной МЗ РФ к государственной аттестации выпускников медвузов, и включают тесты раздела “Биологическая химия”, утвержденные МЗ РФ к междисциплинарному тестированию по специальности “Педиатрия”. В сборник включен раздел по “Биохимии ротовой полости”, предназначенный для студентов стоматологических факультетов.
Предназначен для студентов при подготовке к занятиям, зачетам и экзаменам для самоконтроля, а также для преподавателей при подготовке и проведении занятий, для контроля уровня знаний студентов и составления экзаменационных заданий как в тестовой, так и традиционной форме.
Составители:
Зав. кафедрой, д.б.н., проф. Ерлыкина Е.И., доцент, к.м.н. Шлапакова Т.И., ст. преподаватели: к.б.н. Кузьмина Е.И., к.б.н. Семенова Т.С., к.м.н. Якобсон Л.И., асс.: к.б.н. Баринова О.В., к.б.н. Коновалова О.И., Французова В.П.
Печатается по решению ЦМК по естественно-научным дисциплинам (протокол № 4 от 25.03.2009).
Коллектив авторов, 2009
СОДЕРЖАНИЕ
Раздел 1. Введение в биохимию…………………………………..…..…...5
Раздел 2. Белки: структура, свойства, функции…………………..…..…..9
Раздел 3. Ферменты: структура, свойства, регуляция активности……..17
Раздел 4. Синтез белка……………………………..……………………...34
Раздел 5. Цикл трикарбоновых кислот…………………………..…..… ..40
Раздел 6. Энергетический обмен…………………………………….…....45
Раздел 7. Биохимия гормонов……………………………………………..48
Раздел 8. Обмен углеводов………………………………………….…….55
Раздел 9. Обмен липидов…………………………………………………..62
Раздел 10. Обмен белков…………………………………………………..79
Раздел 11. Биохимия печени………………………………………………87
Раздел 12. Биохимия крови……………………………………………..…93
Раздел 13. Биохимия соединительной ткани………………………..……101
Раздел 14. Биохимия мышечной ткани……………………………..….…107
Раздел 15. Биохимия ротовой полости…………………………………..112
Ответы………………………………………………………………..…….116
СПИСОК СОКРАЩЕНИЙ.
ТГ – триацилглицирол
ХМ – хиломикроны
ЛПОНП – липопротеины очень низкой плотности
ЛПНП – липопротеины низкой плотности
ЛПВП – липопротеины высокой плотности
ХС – холестерол
ЛХАТ – лецитин:холестерол-ацилтрансфераза
ЩУК – щавелевоуксусная кислота
ЦТК – цикл трикарбоновых кислот
НАД – никотинамидадениндинуклеотид
ФМН – флавинмононуклеотид
ФАД – флавинадениндинуклеотид
ФП – фосфопиридоксаль
ТПФ – тиаминпирофосфат
ВЖК – высшие жирные кислоты
КоА – коэнзим А
ОМГ – оксиметилглутарил
Нв – гемоглобин
ППЦ – полипептидная цепь
ФАФС – фосфоаденозинфосфосульфат
ЛПЛ – липопротеинлипаза
ПОЛ – перекисное окисление липидов
ДГ – дегидрогеназа
СДГ – сукцинатдегидрогеназа
АРС-аза – аминоацил-тРНК-синтетаза
Раздел 1. ВВЕДЕНИЕ В БИОХИМИЮ.
1.1 Аминогруппа встречается в составе:
1. белков;
2. нейтральных жиров;
3. углеводов;
4. аминокислот;
5. азотистых оснований.
1.2 Какие из указанных соединений содержат фосфор?
1. простые белки;
2. гликоген;
3. ДНК;
4. мРНК;
5. аминокислоты;
6. нуклеотиды.
1.3 Что является структурным элементом простых белков?
1. мононуклеотиды;
2. глюкоза;
3. аминокислоты;
1.4 Структурными элементами нуклеиновых кислот являются:
1. мононуклеотиды;
2. глюкоза;
3. глицерин;
4. аминокислоты.
1.5 Какое из указанных соединений гидрофобно?
1. простой белок;
2. нейтральный жир;
3. гликоген;
4. аминокислоты.
1.6 Какая химическая связь подвергается гидролизу при распаде жиров?
1. фосфодиэфирная;
2. простая эфирная;
3. сложноэфирная;
4. гидрофобная.
1.7 Укажите биологические полимеры:
1. простые белки;
2. нейтральный жир;
3. ДНК;
4. гликоген;
5. аминокислоты.
1.8 Какая химическая связь подвергается гидролизу при распаде белков?
1. водородная;
2. сложноэфирная;
3. пептидная;
4. гидрофобная.
1.9 Укажите, какой характер имеет группа-NH2:
1. кислый;
2. основной;
3. нейтральный;
4. амфотерный.
1.10 Как называется эта химическая связь O...H:
1. сложноэфирная;
2. дисульфидная;
3. пептидная;
4. водородная;
5. простая эфирная.
1.11Как называется эта химическая связь -S-S-:
1. сложноэфирная;
2. дисульфидная;
3. пептидная;
4. водородная;
5. простая эфирная.
1.12 Как называется эта функциональная группа =NH:
1. спиртовая;
2. амино-;
3. альдегидная;
4. имино.
1.13 Укажите, какой характер имеет –COOH группа:
1. кислый;
2. основной;
3. нейтральный;
4. амфотерный.
1.14 Как называется -CO-NH- связь:
1. сложноэфирная;
2. пептидная;
3. водородная;
4. простая эфирная.
1.15 Структурным элементом крахмала является:
1. мононуклеотиды;
2. глюкоза;
3. фруктоза + глюкоза;
4. галактоза.
1.16 Структурным элементом гликогена является:
1. мононуклеотиды;
2. глюкоза;
3. глицерин;
4. галактоза.
1.17 Альдегидная группа встречается в составе:
1. белков;
2. нейтральных жиров;
3. углеводов;
4. аминокислот;
5. азотистых оснований.
1.18 Спиртовая группа встречается в составе:
1. белков;
2. триглицеридов;
3. углеводов;
4. аминокислот;
5. азотистых оснований.
1.19 Свободная карбоксильная группа встречается в составе:
1. белков;
2. нейтральных жиров;
3. углеводов;
4. аминокислот;
5. азотистых оснований.
1.20 Какие из указанных соединений содержат азот?
1. простые белки;
2. нейтральный жир;
3. фосфолипиды;
4. гликоген;
5. ДНК;
6. нуклеотиды.
1.21 Назовите углеводы - представители альдоз:
1. диоксиацетон;
2. глицеральдегид;
3. глюкоза;
4. рибоза;
5. фруктоза;
6. рибулоза;
7. галактоза.
1.22 Назовите углеводы - представители кетоз:
1. диоксиацетон;
2. глюкоза;
3. рибоза;
4. фруктоза;
5. рибулоза.
1.23 Какие вещества относятся к гомополисахаридам?
1. амилопектин;
2. глюкуроновая кислота;
3. гликоген;
4. гепарин;
5. крахмал;
6. глюкозамингликан.
1.24 Какие вещества относятся к гетерополисахаридам?
1. амилопектин;
2. глюкуроновая кислота;
3. гликоген;
4. гепарин;
5. крахмал;
6. глюкозамингликан.
1.25 Какие моносахариды образуются при кислотном гидролизе лактозы?
1. два остатка Д-глюкозы;
2. α-Д-глюкоза и β-Д-галактоза;
3. Д-глюкоза и Д-фруктоза;
4. Д-глюкоза и Д-манноза.
Раздел 2. БЕЛКИ: СТРУКТУРА, СВОЙСТВА, ФУНКЦИИ.
2.1 Сравните растворимость трех пентапептидов при рН=7. Расположите их в порядке возрастания гидрофильных свойств:
1) лей – фен – иле – гли – вал;
2) глу – асп – сер – фен – иле.
3) арг – лиз – тре – гис – цис.
2.2 Расположите элементы структуры белковой молекулы в той последовательности, в которой они возникают при синтезе белка и формировании его нативной конформации.
1. Объединение протомеров в олигомерный белок.
2. Формирование α-спиралей и β-складчатых участков.
3. Образование пептидных связей.
4. Образование гидрофобных, водородных и ионных связей между радикалами аминокислот.
2.3 Напишите структурную формулу пентапептида следующего строения:
Гис – Глу - Про – Фен – Сер.
2.4 Взаимодействие субъединиц в олигомерном белке и белков с лигандами обусловлено принципом ...
2.5 Аминокислоты серин, тирозин и треонин, согласно классификации по химической природе радикала, относятся к … аминокислотам и при формировании третичной структуры могут образовывать … связи.
2.6 Аспарагиновая и глутаминовая аминокислоты, согласно классификации по химической природе радикала, относятся к … аминокислотам и при формировании третичной структуры могут образовывать … связи с радикалами следующих аминокислот …
2.7 Разделение белков методом электрофореза основано на их различии по …
2.8 В основе метода гемодиализа лежит разделение высокомолекулярных соединений от низкомолекулярных примесей с помощью …
2.9 Назовите данный трипептид:
 |
2.10 Назовите данный трипептид:
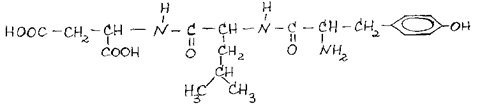 |
2.11
 |
Назовите данный трипептид:
2.12 Подберите к каждой из аминокислот соответствующее свойство радикала (подберите к буквам соответствующие цифры):
| 1.Триптофан. | A-Гидрофильный, |
| 2.Аспарагиновая кислота. | положительно заряженный. |
| 3.Цистеин. | Б-Гидрофильный, |
| 4.Лейцин. | отрицательно заряженный. |
| 5.Аргинин. | В-Гидрофильный, незаряженный. |
| 6.Серин. | Г-Гидрофобный. |
2.13 Разные уровни структурной организации белков стабилизированы определёнными типами связей. Подберите к каждому пронумерованному типу связи буквенный ответ:
| 1.Ковалентные связи между карбоксильными и аминогруппами радикалов аминокислот. | |
| 2.Связь между α- амино- и α-карбокси-группировками аминокислот. | A-Первичная структура. |
| 3.Связь между радикалами цистеина. | |
| 4.Водородные связи между пептидными группировками. | Б-Вторичная структура. |
| 5.Водородные связи между радикалами аминокислот. | В-Третичная структура. |
| 6.Гидрофобные взаимодействия радикалов аминокислот. |
2.14 Дан фрагмент пентапептидной цепи: серил-лизил-лейцил-цистеил-валин.
Выберите аминокислоты, которые могут участвовать в образовании:
| 1. Серин. | |
| А – Водородной связи. | 2. Лизин. |
| Б – Ионной связи. | 3. Лейцин. |
| В – Гидрофобного взаимодействия. | 4. Цистеин. |
| 5. Валин. |
2.15 Определите, как будут вести себя при электрофорезе в нейтральной среде следующие аминокислоты:
| 1. Лизин. | А – Двигается к аноду. |
| 2. Триптофан. | Б – Двигается к катоду. |
| 3. Аспартат. | В – Останутся на линии старта. |
| 4. Глутамат. | |
| 5. Фенилаланин. | |
| 6. Гистидин. |
2.16 Какие из перечисленных факторов могут изменять конформацию белковой молекулы:
| А – регулировать биологическую активность белков; | 1. Изменение температуры от 00 до 400С. |
| 2. Повышение температуры от 500 до 1000С. | |
| Б – вызывать денатурацию белка. | 3. Взаимодействие с природными лигандами. |
| 4. Действие солей тяжелых металлов. | |
| 5. Действие солей щелочно-земельных металлов. |
2.17 Какие свойства белка обусловлены наличием в их структуре карбоксильных и аминогрупп?
1. гидрофильность и агрегативная неустойчивость;
2. термолабильность и растворимость;
3. способность к электрофорезу и реакциям осаждения;
4. амфотерность и способность к электрофорезу.
2.18 Для изучения первичной структуы белка применяется метод:
1. секвенирования;
2. рентгеноструктурного анализа;
3. определение коэффициента поступательного трения;
4. определение характеристической вязкости.
2.19 Какова особенность кислых белков?
1. преобладание дикарбоновых аминокислот;
2. равное соотношение диаминомонокарбоновых и моноаминодикарбоновых аминокислот;
3. преобладание диаминомонокарбоновых кислот;
4. белок состоит из моноамино- и монокарбоновых кислот.
2.20 Белки характеризуются:
1. амфотерными свойствами;
2. отсутствием специфической молекулярной организации;
3. сохранением структуры молекулы при кипячении;
4. неспособностью кристаллизоваться.
2.21 Первичная структура белка – это:
1. конфигурация полипептидной цепи;
2. способ укладки полипептидной цепи в определенном объеме;
3. порядок чередования аминокислот в полипептидной цепи;
4. количественный состав аминокислот в полипептидной цепи.
2.22 Вторичная структура – это:
1. альфа-спираль, бета-складчатость и аморфные участки;
2. конфигурация полипептидной цепи;
3. образование протомера;
4. способ взаимодействия нескольких протомеров в пространстве.
2.23 Третичная структура белка – это высшая ступень организации для:
1. олигомерных белков;
2. мономерных белков;
3. доменных белков.
2.24 Связи, стабилизирующие α-спираль:
1. водородные;
2. гидрофобные;
3. пептидные;
4. ионные.
2.25 Что такое лиганд?
1. мономер четвертичного белка;
2. часть молекулы протомера, выполняющая определенную функцию;
3. скопление гидрофобных аминокислот на поверхности белка;
4. молекула или ион, которые связываются с белком.
2.26 Что такое кластер?
1. скопление радикалов на поверхности белка, выполняющих функцию связывания;
2. мономер четвертичного белка;
3. небелковая часть сложного белка;
4. часть молекулы протомера, выполняющая определенную функцию.
2.27 Домен – это:
1. часть протомера, участвующая в функции связывания;
2. мономер четвертичного белка;
3. часть протомера, выпоняющая сходные функции в разных белках;
4. небелковая часть сложного белка.
2.28 Четвертичная структура – это:
1. пространственная укладка протомера;
2. пространственная укладка нескольких протомеров;
3. α-спираль и β-структура;
4. образование доменов.
2.29 Нативные свойства олигомерных белков проявляются при формировании:
1. α-спирали;
2. четвертичной ступени организации;
3. β-структуры;
4. третичной ступени организации.
2.30 Взаимодействие субъединиц в олигомерном белке осуществляется за счет:
1. всех типов слабых связей;
2. только ковалентных связей;
3. только гидрофобных связей;
4. ионов металлов.
2.31 Нативные свойства мономерных белков проявляются при формировании:
1. α-спирали;
2. третичной структуры;
3. полипептидной цепи;
4. четвертичной структуры;
5. вторичной структуры.
2.32 Скорость седиментации белка зависит от:
1. числа растворенных молекул;
2. формы молекулы белка;
3. ионной силы раствора;
4. величины молекулы и ее массы.
2.33 Изоэлектрическая точка гемоглобина равна 6,8. Куда мигрирует данный белок в среде с рН=3,0 при электрофорезе?
1. мигрирует к катоду;
2. остается на линии старта;
3. образует биполярный ион;
4. мигрирует к аноду.
2.34 Обратимая денатурация белка происходит при:
1. длительном нагревании;
2. действии сильных кислот;
3. кратковременном воздействии спирта;
4. добавлении солей тяжелых металлов.
2.35 При денатурации белка происходит:
1. изменение пространственной организации молекулы;
2. связывание ионогенных групп;
3. сохранение конформации белка.
2.36 Необратимая денатурация происходит при:
1. высаливании;
2. кратковременном воздействии спирта;
3. действии сильных кислот;
4. воздействии постоянного электрического поля.
2.37 Представителями хромопротеинов являются:
1. цитохромы;
2. каталаза;
3. гемоглобин;
4. миоглобин;
5. хлорофилл;
6. рибофлавин.
2.38 Какой заряд имеет белок в ИЭТ?
1. положительный;
2. отрицательный;
3. электрически нейтрален;
4. любой.
2.39 Как будет мигрировать белок при проведении электрофореза в условиях, когда pH раствора имеет более щелочное значение, чем ИЭТ?
1. к аноду;
2. к катоду;
3. остаётся на месте старта;
4. образует биполярный ион.
2.40 Что является простетической группой гемоглобина?
1. четыре пиррольных кольца, соединённых с железом;
2. протопорфирин;
3. железосодержащий протопорфирин.
2.41 Какой метод можно применить для фракционирования белков?
1. кристаллизацию;
2. осаждение кислотами и щелочами;
3. электрофорез;
4. высаливание.
2.42 Укажите суммарный заряд в нейтральной среде для тетрапептида
глицил-аспарагил-лизил-гистидин:
1. положительный;
2. отрицательный;
3. нейтральный.
2.43 Укажите направление движения пептида лиз-гли-ала-лей в процессе электрофореза на бумаге при pH=7.0:
1. к катоду;
2. к аноду;
3. останется на старте.
2.44 Какой процесс сопровождается потерей белком гидрофильных и приобретением гидрофобных свойств:
1. гидролиз;
2. денатурация;
3. диссоциация;
4. седиментация.
2.45 Специфичность белков обусловлена:
1. аминокислотным составом, их чередованием;
2. содержанием α-спирализованных и β-складчатых участков;
3. наличием определённых кластеров;
4. наличием небелкового компонента.
2.46 Укажите аминокислоты, радикалы которых имеют при pH=7.0 отрицательный заряд:
1. лизин;
2. серин;
3. треонин;
4. глутаминовая кислота;
5. аргинин;
6. аспарагин.
2.47 О чём позволяет судить биуретовая реакция:
1. о наличии белков в биологической жидкости;
2. о первичной структуре белка;
3. о наличии аминокислот в белке;
4. о функциях белков.
2.48 Из приведённых ниже аминокислот выберите те, радикалы которых могут участвовать в образовании водородных связей:
1. аспарагиновая кислота;
2. глицин;
3. глутаминовая кислота;
4. серин;
5. валин;
6. лизин;
7. гистидин.
2.49 Выберите пары аминокислот, способные образовывать связи при формировании третичной структуры белка:
1. серин, аланин;
2. аланин, валин;
3. глутамин, аспарагиновая кислота;
4. цистеин, цистеин;
5. гистидин, аспарагиновая кислота;
6. фенилаланин, аргинин;
7. цистеин, аланин;
8. глутаминовая кислота, лизин.
2.50 Что представляют собой контактные поверхности протомеров в олигомерном белке:
1. поверхностные участки протомеров, между аминокислотными остатками которых образуются преимущественно ковалентные связи;
2. поверхностные участки протомеров, комплементарные друг другу, в результате пространственного и химического соответствия между двумя поверхностями образуется большое количество слабых связей;
3. поверхностные участки протомеров, представленные только небелковыми группами, за счёт которых осуществляется контакт взаимодействующих полипептидных цепей;
4. фрагменты полипептидных цепей уложенных в пространстве в виде бета-структур.
2.51 Какие из перечисленных ниже взаимодействий обусловлены комплементарностью молекул:
1. белки с лигандами;
2. протомеры в олигомерном белке;
3. белок с диполями воды в растворе;
4. функционально связанные ферменты при формировании полиферментных комплексов;
5. различные белки в процессе самосборки клеточных органелл;
6. радикалы аминокислот при формировании третичной структуры белка.
2.52 Что представляет собой центр узнавания белка лигандом:
1. совокупность радикалов аминокислот, сближенных на уровне третичной структуры;
2. фрагмент третичной структуры;
3. простетическая небелковая группа;
4. участок белка, комплементарный лиганду.
2.53 Чем определяется растворимость белка в водной среде:
1. ионизацией белковой молекулы;
2. гидратацией белковой молекулы при растворении;
3. формой молекулы белка;
4. наличием в структуре гидрофильных аминокислот;
2.54Что происходит с белком при денатурации:
1. уменьшение растворимости;
2. изменение степени гидратации;
3. осаждение;
4. сохранение нативной структуры;
5. изменение молекулярной массы;
6. потеря биологических свойств.
2.55 Какие из перечисленных ниже факторов могут вызвать денатурацию белка:
1. температура выше 600С;
2. взаимодействие с лигандом (субстратом, эффектором-регулятором, кофактором);
3. отщепление части полипептидной цепи при действии протеолитических ферментов;
4. значительные изменения pH;
5. изменение модификации белков (присоединение фосфатной, метильной или ацетильной группировки к молекуле белка);
6. действие солей тяжёлых металлов;
7. действие солей щёлочноземельных металлов.
Раздел 3. ФЕРМЕНТЫ: СТРУКТУРА, СВОЙСТВА,
РЕГУЛЯЦИЯ АКТИВНОСТИ.
 |
3.1. На рисунке изображены графики зависимости скорости реакции от концентрации лактата для трех изоферментов лактатдегидрогеназы. Расположите ферменты в порядке увеличения сродства к субстрату.
3.2 Выберите и запишите последовательность событий (номеров), происходящих при аллостерическом ингибировании (например 6-5-1-…):
1. снижается скорость реакции;
2. изменяется конформация фермента;
3. эффектор присоединяется в активном центре;
4. изменяется конформация аллостерического центра;
5. нарушается комплементарность активного центра субстрату;
6. эффектор присоединяется в аллостерическом центре;
7. изменяется конформация активного центра.
3.3 Фермент креатинфосфокиназа, катализирующий превращение креатинфосфата в креатин, существует в трех изоформах, которые имеют следующие значения Км:
КК 1 – 0,05 мкмоль/л
КК 2 – 0,1 мкмоль/л
КК 3 – 0,2 мкмоль/л.
Расположите ферменты в порядке убывания сродства фермента к субстрату.
3.4 Оптимальные условия действия фермента – рН=7, Т=370С. При изменении рН до 5,5 активность фермента заметно снизилась, так как …
3.5 Большинство ферментов организма проявляют максимальную активность при Т=370С. При увеличении температуры до 600С активность ферментов значительно снижается, так как …
3.6 Фермент в количестве 2 мг за 30с катализировал превращение 50 мкмоль субстрата. Удельная активность этого фермента составила …
3.7 Фермент поджелудочной железы трипсиноген (неактивный фермент) имеет молекулярную массу 56000 Д. В кишечном соке трипсиноген превращается в трипсин (активный фермент) с молекулярной массой 45000 Д. Активация фермента происходит за счет изменения его … , такой способ регуляции называется …
3.8 В медицинской практике количественное определение активности ферментов в тканях и биологических жидкостях организма используется для …
3.9 Сравните взаимодействие фермента с субстратом и эффектором:
| 1. Связывание вызывает конформационные изменения фермента. | |
| А – субстрат. | 2. Связывается с регуляторным центром. |
| Б – аллостерический эффектор. | 3. Всегда является низкомолекулярным соединением. |
| 4. Претерпевает структурные изменения в ходе катализа. |
3.10 Сравните действие аллопуринола (конкурентный ингибитор) и PbSO4 (неконкурентный ингибитор) на фермент ксантиноксидазу:
| 1. Снижают активность фермента. | |
| 2. Конкурируют с субстратом за место в активном центре. | |
| А – только аллопуринол; | 3. Действие необратимо. |
| Б – только PbSO4. | 4. Ингибитрование устраняется избытком субстрата. |
| 5. Образует с ферментом ковалентные связи. |
3.11 Определите, какой класс ферментов может катализировать следующие реакции:
| А – оксидоредуктазы; | 1. NH3 + CO2 + 2ATP = Карбомоилфосфат + 2ATP + Pi |
| Б – трансферазы; | 2. аланин + α-кетоглутарат = пируват + глутамат |
| В – гидролазы; | 3. сукцинат + ФАД+ = фумарат + ФАДН2 |
| Г – лиазы; | 4. глюкозо-6-фосфат = глюкозо-1-фосфат |
| Д – изомеразы; | 5. сахароза + Н2О = глюкоза + фруктоза |
| Е – лигазы. | 6. фруктозо-1,6-дифосфат = глицеральдегид-3-фосфат + диоксиацетонфосфат |
3.12 Подберите к каждому из перечисленных классов ферментов витамины, производные которых могут быть кофакторами данного класса ферментов:
| А – оксидоредуктазы; | 1. В1, В6 |
| Б – трансферазы; | 2. В2, В3 |
| В – изомеразы; | 3. В5, В6 |
| Г – лиазы; | 4. В12 |
| Д – лигазы. | 5. Н, К |
3.13 Сравните ферменты с неорганическими катализаторами:
| 1. Способны к регуляции активности. | |
| 2. Ускоряют только термодинамически возможные реакции. | |
| А – сходство с неорганическими катализаторами; | 3. Не расходуются в ходе реакции. |
| 4. Обладают высокой каталитической активностью. | |
| Б – отличия от неорганических катализаторов. | 5. Не смещают равновесие химической реакции. |
| 6. Действуют в мягких условиях (Т, рН). | |
| 7. Обладают высокой специфичностью действия. |
3.14 Выберите, какие воздействия могут:
| А – активировать фермент. | 1. Присоединение к ферменту остатка фосфорной кислоты. |
| 2. Образование полиферментного комплекса. | |
| Б – ингибировать фермент. | 3. Присоединение к ферменту щелочноземельного металла. |
| 4. Присоединение к ферменту квазисубстрата. | |
| 5. Присоединение к ферменту эффектора. | |
| 6. Присоединение к ферменту тяжелого металла. |
3.15 Определите, какие из перечисленных воздействий являются:
| А – обратимым способом регуляции. | 1. Химическая модификация. |
| 2. Ограниченный протеолиз. | |
| Б – необратимым способом регуляции. | 3. Конкурентное ингибирование. |
| 4. Аллостерическая регуляция. |
3.16 Сравните конкурентное и неконкурентное виды ингибирования:
| А – конкурентное ингибирование; | 1. Ингибитор присоединяется в активном центре. |
| 2. Ингибитор не имеет структурного сходства с субстратом. | |
| 3. Ингибитор связывается чаще вне активного центра фермента. | |
| Б – неконкурентное ингибирование. | 4. Ингибитор связывается в аллостерическом центре. |
| 5. Кm увеличивается, Vmax не изменяется. | |
| 6. Кm не изменяется, Vmax уменьшается. | |
| 7. Снимается избытком субстрата. |
3.17 Проводилось измерение активности сукцинатдегидрогеназы в оптимальных условиях. Как изменится активность фермента, если:
| А – к инкубационной среде добавили малоновую кислоту. | 1. Увеличится. |
| 2. Уменьшится. | |
| Б – в присутствии малоновой кислоты увеличили концентрацию сукцината. | 3. Сначала уменьшится, а затем восстановится до исходного значения. |
| 4. Не изменится. |
3.18 Проводилось измерение активности амилазы (фермента, расщепляющего крахмал) в оптимальных условиях. Как изменится активность фермента, если:
| А – к инкубационной среде добавили сульфат свинца. | 1. Увеличится. |
| 2. Уменьшится. | |
| Б – в присутствии сульфата свинца увеличили концентрацию крахмала. | 3. Сначала уменьшится, а затем восстановится до исходного значения. |
| 4. Не изменится. |
3.19 Подберите способ регуляции для каждого из перечисленных ферментов:
| А – Аллостерическая регуляция. | 1. Гликогенсинтаза –Н2РО4(неактивная) + Н2О = гликогенсинтетаза (активная) + Н3РО4. |
| Б – Химическая модификация. | 2. Протеинкиназа (неактивная) + цАМФ = протеинкиназа (активная). |
| В – Ограниченный протеолиз. | 3. Пепсиноген + НСl + Н2О = пепсин + полипептид. |
| 4. 2 Фосфорилазы В (неактивная) + 4 АТФ = фосорилаза А-Н3РО4 (активная) + 4 АДФ |
3.20 Что называется активным центром фермента?
1. участок фермента, обеспечивающий присоединение субстрата и его превращение;
2. место присоединения апофермента к коферменту;
3. часть молекулы фермента, которая легко отщепляется от апофермента;
4. место присоединения аллостерического эффектора.
3.21 Аминокислоты, входящие в активный центр фермента, располагаются:
1. в разных участках полипептидной цепи;
2. в середине полипептидной цепи;
3. на С-конце полипептидной цепи;
4. непрерывно друг за другом в одном участке полипептидной цепи.
3.22 Какие связи преимущественно образуются между ферментом и субстратом при формировании субстрат-энзимного комплекса?
1. водородные;
2. пептидные;
3. ионные;
4. дисульфидные.
3.23 Как называется вещество, с которым взаимодействует фермент?
1. апофермент;
2. кофермент;
3. изоэнзим;
4. субстрат;
5. холофермент.
3.24 С белковой частью фермента непрочно связан:
1. простетическая группа;
2. кофермент;
3. апофермент;
4. изофермент.
3.25 Какая часть фермента определяет специфичность его действия?
1. апофермент;
2. кофермент;
3. простетическая группа;
4. профермент.
3.26 Как называется участок фермента, обеспечивающий химическое превращение субстрата?
1. адсорбционный центр;
2. регуляторный центр;
3. каталитический центр.
3.27 Аллостерический центр – это участок фермента, к которому присоединяется:
1. квази-субстрат;
2. кофермент;
3. эффектор;
4. субстрат.
3.28 Сущность теории Фишера:
1. активный центр фермента и субстрат находятся в строгом пространственном соответствии;
2. активный центр пространственно формируется по субстрату в процессе образования субстрат-энзимного комплекса;
3. активный центр присоединяет группу родственных субстратов;
4. активный центр может взаимодействовать только с одним субстратом.
3.29 Сущность теории Кошланда:
1. активный центр фермента и субстрат находятся в строгом пространственном соответствии;
2. активный центр пространственно формируется по субстрату в процессе образования субстрат-энзимного комплекса;
3. активный центр присоединяет группу родственных субстратов;
4. активный центр может взаимодействовать только с одним субстратом.
3.30 Какова возможная причина активирующего действия на фермент ионов щелочно-земельных металлов?
1. способствуют образованию субстрат-энзимного комплекса;
2. усиливают диссоциацию субстрат-энзимного комплекса;
3. вызывают денатурацию апофермента;
4. изменяют конформацию субстрата.
3.31 Какие связи разрушаются под действием амилазы?
1. пептидные;
2. эфирные;
3. гликозидные;
4. водородные.
3.32 Ферменты, участвующие в разрыве –С-С-связей без участия воды, относятся к классу:
1. лиаз;
2. лигаз;
3. трансфераз;
4. гидролаз;
5. изомераз.
3.33 Какой фермент осуществляет гидролитический распад дисахарида?
1. липаза;
2. амилаза;
3. лактаза;
4. пептидаза.
3.34 К классу оксидоредуктаз относятся:
1. цитохромоксидаза;
2. глюкокиназа;
3. каталаза;
4. эндопептидаза.
3.35 Энзимопатии – заболевания, связанные с недостаточной функцией:
1. белков;
2. белков-ферментов;
3. углеводов;
4. углеводно-белковых комплексов;
5. гормонов.
3.36 Энергия активации – это:
1. средняя кинетическая энергия молекул в системе;
2. минимальное количество энергии, которое нужно сообщить системе, чтобы перевести 1 моль вещества в реакционноспособное состояние;
3. минимальная энергия реакционноспособных молекул.
3.37 При изменении концентрации субстрата активность фермента:
1. не изменяется;
2. активность фермента постоянно повышается с увеличением концентрации субстрата;
3. с увеличением концентрации субстрата активность фермента повышается до определенного предела.
3.38 Константа Михаэлиса численно равна:
1. концентрации субстрата, при которой скорость реакции составляет половину максимальной;
2. концентрации субстрата, при которой скорость реакции является максимальной;
3. концентрации субстрата, при которой скорость реакции минимальна;
4. половине максимальной скорости реакции.
3.39 При превращении профермента в фермент происходит:
1. изменение активного центра;
2. стабилизация структуры белка;
3. отщепление части полипептидной цепи, изменение структуры фермента, формирование активного центра;
4. образование субстрат-энзимного комплекса.
3.40 В физиологических условиях не наблюдается:
1. необратимое ингибирование, вызванное денатурацией фермента;
2. конкурентное ингибирование;
3. неконкурентное ингибирование;
4. ретроингибирование.
3.41 Эффект положительной кооперативности олигомерных ферментов - это:
1. эффект усиления первоначального действия ферментов;
2. эффект ослабления первоначального действия ферментов;
3. обратимое ингибирование;
4. необратимое ингибирование.
3.42 Обратимое ингибирование активности фермента возможно:
1. при врожденном нарушении первичной структуры фермента;
2. при действии солей тяжелых металлов;
3. при действии высокой температуры;
4. при избытке субстрата.
3.43 Субстратное ингибирование активности ферментов возникает вследствие:
1. недостаточной концентрации субстрата;
2. оптимальной концентрации субстрата;
3. высокой концентрации субстрата.
3.44 При действии ингибитора, обладающего структурным сходством с субстратом, наблюдается следующий вид торможения:
1. неконкурентное;
2. конкурентное;
3. аллостерическое;
4. неспецифическое.
3.45 Необратимые ингибиторы ферментов:
1. гормоны;
2. соли тяжелых металлов в высоких концентрациях;
3. соли щелочно-земельных металлов;
4. избыток субстрата.
3.46 К специфической регуляции активности ферментов относится:
1. влияние температуры;
2. влияние рН;
3. влияние гормонов;
4. влияние ионной силы.
3.47 Механизм действия конкурентных ингибиторов, заключается в том, что ингибитор:
1. вызывают денатурацию фермента;
2. изменяют пространственную конформацию активного центра;
3. блокируют активный центр;
4. окисляют сульфгидрильные группы фермента.
3.48 Часть молекулы фермента, обеспечивающая присоединение к нему отрицательного эффектора, называется:
1. активный центр;
2. аллостерический центр;
3. каталитический участок.
3.49 Ингибирование фермента по типу обратной связи называется:
1. конкурентным ингибированием;
2. бесконкурентным ингибированием;
3. ретроингибированием;
4. смешанным ингибированием.
3.50 Изоферменты – это:
1. ферменты, отличающиеся по физико-химическим свойствам, катализирующие одну и ту же реакцию;
2. мультимеры, обладающие одинаковыми физико-химическими свойствами;
3. ферменты, катализирующие разные химические реакции;
4. ферменты, способные катализировать несколько химических реакций.
3.51 Неактивной формой протеолитических ферментов является:
1. апофермент;
2. профермент;
3. кофермент;
4. изофермент.
3.52 Квази-субстрат присоединяется к:
1. активному центру;
2. аллостерическому центру;
3. апоферменту;
4. коферменту.
3.53 Отрицательный эффектор:
1. влияет на активный центр фермента и ускоряет ход реакции;
2. вызывает деформацию активного центра фермента и замедляет ход реакции;
3. вызывает обратимую денатурацию белка-фермента;
4. вызывает необратимую денатурацию фермента.
3.54 Положительный эффектор:
1. изменяет конформацию активного центра фермента и ускоряет ход реакции;
2. вызывает деформацию активного центра фермента и замедляет ход реакции;
3. вызывает обратимую денатурацию фермента.
3.55 Механизм действия аллостерических ингибиторов заключается в том, что они:
1. вызывают денатурацию апофермента;
2. блокируют активный центр фермента;
3. нарушают пространственную конфигурацию активного центра фермента.
3.56 К модификации фермента не относится:
1. денатурация апофермента;
2. ограниченный протеолиз;
3. присоединение химических группировок;
4. аллостерический эффект.
3.57 Малоновая кислота тормозит активность сукцинатдегидрогеназы в результате:
1. аллостерического ингибирования;
2. субстратного ингибирования;
3. конкурентного ингибирования;
4. ретроингибирования.
3.58 В основе обнаружения ферментов лежит следующее их свойство:
1. специфичность действия и каталитическая активность;
2. термолабильность;
3. зависимость от рН среды;
4. способность к электрофорезу.
3.59 К факторам, влияющим на активность фермента посредством изменения степени ионизации субстрата и активногоцентра фермента, относятся:
1. температура;
2. рН среды;
3. соли тяжелых металлов;
4. соли щелочноземельных металлов.
3.60 При действии низкой температуры с ферментом происходит:
1. денатурация;
2. необратимая инактивация;
3. обратимая инактивация.
3.61 Механизм активации проферментов:
1. изменение первичной структуры;
2. изменение третичной структуры;
3. формирование активного центра;
4. присоединение металла.
3.62 Увеличение активности ферментов при повышении температуры до 45 С связано с:
1. денатурацией белковой части фермента;
2. изменением первичной структуры;
3. обратимым изменением третичной структуры;
4. снижением энергии активации.
3.63 Укажите свойства ферментов, обусловленные их белковой природой:
1. ускорение как прямой, так и обратной реакции;
2. термолабильность;
3. рН зависимость;
4. не изменяемость в ходе реакции;
5. изменяют активность под действием активаторов и ингибиторов;
6. специфичность.
3.64 Укажите класс ферментов, представители которого требуют затрат энергии для осуществления катализа:
1. оксидоредуктазы;
2. трансферазы;
3. гидролазы;
4. лиазы;
5. изомеразы;
6. лигазы.
3.65 Ферменты, расщепляющие молекулу субстрата на два фрагмента с присоединением молекулы воды по месту разрыва, относятся к классу:
1. лигазы;
2. изомеразы;
3. гидролазы;
4. лиазы;
5. трансферазы;
6. оксидоредуктазы.
3.66 Ферменты, перемещающие группу атомов внутри молекулы субстрата, относятся к классу:
1. трансферазы;
2. лиазы;
3. лигазы;
4. гидролазы;
5. изомеразы;
6. оксидоредуктазы.
3.67 Ферменты, отщепляющие молекулу воды от субстрата с образованием двойной связи, относятся к классу:
1. оксидоредуктазы;
2. трансферазы;
3. гидролазы;
4. лиазы;
5. изомеразы;
6. лигазы.
3.68 Ферменты, транспортирующие электроны, относятся к классу:
1. трансферазы;
2. оксидоредуктазы;
3. гидролазы;
4. лигазы;
5. лиазы;
6. изомеразы.
3.69 При конкурентном ингибировании происходит:
1. необратимое ингибирование;
2. изменение третичной структуры фермента;
3. ингибирование продуктами реакции;
4. обратимое ингибирование;
5. угнетение активности, зависящее от концентрации ингибитора.
3.70 Изоферменты отличаются между собой по:
1. первичной структуре;
2. электрофоретической подвижности;
3. оптимуму рН;
4. иммунологическим особенностям;
5. отношению к ингибиторам;
6. механизму действия.
3.71 Биологическое значение витаминов заключается в том, что они:
1. являются источником энергии;
2. входят в состав гормонов;
3. являются структурными компонентами клеток;
4. входят в состав белков соединительной ткани;
5. входят в состав ферментов в виде коферментов.
3.72 Витамины-кофакторы:
1. связываются с ферментом только слабыми связями;
2. связываются с ферментом только ковалентно;
3. связываются с активным центром фермента всеми типами связей;
4. связываются с апоферментом;
5. встраиваются в активный центр фермента.
3.73 Функции витаминов:
1. ингибиторная, транспортная;
2. кофакторная, косубстратная;
3. рецепторная, антиоксидантная;
4. регуляторная, ингибиторная;
5. регуляторная, структурная.
3.74 Основная функция витамина В3(РР или никотинамида):
1. дегидрирование;
2. декарбоксилирование;
3. ацетилирование;
4. окислительное декарбоксилирование.
3.75 Основная функция витамина В6:
1. перенос ацильных групп;
2. перенос аминогрупп, декарбоксилирование аминокислот;
3. перенос карбоксильных групп;
4. перенос метильных групп.
3.76 Основная функция витамина В2:
1. карбоксилирование субстрата;
2. декарбоксилирование субстрата;
3. перенос ацильных групп;
4. перенос метильных групп;
5. дегидрирование субстрата.
3.77 Основная функция витамина Н (биотина) :
1. включение карбоксила в молекулу субстрата;
2. перенос аминогрупп;
3. перенос метильных групп;
4. перенос ацильных групп.
3.78 Основная функция витамина В1:
1. участие в процессах дезаминирования;
2. участие в процессах окисления;
3. перенос ацильных групп;
4. участие в процессе окислительного декарбоксилирования кетокислот.
3.79 Витамин С принимает участие:
1. в структуре редокс-цепи митохондрий.
2. в регуляции водно-солевого обмена.
3. в реакциях дегидрирования и декарбоксилирования.
4. в окислительно-восстановительных процессах, гидроксилировании аминокислот и стероидных гормонов.
3.80 Витамин В2является составной частью кофермента:
1. флавинадениндинуклеотида.
2. никотинамидадениндинуклеотида.
3. биотина.
4. пиридоксальфосфата.
3.81 Витамин В3 является кофактором:
1. ФАД-зависимых дегидрогеназ.
2. НАД-зависимых дегидрогеназ.
3. трансаминаз.
4. декарбоксилаз.
3.82 К водорастворимым витаминам относятся:
1. РР, Н, В6;
2. А, В, С, Д;
3. С, Р, К, Е;
4. В1, В2, В12.
3.83 К жирорастворимым витаминам относятся:
1. А, В, С, Д;
2. А, Д, Е, К;
3. РР, Н, В, Вс;
4. С, Р, К, Е.
3.84 Антивитамины – это:
1. вещества, вызывающие конкурентное торможение химических реакций
2. это модификаторы витаминов химической природы
3. вещества, введение которых вызывает гипо– и авитаминоз
4. это соединения повышающие активность витаминов.
3.85 Ферменты – это:
1. вещества, которые используются в ходе реакции;
2. вещества, которые в ходе реакции претерпевают изменения, но по ее завершении возвращаются в исходное состояние;
3. белковые катализаторы;
4. вещества, которые образуют комплекс с субстратом и разрушаются в ходе реакции;
5. вещества, ускоряющие химическую реакцию.
3.86 Центр регуляции- это:
1. место связывания фермента с субстратом;
2. место присоединения эффектора;
3. место присоединения кофактора;
4. часть фермента, обеспечивающая химические превращения субстрата.
3.87 Химическое превращение субстрата обеспечивается:
1. аллостерическим центром;
2. регуляторным центром;
3. адсорбционным центром;
4. каталитическим центром.
3.88 Функция активного центра:
1. ориентация субстрата относительно активного центра;
2. строгая пространственная ориентация фермента и субстрата;
3. присоединение субстрата;
4. взаимосвязь с регулятором фермента;
5. акт катализа.
3.89 Какая функциональная группа лизина может входить в активный центр фермента?
1. Карбоксильная группа.
2. α-аминогруппа.
3. ε-аминогруппа.
4. Углеводородная цепь.
3.90 Какая функциональная группа аспарагиновой кислоты может входить в активный центрфермента?
1. γ-карбоксильная.
2. α-аминогруппа.
3. α-карбоксильная.
4. α-аминогруппа.
3.91 В активном центре различают:
1. контактный участок;
2. каталитический участок;
3. регуляторный участок;
4. апофермент, определяющий специфичность фермента.
3.92 Аллостерический центр – это:
1. место присоединения субстрата;
2. место присоединения кофактора;
3. центр регуляции;
4. участок фермента, обеспечивающий присоединение эффекторов.
3.93 Простетическая группа ферментов – это:
1. прочно связанные с активным центром небелковые компоненты;
2. кофакторы, легко вступающие в реакцию и не связанные с активным центром фермента;
3. белковая часть фермента.
3.94 Апофермент – это:
1. белковая часть фермента, не влияющая на ход химических реакций;
2. небелковая часть фермента;
3. часть фермента, обеспечивающая связывание “своего” субстрата;
4. белковая часть фермента.
3.95 Коферменты – это:
1. нуклеотиды, непосредственно участвующие в химической реакции;
2. прочно связанные с активным центром соединения;
3. производные витаминов, участвующие в химческой реакции.
3.96 Для образования фермент-субстратного комплекса необходимо:
1. соответствие конфигураций субстрата и активного центра фермента;
2. комплементарность контактного участка активного центра с кофактором;
3. соответствие апофермента и кофермента;
4. изменение конфигурации субстрата относительно активного центра.
3.97 Могут ли ферменты катализировать реакции, которые термодинамически невозможны вотсутствие фермента?
1. не могут;
2. могут;
3. могут, если эти реакции экзотермические;
4. могут, если эти реакции эндотермические.
3.98 Скорость ферментативной реакции измеряют:
1. по количеству исчезающего субстрата в единицу времени;
2. по изменению количества кофактора фермента;
3. по количеству фермента в пробе;
4. по количеству продукта, образовавшемуся под действием фермента в единицу времени.
3.99 Выберите особенности строения и функционирования аллостерических ферментов:
1. являются лимитирующими ферментами метаболических путей;
2. являются мономерными белками;
3. имеют пространственно разделенный активный и регуляторный центры;
4. при взаимодействии с лигандами не проявляют кооперативный эффект;
5. не проявляют регуляторные свойства при диссоциации молекулы на протомеры.
3.100 Для снятия действия неконкурентного ингибитора используют:
1. увеличесние концентрации субстрата ;
2. реактиваторы;
3. SH-содержащие комплексоны;
4. аналоги субстрата.
3.101 Липаза в жировой ткани может находиться в двух формах – в виде простого белка и фосфопротеина. Объясните механизм изменения активности фермента:
1. аллостерическая регуляция;
2. кооперативный эффект;
3. химическая модификация фермента;
4. ограниченный протеолиз.
3.102 При аллостерическом ингибировании активности ферментов:
1. уменьшается скорость реакции;
2. изменяется конформация фермента;
3. эффектор присоединяется в активном центре фермента;
4. нарушается комплиментарность активного центра субстрату;
5. эффектор присоединяется в аллостерическом центре;
6. изменяется конформация активного центра.
3.103 Участок фермента, стереохимически комплементарный субстрату - это:
1. аллостерический центр;
2. регуляторный центр;
3. активный центр;
4. адсорбционный центр.
3.104 Оптическая специфичность – это:
1. способность фермента действовать на определенные связи в большом количестве субстратов;
2. способность фермента воздействовать на определенный участок субстрата;
3. способность фермента катализировать превращение одного изомера субстрата;
4. способность фермента катализировать реакции одного типа.
3.105 Трансферазы -это:
1. ферменты, катализирующие перенос групп с субстрата на субстрат;
2. ферменты, катализирующие перенос одноуглеродных фрагментов;
3. ферменты, катализирующие перенос групп внутри субстратов;
4. ферменты, катализирующие перенос альдегидных и кетонных группировок.
3.106 В состав активного центра входят:
1. аминокислоты с функциональными группировками;
2. все аминокислоты;
3. определенные аминокислоты, расположенные в полипептидной цепи вдали друг от друга и приближенные друг к другу;
4. несколько аминокислот, расположенных в полипептидной цепи непосредственно друг около друга.
3.107 К особенностям ферментативного катализа относятся:
1. исходная активность при низкой температуре;
2. высокие кинетические параметры;
3. специфичность действия;
4. высокая скорость реакции;
5. разнообразие реакций при отсутствии специфичности.
3.108 Абсолютная специфичность - это:
1. способность фермента воздействовать на определенную часть молекулы субстрата;
2. способность фермента катализировать только одну реакцию;
3. способность фермента катализировать превращение одного субстрата.
3.109 Групповая специфичность – это:
1. способность фермента воздействовать на определенную часть молекулы субстрата;
2. способность фермента катализировать превращения одного субстрата;
3. способность фермента действовать на определенные связи в большом числе субстратов;
4. способность фермента катализировать реакции одного типа.
3.110
 |
По графику зависимости скорости реакции от концентрации субстрата определите Км этого фермента:
1. 0,5
2. 1
3. 1,5
4. 2,5
5. 3
3.111 На рисунке изображен график зависимости скорости реакции от концентрации субстрата.
 |
Определите тип ингибирования:
1. Конкурентное.
2. Неконкурентное.
3. Бесконкурентное.
4. Субстратное.
 |
3.112. На рисунке изображены графики зависимости скорости реакции от концентрации субстрата. А – без действия ингибитора; Б – с добавлением ингибитора.
Определите тип ингибирования:
1. Конкурентное.
2. Неконкурентное.
3. Бесконкурентное.
4. Субстратное.
 3.113. На рисунке изображены графики зависимости скорости реакции от концентрации субстрата. А – без действия ингибитора; Б – с добавлением ингибитора.
3.113. На рисунке изображены графики зависимости скорости реакции от концентрации субстрата. А – без действия ингибитора; Б – с добавлением ингибитора.
Определите тип ингибирования:
5. Конкурентное.
6. Неконкурентное.
7. Бесконкурентное.
8. Субстратное.
Раздел 4. СИНТЕЗ БЕЛКА.
4.1 Укажите последовательность стадий синтеза белка:
1. инициация рибосомального цикла;
2. посттрансляционный процессинг;
3. транскрипция;
4. элонгация рибосомального цикла;
5. терминация рибосомального цикла;
6. посттранскрипционный процессинг.
4.2 Укажите последовательность процессов, идущих на начальной стадии элонгации рибосомального цикла:
1. образование пептидной связи между метионином и аминокислотным радикалом в А-сайте при участии пептидилтрансферазы;
2. в Р-сайте находится метионил-тРНК;
3. в А-сайт присоединяется первая аминоацил-тРНК, соединенная с фактором элонгации и ГТФ;
4. тРНК покидает Р-сайт;
5. пептидилтранслоказа, фактор элонгации и энергия ГТФ участвуют в перемещении рибосомы на 1 триплет;
6. в А-сайт присоединяется вторая аминоацил-тРНК;
7. А-сайт становится свободным.
4.3 Подберите к каждой группе (А, Б, В) соответствующие им соединения (а, б, в, …):
| А. Нуклеозид. | 1. аденин; |
| 2. цитидин 5’-монофосфат; | |
| Б. Азотистое основание. | 3. гуанозин; |
| 4. цитозин; | |
| В. Нуклеотид. | 5. аденозин; |
| 6. уридин; 7. тимидин 5’-монофосфат. |
4.4 Укажите, какие источники энергии используются на отдельных этапах трансляции:
| А Образование пептидных связей. | 1. Энергия АТФ. |
| Б. Присоединение мРНК к малой субъединице рибосомы. | 2. Энергия ГТФ. |
| В. Присоединение метионил-тРНК к мРНК и субчастице рибосомы. | 3. Энергия субстратов. |
| Г. Перемещение рибосомы на мРНК на один кодон. | 4. Без энергии. |
| Д. Освобождение белка с рибосомы. | |
| Е. Присоединение аминоацил-тРНК к аминоацильному участку рибосомы. |
4.5 Укажите необходимые условия для процесса репликации:
А. Субстраты:
1. азотистые основания;
2. дезоксинуклеозидтрифосфаты;
3. дезоксинуклеозидмонофосфаты.
Б. Матрица:
1. иРНК;
2. ДНК
3. пептид
В. Ферменты:
1. РНК-полимераза;
2. ДНК – полимераза;
3. ДНК-зависимая РНК-полимераза;
4. праймаза;
5. АРС-аза.
Г. Источники энергии:
1. нет;
2. ГТФ;
3. дезоксинуклеозидтрифосфаты;
4. дезоксинуклеозидмонофосфаты.
4.6 Укажите условия, необходимые для процесса транскрипции:
А. Матрица:
1. рРНК;
2. тРНК;
3. иРНК;
4. ДНК;
5. аминокислоты;
6. полипептид.
Б. Субстраты:
1. мононуклеотиды;
2. азотистые основания;
3. нуклеозидтрифосфаты;
4. дезоксинуклеозидтрифосфаты.
В. Источники энергии:
1. энергия гидролиза АТФ;
2. энергия гидролиза ГТФ;
3. энергия субстратов.