Сұйықтық фазада хлорлау технологиясы. Процестің жағдайлары және реакторлар түрлері
Галогендеу процестерінің классификциясы және термодинамикалық сипаттамасы. Көмірсутектерді радикалды-тізбекті галогендеу: механизм, талғампаздық.
ГАЛОГЕНИРОВАНИЕ (галоидирование), введение галогена в молекулу орг. соединения. Осуществляют путем р-ций замещения (заместительное галогенирование) или присоединения (присоединительное галогенирование). Заместительное галогенирование. При действии галогенов на насыщ. углеводороды (металепсия) процесс протекает при инициировании светом по свободнорадикальному цепному механизму, напр.:
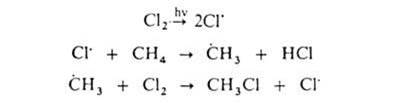
По свободнорадикальному механизму идет также галогенирование углеводородных цепей жирноароматич. соединений. В присут. к-т Льюиса р-ция протекает по электроф. механизму, напр.: 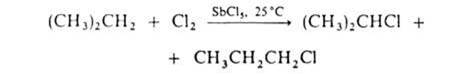
Галогенирование алифатич. карбоновых к-т в-положение проводят с помощью С12 или Вг2 в присут. красного Р (Гелля-Фолъгарда-Зелинского реакция). Замещениеводородных атомов в алифатич. и жирноароматич. карбонильных соед. идет через присоединение галогена к енольной форме, напр.:
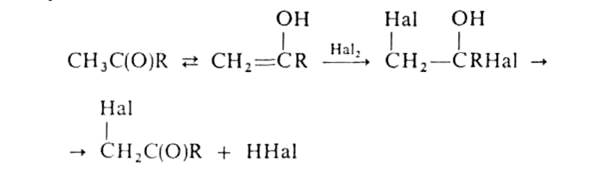 Действием N-галогенамидов, гл. обр. N-бромсукцинимида, в присут. пероксидов осуществляют свободнорадикальное галогенирование олефинов, жирноароматич. и гетероароматич. соед. по метальной или метиленовой группе, соседней с двойной связью или циклом (Воля - Циглера реакция). Замещение атомов Н на F с образованием полифторзамешенных соед. проводят путем электрохим. фторирования в безводном HF (р-ция Саймонса), действием CoF3 и др. Заместительное галогенирование в ядро ароматич. и гетероароматич. соед. протекает по механизму электроф. замещения; обычно его осуществляют с использованием катализаторов (гл. обр. апротонных или протонных к-т), напр.:
Действием N-галогенамидов, гл. обр. N-бромсукцинимида, в присут. пероксидов осуществляют свободнорадикальное галогенирование олефинов, жирноароматич. и гетероароматич. соед. по метальной или метиленовой группе, соседней с двойной связью или циклом (Воля - Циглера реакция). Замещение атомов Н на F с образованием полифторзамешенных соед. проводят путем электрохим. фторирования в безводном HF (р-ция Саймонса), действием CoF3 и др. Заместительное галогенирование в ядро ароматич. и гетероароматич. соед. протекает по механизму электроф. замещения; обычно его осуществляют с использованием катализаторов (гл. обр. апротонных или протонных к-т), напр.:

Если в ядре этих соед. присутствуют пассивирующие заместители, процесс можно проводить действием катиона галогена, образующегося из молекулярного галогена и соли Ag в среде сильной протонной к-ты (р-ция Биркенбаха-Губо-Уотерса), напр.:

Замещение на галоген атомов, отличных от водорода, или группы атомов осуществляется чаще всего по нуклеоф. механизму. В алифатич. соед. для замены атомов галогенов (гл. обр. С1 или Вr) на иод используют Nal (Финкелъштапна реакция), а на фтор-SbF3 (р-ция Свартса). Группы ОН замещают на хлор или бром действием соответствующих галогеноводородов, тригалогенидов или оксигалогенидов фосфора, а также тионилгалогенидов, а на фтор-действием диэтил-1,1,2-трифтор-2-хлорэтиламина или SF4. Карбоксильную группу замещают на С1, Вг или I действием на серебряные соли карбоновых к-т соответствующего галогена (Бородина - Хунсдиккера реакция]. Заменой карбонильного кислорода в альдегидах или кетонах на галоген (напр., с помощью РС15, PBr5, SF4, MoF6) получают геминальные галогензамещенные. В ароматич. ряду для получения галогензамсщеиных используют замену групп NH2 на С1, Вr или I каталитич. разложением соответствующих солей диазония в присут. порошка Сu (Гаттермана-Коха реакция)или действием солей Сu (Зандмепера реакция), а на F-разложением гидрофторидов диазония (Шимана реакция). Для галогенирования ароматич. и гетероароматич. соед. используют также р-цию замещения (в т.ч. обмен галогенов), протекающую по механизму присоединения-отщепления с промежут. образованием анионныхкомплексов, напр.: Легкость заместительного галогенирования действием галогенов уменьшается в ряду F " С1 > Вr > I. Напр., для гомолитич. галогенирования метана до СН3На1 изменение энтальпии в указанном ряду составляет соотв. -418, -105, -31 и + 54 кДж/моль. Из-за высокой экзотермичности фторирование проводят при низких т-рах и разбавлении F2 азотом, а чаще вместо F2 используют фторсодержашие соединения. Иодирование действием I2, как правило, идет с трудом и к тому же резко замедляется из-за обратимости р-ции. Поэтому процесс ведут обычно в присут. окислителей (напр., HgO, HNO3), окисляющих выделяющийся HI до I2, либо солей серебра, связывающих анион I- в виде нерастворимой соли и одновременно обеспечивающих генерирование галогенирования.
Присоединительное галогенирование. К ароматич. и гете-роароматич. соед. галоген присоединяется, как правило, по радикальному механизму под действием света или при нагр., напр.:

Если цикл активирован, р-ция может протекать по ионному механизму, к-рый включает стадию присоединения аниона галогена к промежуточно образующемуся в процессе электроф. замещениякомплексу, напр.:
 Присоединение галогенов по кратной связи происходит по электроф. или радикальному механизму. Его можно осуществлять действием галогсноводородов (см. Гидрогалогенирование), межгалогенных соед. (напр., ClBr, СП) или гипогалогенитов. В случае электроф. присоединения может нарушаться правило Марковникова, что обусловлено образованием промежут. мостикового катиона ф-лы I, напр.
Присоединение галогенов по кратной связи происходит по электроф. или радикальному механизму. Его можно осуществлять действием галогсноводородов (см. Гидрогалогенирование), межгалогенных соед. (напр., ClBr, СП) или гипогалогенитов. В случае электроф. присоединения может нарушаться правило Марковникова, что обусловлено образованием промежут. мостикового катиона ф-лы I, напр.
 : Способность галогенов образовывать такие промежут. катионы возрастает в ряду: F " С1 < Вr < I. Для введения в молекулу атома F широко используют варианты сопряженного присоединения аниона F- и связанного с ним катиона по кратной связи в среде HF, напр.:
: Способность галогенов образовывать такие промежут. катионы возрастает в ряду: F " С1 < Вr < I. Для введения в молекулу атома F широко используют варианты сопряженного присоединения аниона F- и связанного с ним катиона по кратной связи в среде HF, напр.: 
Среди процессов галогенирования широкое распространение получили процессы хлорирования углеводородов. Их ценные свойства и доступность элементарного хлора, необходимого для их получения, способствовали развитию производства хлорорганических соединений-

Фотохимическое хлорирование - процесс хлорирования, ускоряемый действием света. Элементарный механизм этого процесса заключается в активации молекул реагирующих веществ при поглощении фотонов. Под действием лучистой энергии хлор диссоциирует на атомы:  которые затем взаимодействуют с углеводородом (RH). При этом образуется свободный углеводородный радикал R- и отщепляется хлористый водород:
которые затем взаимодействуют с углеводородом (RH). При этом образуется свободный углеводородный радикал R- и отщепляется хлористый водород:
 Углеводородный радикал реагирует с другой молекулой хлора и образует хлорпроизводные углеводорода и один атом хлора и т. д.т Таким образом, хлорирование углеводородов принадлежит к цепным реакциям.
Углеводородный радикал реагирует с другой молекулой хлора и образует хлорпроизводные углеводорода и один атом хлора и т. д.т Таким образом, хлорирование углеводородов принадлежит к цепным реакциям.
Сұйықтық фазада хлорлау технологиясы. Процестің жағдайлары және реакторлар түрлері.
Хлорирование углеводородов проводится в паровой и в жидкой фазах различными способами: при нагревании (термическое хлорирование). в присутствии катализаторов (каталитическое хлорирование), при специальном освещении реагирующих компонентов (фотохимическое хлорирование). Термическое хлорирование обычно применяется для получения хлоридов низших углеводородов. Например, метан реагирует с хлором трудно, поэтому его хлорируют при высокой температуре. Гомологи метана хлорируются легче, чем метан, и при более низких температурах. Каталитическое хлорирование углеводородов проводится чаще всего в жидкой фазе, причем газообразные углеводороды предварительно растворяют в хлорорганических растворителях. Поскольку катализатор снижает энергию активации, в его присутствии хлорирование протекает при более низких температурах, чем при термическом хлорировании. Например, в присутствии катализатора четырех хлористой углерод образуется при 250-300° С; без катализатора в процессе термического хлорирования - при 460° С. Катализаторами служат хлориды металлов (Сu, Sb, Sn, Si) и металлоидов (I, S), нанесенные на высокопористые материалы (пемзу, активированный уголь, силикагель), а также органические соединения - перекись бензоила и некоторые нитрилы. Наиболее активным катализатором является хлорид меди СuС12, нанесенный на пористый носитель (пемзу, силикагель, активированный уголь).
В качестве хлоратора периодического действия используется цилиндрический стальной аппарат освинцованный изнутри, снабженный рубашкой, барботером и трубой передавливания  Рис.5.4. Хлоратор периодического действия: 1 - рубашка; 2 - корпус; 3 - труба передавливания; 4 - барботер хлора; 5 - штуцер загрузки углеводорода.
Рис.5.4. Хлоратор периодического действия: 1 - рубашка; 2 - корпус; 3 - труба передавливания; 4 - барботер хлора; 5 - штуцер загрузки углеводорода.
В аппарат периодически загружается углеводород через штуцер 5, выгрузка производится через трубу передавливания 3. Сообразный хлор подается под слой жидкости с помощью барботера 4.
По способу фирмы «Diamond Alkali Co.» (США) сухой хлор и этилен подают барботированием при 50–80 °С в реактор, заполненный 1,2-дихлорэтаном (рис. 13.69). Для подавления реакции дальнейшего замещения водорода на хлор (образование 1,1,2-трихлорэтана) снижают температуру и вводят ингибиторы — соли металлов переменной валентности, — роль которых состоит также в ускорении основной реакции электрофильного присоединения. В присутствии 0,1 % FeCl3 при 30 °С выход продукта замещения при синтезе 1,2-дихлорэтана снижается с 10 до 1–2 %. Молярное соотношение этилен : хлор сохраняется близким к стехиометрическому; небольшой избыток углерода (~5 %) требуется лишь для того, чтобы повысить степень превращения хлора. Сырой продукт для освобождения от солей железа промывают раствором каустической соды, водой и направляют на ректификацию. Сырой дихлорэтан имеет чистоту 99 % и пригоден для производства перхлорэтилена.
 Схема производства 1,2-дихлорэтана жидкостным хлорированием этилена
Схема производства 1,2-дихлорэтана жидкостным хлорированием этилена
(фирма «Diamond Alkali Co.»):
1 — реактор; 2 — сепаратор; 3 — скруббер; 4 — нейтрализационный декантатор;
5 — промывной декантатор; 6 — промежуточный бак для сырого дихлорэтана;
7 — колонна осушки дихлорэтана; 8 — колонна кондиционирования дихлорэтана;
9 — емкость для хранения дихлорэтана;
I — хлор; II — этилен; III — разбавленная каустическая сода;
IV — в канализацию; V — сдувка; VI — вода; VII — рецикл; VIII — тяжелые концевые фракции
После дистилляции чистота дихлорэтана — 99,9 %. Степень превращения хлора составляет 97 %, селективность по дихлорэтану — 98,5 %. В качестве сырья используют 99% этилен и сухой газообразный электролитический хлор.