ЛУЧШЕ, ЧТОБЫ КИСЛОРОДА В КЛЕТКЕ БЫЛО НЕ СЛИШКОМ МНОГО
Снижение внутриклеточной концентрации кислорода является более кардинальным решением проблемы "кислородной опасности". Хорошо известно, что фермент цитохромоксидаза и другие конечные оксидазы запасающих энергию дыхательных цепей имеют чрезвычайно высокое сродство к кислороду (полумаксимальная скорость наблюдается при концентрации О2 менее 1 x 10-6 М). В то же время "паразитные" процессы образования O2•- представляют собой по существу неферментативные химические реакции, протекающие без специфического связывания О2 . Вот почему скорость "паразитных" реакций линейно снижается с уменьшением концентрации кислорода в широком ее диапазоне (рис. 1). На рис. 1 выделены три области концентраций кислорода. Область А: кислорода слишком мало, чтобы насытить оксидазу (ниже 5 x 10-7 М). Область В : оксидаза уже насыщена кислородом, но его еще недостаточно для обеспечения заметной скорости образования O2•-. Область С : концентрация О2 достаточно высока, чтобы начали накапливаться продукты одноэлектронного восстановления кислорода. Совершенно очевидно, что область В оптимальна для аэробной жизни. Природа использует несколько 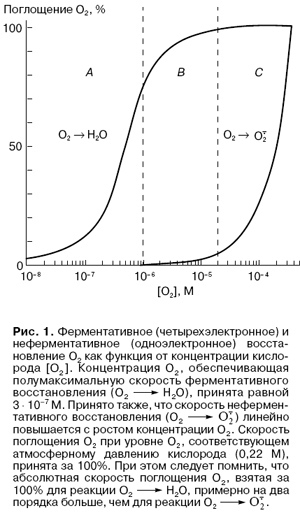 способов, позволяющих находиться в области В, а не А или С.
способов, позволяющих находиться в области В, а не А или С.
У подвижных бактерий эта цель достигается взаимодействием двух антагонистических систем направленного движения клеток (таксиса). Одна из них обусловливает отпугивающее (репеллентное) действие высоких концентраций О2 , что опосредовано специфическим рецептором кислорода с низким сродством к О2 . У бактерии Salmonella thyphimurium полумаксимальный репеллентный эффект наблюдается при уровне О2 , равном 1 x 10-3 М. Что касается эффекта О2 как привлекающего вещества (аттрактанта), здесь участвует совсем другой, гораздо более чувствительный сенсор О2 (полумаксимальный эффект при 7 x 10-7 М кислорода). В результате бактерии собираются в области В, поскольку их проникновение из В в С и А вызывает репеллентный эффект.
У животных снижение вентиляции легких и сужение кровеносных сосудов при переходе от состояния активности к покою можно рассматривать как физиологический ответ, предотвращающий нежелательное повышение уровня О2 в состоянии покоя. Дело в том, что дыхание в клетках животного обычно протекает таким образом, что освобождающаяся энергия накапливается в виде "конвертируемой энергетической валюты клетки" - АТФ. Иными словами, дыхание сопряжено с синтезом АТФ из АДФ и неорганического фосфата:
O2 + AH2 +АТФ + H3PO4 → H2O + A + AТФ, (2)
где АН2 и А - субстрат и продукт окисления.
Образующийся АТФ расщепляется затем каким-либо ферментом, производящим тот или иной вид полезной работы (например, сократительным белком мышц актомиозином):
АТФ → АДФ + H3PO4 + работа. (3)
В состоянии покоя реакция (3) замедляется, концентрации АДФ и фосфата падают и, как следствие, тормозится потребление О2 в реакции (2). Чтобы предотвратить повышение уровня О2 в клетках, сужаются капилляры и замедляется доставка О2 . Однако такого рода макроскопические механизмы имеют весьма существенное ограничение. Так, сужение капилляра должно привести к появлению в ткани кислородного градиента: концентрация О2 будет понижаться по мере удаления от капилляра. В результате клетки, расположенные вблизи капилляра, будут по-прежнему насыщены кислородом, а удаленные от него попадут в анаэробные условия. Чтобы избежать такой неблагоприятной ситуации, было бы желательно дополнить упомянутые выше надклеточные физиологические механизмы какими-то внутриклеточными, биохимическими. Одним из них может быть ослабление сопряженности между дыханием и синтезом АТФ в условиях покоя.
КАК ДЫХАНИЕ ОБРАЗУЕТ АТФ
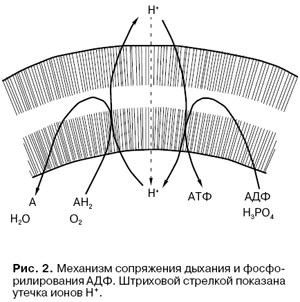 Механизм сопряжения дыхания и фосфорилирования АДФ неорганическим фосфатом в клетках животных, растений, грибов и большинства бактерий показан на рис. 2. Энергия дыхания сначала используется для перекачки сквозь мембрану ионов Н+. При этом ионы Н+ переносятся как бы "в гору" - в сторону большей их концентрации (при этом создается разность химических потенциалов ионов Н+) и против электрических сил, то есть от минуса к плюсу (создается разность электрических потенциалов). Этот процесс катализируется дыхательными ферментами. Другой фермент, встроенный в ту же мембрану, а именно протонная АТФ-синтаза, разрешает ионам Н+ вернуться назад, "под гору", но при обязательном условии, что это возвращение приведет к синтезу АТФ. Таким образом, последовательность событий может быть описана уравнением
Механизм сопряжения дыхания и фосфорилирования АДФ неорганическим фосфатом в клетках животных, растений, грибов и большинства бактерий показан на рис. 2. Энергия дыхания сначала используется для перекачки сквозь мембрану ионов Н+. При этом ионы Н+ переносятся как бы "в гору" - в сторону большей их концентрации (при этом создается разность химических потенциалов ионов Н+) и против электрических сил, то есть от минуса к плюсу (создается разность электрических потенциалов). Этот процесс катализируется дыхательными ферментами. Другой фермент, встроенный в ту же мембрану, а именно протонная АТФ-синтаза, разрешает ионам Н+ вернуться назад, "под гору", но при обязательном условии, что это возвращение приведет к синтезу АТФ. Таким образом, последовательность событий может быть описана уравнением
Дыхание → ΔμH+ → АТФ, (4)
где ΔμH+ - разность электрохимических потенциалов ионов Н + на мембране митохондрий или бактерий.
В состоянии покоя, когда протекание АТФ-синтазной реакции тормозится из-за нехватки АДФ, дыхание должно прекратиться, поскольку образуемая ΔμH+, которая уже не потребляется Н+ - АТФ-синтазным механизмом, возрастает до таких величин, когда дальнейший перенос Н+ "в гору" оказывается термодинамически невозможным. Это происходит потому, что выигрыш в энергии от окисления субстратов кислородом становится меньшим, чем проигрыш в энергии от переноса Н+ в более кислый и заряженный положительно отсек (на рис. 2 - вверх).