На рисунке показана фазовая диаграмма воды. Укажите на диаграмме точки, характеризующие равновесие жидкой и паровой фаз.
Тесты для студентов
Тесты по разделу «Электрохимия»
1. Электролиз расплава хлорида натрия описывается суммарным уравнением:
1)NaCl → Na+ + Cl-
2)NaCl → Na + Cl
3)2NaCl → 2Na + Cl2
4)2NaCl + H2O → Na2О + Cl2 + H2
5)NaCl + Н2О → NaOH + Cl2 + H2
2. При электролизе водного раствора хлорида калия на инертном аноде выделяется :
1)вода
2)кислород
3)водород
4)хлор
5)гидроксид калия
3. Количественно процессы электролиза подчиняются законам
1)Ньютона
2)Ампера
3)Фарадея
4)Ома
5)Кулона
4. Процесс, протекающий при электролизе раствора сульфата натрия на платиновом аноде, описывается уравнением:
1)Na+ + 1ē →Na0
2)2H2O + 2ē → H2 + 2OH-
3)Pt - 2ē → Pt2+
4)2H2O - 4ē → 4H+ + O2
5)Na - 1ē → Na+
5. Процесс, протекающий при электролизе раствора сульфата никеля на никелевом аноде описывается уравнением:
1)2SO42- - 2 ē→ S4O82-
2)2H2O - 4 ē → O2 +4H+
3)Ni - 2 ē → Ni2+
4)2H2O +2 ē → H2 + 2OH-
5)Ni2+ + 2 ē → Ni0
6. Процесс, протекающий при электролизе раствора хлорида меди(II) на платиновом аноде, описывается уравнением
1)2Cl- -2 ē→ Cl2
2)2H2O - 4 ē → O2 + 4H+
3)Pt - 2 ē →Pt2+
4)Cu2+ + 2 ē → Cu0
5)Cu - 2 ē →Cu2+
7. При электролизе водного раствора смеси солей CuCl2, KCl, AlCl3 на катоде протекает процесс:
1)Cu2+ + 2 ē → Cu0
2)K+ + 1 ē → K
3)Al3+ + 3 ē →Al
4)2Cl- - 2 ē →Cl2
5)2H2O - 4 ē → 4H+ + O2
8. На электродах гальванического элемента Якоби-Даниэля, состоящего из цинковой и медной пластин, протекают следующие процессы:
1)A: Cu - 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn
2)A: Zn - 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
3)A: Cu - 2 ē → Cu2+ K: 2H+ + 2 ē → H2
4)A: Zn - 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)A: Zn - 2 ē → Zn2+ K: 2H+ + 2 ē → H2
9. На электродах гальванического элемента Якоби-Даниэля, состоящего из серебряной и свинцовой пластин, протекают следующие процессы:
1)A: Pb - 2 ē → Pb2+ K: Ag+ + 1 ē →Ag
2)A: Ag - 1 ē → Ag+ K: Pb2+ + 2 ē → Pb
3)A: Pb - 2 ē → Pb2+ K: 2H+ + 2 ē → H2
4)A: Pb - 2 ē → Pb2+ K: 2H2O - 4 ē →O2 + 4H+
5)A: Sn - 2 ē → Sn2+ K: Ag+ + 1 ē →Ag0
10. Гальванический элемент Вольта состоит из цинковой и медной пластин, опущенных в раствор серной кислоты. На электродах этого гальванического элемента протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
2)А: Cu – 2 ē → Cu2+ K: 2H+ + 2 ē → H2
3)А: Zn – 2 ē → Zn2+ K: Cu2+ + 2 ē → Cu
4)А: Zn – 2 ē → Zn2+ K: 2H2O - 4 ē → O2 + 4H+
5)А: Cu – 2 ē → Cu2+ K: Zn2+ + 2 ē → Zn0
11. На электродах гальванического элемента Якоби-Даниэля., состоящего из цинковой и железной пластин, протекают следующие процессы:
1)А: Zn – 2 ē → Zn2+ K: Fe2+ + 2 ē → Fe
2)А: Zn – 2 ē → Zn2+ K: 2H+ + 2 ē → H2
3)А: Fe – 2 ē → Fe2+ K: 2H+ + 2 ē → H2
4)А: Fe – 2 e → Fe2+ K: Zn2+ + 2e → Zn
5)А: Fe – 2e → Fe2+ K 2H2O + O2 +4e → 4OH-
12. Наибольшую э.д.с. имеет гальванический элемент:
1)Zn / ZnCl2, 1M // CdCl2, 1M /Cd
2)Cd / CdNO3, 1M // AgNO3, 1M / Cd
3)Zn / ZnSO4, 1M // NiSO4, 1M / Ni
4)Mg / Mg(NO3)2, 1M // AgNO3, 1M / Ag
5)Mg / MgSO4, 1M // FeSO4, 1M / Fe
13. В гальваническом элементе Якоби-Даниэля при 298 К установилось равновесие :
Zn + 2Ag+ ←→ Zn2+ + 2Ag
Концентрация ионов Zn2+ составляет 0,01моль/л, концентрация ионов Ag+ составляет 0,001 моль/л. Э.д.с. данного гальванического элемента равна:
1)1,0 В
2)-1,44 В
3)1,44 В
4)1,56 В
5)0,04 В
14. Э.д.с. гальванического элемента
Zn / ZnSO4, 0,000001 M // ZnSO4, 0,01 M /Zn равна:
1)0,76 В
2)0,06 В
3)0,12 В
4)0,24 В
5)0,18 В
15. Краткая схема гальванического элемента Якоби-Даниэля имеет вид:
Zn / ZnSO4, 1M // CuSO4, 1M / Cu
Э.д.с. данного гальванического элемента равна:
1)0,32 В
2)1,1 В
3)-1,1 В
4)-0,32 В
5)0,5 В
16. Процессы, протекающие при контактной коррозии магния и железа в нейтральной водной среде, описываются уравнениями
1)А: Mg – 2e → Mg2+ K: 2H2O + O2 – 4e → 4OH-
2)А: Mg – 2e → Mg2+ K: 2H+ + 2e → H2
3)А: Mg – 2e → Mg2+ K: Fe2+ + 2e → Fe
4)А: Fe – 2e → Fe2+ K: 2H+ + 2e → H2
5)А: Fe – 2e → Fe2+ K: 2H2O + O2 –4e → 4OH-
17.Для протекторной защиты железа от коррозии в нейтральной водной среде применяется:
1)серебро
2)цинк
3)медь
4)олово
5)свинец
18. Металлом, наиболее подверженным электрохимической коррозии при контакте с оловом, является:
1)магний
2)свинец
3)кобальт
4)железо
5)медь
19. Электрохимическая коррозия железа в нейтральной водной среде описывается уравнением:
1)4Fe + 3O2 + 6H2O = 4Fe(OH)3
2)4Fe + 3O2 = 2Fe2O3
3)Fe + 3Cl2 = 2FeCl3
4)3Fe + C = Fe3C
5)3Fe + Si + Fe3Si
20. Процессы, протекающие при коррозии оцинкованного железа во влажном воздухе, описываются уравнениями:
1)А: Zn – 2e → Zn2+
K: Fe2+ + 2e → Fe
2)А: Zn – 2e → Zn2+
K: 2H+ + 2e → H2
3)А: Zn – 2e → Zn2+
K: 2H2O + O2 – 4e → 4OH-
4)А: Fe – 2e → Fe2+
K: 2H2O + O2 –4e → 4OH-
5)А:Fe – 2e → Fe2+
K: 2H+ + 2e → H2
21. Уравнение, отвечающее электрохимической коррозии металла:
1) 2Mg + O2 = 2MgO
2) Sn + O2 = SnO2
3) 2Zn + O2 + 2H2O = 2Zn(OH)2
4) 2Pb + O2 = 2PbO
5) 4Fe + 3O2 = 2Fe2O3
22. Процесс отвода электронов с катодных участков при электрохимической коррозии называется:
1)деполяризацией
2)ионизацией
3)диссоциацией
4)аэрацией
5)катодной защитой
23. Металлом, который может служить анодным покрытием на железе, является:
1)свинец
2)олово
3)медь
4)серебро
5)магний
24. Процесс коррозии лужёного железа в кислой среде при нарушении целостности покрытия описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
4)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
5)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
25. Атмосферная коррозия лужёного железа (покрытого тонким слоем олова) описывается уравнениями:
1)А: Fe – 2ē → Fe2+ K: 2H2O + O2 +4ē → 4OH-
2)А: Fe – 2ē → Fe2+ K: 2H+ + 2ē → H2
3)А: Sn – 2ē → Sn2+ K: 2H2O + O2 +4ē → 4OH-
4)А: Sn – 2ē → Sn2+ K: 2H+ + 2ē → H2
5)А: Fe – 2ē → Fe2+ K: Sn2+ + 2ē → Sn
Тесты по разделу «Химическая связь»
1. Между атомами элементов с порядковыми номерами 3 и 9 образуется химическая связь
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
5) донорно-акцепторная
2. Наименее прочная химическая связь
1) ионная
2) водородная
3) металлическая
4) ковалентная полярная
5) ковалентная неполярная
3. При образовании молекулы хлороводорода перекрываются орбитали
1) р и d
2) р и р
3) s и р
4) s и s
5) s и d
4. При гибридизации одной одной s- и одной р-орбиталей образуются
1) две гибридные sр2-орбитали
2) одна гибридная sр-орбиталь
3) две гибридные sр-орбитали
4) одна гибридная sр2-орбитали
5) три гибридные sр-орбитали
5. Между молекулами воды образуется вид связи
1) ионный
2) водородный
3) металлический
4) донорно-акцепторный
5) ковалентная неполярный
6.Между молекулами этилового спирта образуется вид связи
1) ионный
2) водородный
3) металлический
4) донорно-акцепторный
5) ковалентная неполярный
7. Последовательность заполнения молекулярных орбиталей в порядке возрастания их энергии σs<σs*<σz<πх=πу<πх*=πу*<σz* характерна для молекулы
1) Н2O
2) НCl
3) O2
4) CO
5) ВN
8. Последовательность заполнения молекулярных орбиталей в порядке возрастания их энергии σs<σs*<πх=πу<σz <πх*=πу*<σz* характерна для молекулы
1) Н2
2) Cl2
3) O2
4) CO
5) N2
9. Кратность связи в молекуле О2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
10. Кратность связи в молекуле N2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
11. Кратность связи в молекуле Н2 равна
1) 1
2) 2
3) 3
4) 5
5) 0
12. В хлориде аммония отсутствуют связи
1) ионные
2) донорно-акцепторные
3) ковалентные полярные
4) ковалентные неполярные
5) водородные
13. Ковалентную неполярную связь имеет
1) Н2О
2) СО
3) Н2
4) КОН
5) Сu
14. Ковалентную полярную связь имеет
1) Cl2
2) O2
3) Н2
4) НСl
5) N2
15. Наибольшую склонность к образованию ионных связей проявляет элемент
1) N
2) Si
3) C
4) S
5) F
16. Геометрическая форма молекулы метана СН4
1) пирамидальная
2) тетраэдрическая
3) треугольная
4) угловая
5) линейная
17. Угол 109028/ образуется между гибридными
1) sр-орбиталями
2) sр2-орбиталями
3) sр3-орбиталями
4) sр3d2-орбиталями
5) sd-орбиталями
18. Угол 1200 характерен для
1) пирамидальной молекулы
2) тетраэдрической молекулы
3) треугольной молекулы
4) угловой молекулы
5) линейной молекулы
19. Угол 109028/ характерен для
1) пирамидальной молекулы
2) тетраэдрической молекулы
3) треугольной молекулы
4) угловой молекулы
5) линейной молекулы
20. Геометрическая форма молекулы аммиака NH3
1) тетраэдрическая
2) пирамидальная
3) треугольная
4) угловая
5) линейная
21. Прочность и полярность связи в ряду молекул HF→HCl→НВr→HJ изменяются:
1) как прочность, так и полярность связи увеличивается
2) прочность уменьшается, полярность увеличивается
3) как прочность, так и полярность связи уменьшаются
4) прочность увеличивается, полярность уменьшается
5) прочность и полярность связи сначала увеличивается, затем уменьшается
22. π-связь образуется при перекрывании
1) вдоль оси s-орбиталей
2) вдоль оси р-орбиталей
3) вдоль оси s-и р-орбиталей
4) р-орбиталей, оси которых параллельны
5) d-орбиталей, находящихся в двух параллельных плоскостях
23. Две π-связи имеет молекула
1) Н2О
2) СО2
3) NH3
4) O2
5) HCl
24. Двойную связь имеет молекула
1) Н2О
2) С2Н6
3) NH3
4) O2
5) HCl
25. Тройную связь имеет молекула
1) Н2О
2) СО2
3) NH3
4) C2Н2
5) HCl
26. Трехцентровую связь имеет молекула
1) Н2О
2) НNО3
3) NH3
4) O2
5) HCl
27. Линейную форму имеет молекула
1) OF2
2) ВeCl2
3) H2O
4) AlCl3
5) CH4
28. Пирамидальную форму имеет молекула
1) NH3
2) ВeCl2
3) H2O
4) AlCl3
5) CH4
29. Число σ-связей в три раза больше числа π-связей
1) хлороводородной кислоты
2) сернистой кислоты
3) ортофосфорной кислоты
4) хлористой кислоты
5) бромистоводородной кислоты
30 Все связи ковалентные неполярные в молекуле
1) СО2
2) С2Н6
3) С2Н2
4) Н2О2
5) О2
31. Парамагнитной является молекула
1) F2
2) O2
3) Cl2
4) N2
5) H2
32. В молекуле аммиака NH3 число связывающих электронных пар равно
1) 2
2) 3
3) 1
4) 0
5) 4
33. В молекуле аммиака NH3 число несвязывающих электронных пар равно
1) 2
2) 3
3) 1
4) 0
5) 4
34. Формулы соединений только с ковалентной связью представлены в ряду
1) N2, КNO3
2) КСl, CuSO4
3) H2O, СН3СООН
4) ВаСl2, КF
5) КВr, О2
Тесты по разделу «Полимеры»
1.Карбоцепным является полимер:
1) (-СF2-)n -тефлон
2) (-CH2O-)n-полифоральдегид
3) (-MeO-)n-оксиды металлов
4) (-ЅιO2-)n-двуокись кремния
5) (-S-)n-сера
2.Гетероцепным полимером является:
1) (-СН2-)n-полиэтилен
2) (-СН2-СClH-)n-поливинилхлорид
3) (СН2-С(СН3)2-)-полиизобутилен
4) (-СН2-СН-F-)n –поливинилфторид
5) (-СН2-СН2О-)n-полиэтиленоксид
3.Полимерами не являются:
1) Вещества, получаемые методами поликонденсации
2) Вещества, получаемые методами полимеризации
3) Вещества, получаемые методами полимераналогичных превращений
4) Продукты взаимодействия щелочей с минеральными кислотами
5) Вещества, получаемые реакциями полиприсоединения
4 Наиболее устойчивым полимером является:
Тефлон ( Фторпласт-4)
2)Белок
3)Полиэтилен
4)Каучук
5)Крахмал
5. При нагревании термопласты:
1)Только разлагаются
2)Переходят в вязкотекучее состояние практически без разложения
3)Испаряются
4)Кристаллизуются
5)Обугливаются
6.Природным полимером является:
1)Желатин
2)Органическое стекло
3)Лавсан
4)Полиэтилен
5)Фторопласт-4
7.Органические ВМС содержат в своем составе:
1)Только углерод
2)Углерод, водород, кремний и водород
4)Углерод, водород, азот, кислород и серу
5)Кремний, фосфор, серу
8.При реакции поликонденсации не образуются:
1) Поликарбонаты
2) Полипептиды
3) Полиэфиры
4) Водород
5) Полиамиды
9. К сетчатым полимерам не относятся:
1) Лавсан
2) Тефлон
3) Резина
4) Клетчатка
5) Нейлон
10. Поликонденсационные ВМС могут быть получены реакциями взаимодействия:
1) Этилена и изобутилена
2) Стирола и соляной кислоты
3) Этилендиамина и уксусной кислоты
4) Гексаметилендиамина и адипиновой кислоты
5) Адипиновой кислоты и метанола
11. Степень полимеризации это:
1) Отношение среднего молекулярного веса полимера к молекулярному весу мономера
2) Отношение молекулярного веса полимера к молекулярному весу мономера
3) Молекулярный вес полимера
4) Молекулярный вес мономера
5) Количество молей полимера
12. При полимеризации метилметакрилата - СН2=С(СН3)СООСН3 образуется:
1) Полиметилметакрилат
2) Метанол
3) Полиакрилонитрил
4) Каучук
5) Лавсан
13. При обработке полистирола серной кислотой образуется:
1) Бензолсульфокислота
2) Сульфированный полистирол
3) Стирол
4) Бензол
5) Винилбензол
14. При гидролизе капрона образуются:
1) Капроновая кислота
2) Капролактам
3) Полиамид
4) Валериановая кислота
5) Азотная кислота
15. Пенополиуретаны это:
1) Пенополиэтилен
2) Вспененные полиуретаны
3) Пенополистирол
4) Поронит
5) Плексиглас
16. Силиконы это:
1) Силикаты
2) Диалкилдихлорсиланы
3) Полисилоксаны
4) Диарилдихлорсиланы
5) Алкиларилдихлорсиланы
17. Натуральный каучук это:
1) Транс-полиизопрен
2) Цис-полиизопрен
3) Полибутадиен
4) Гуттаперча
5) Наирит
18. При нитровании клетчатки не образуется:
1) Вода
2) Пироксилин
3) Динитроклетчатка
4) Целлофан
5) Мононитроклетчатка
19. Лавсан (терилен) образуется при взаимодействии:
1) Диметилтерефталата с этиленгликолем
2) Этиленгликоля с фталиевой кислтой
3) Окиси этилена с диметилтерефталатом
4) Адипиновой кислоты с этиленглиголем
5) Фталевого ангидрида с глицерином
20. При нагревании термореактивных ВМС не образуются:
1) Низкомолекулярные продукты
2) Углистые вещества
3) Продукты уплотнения
4) Термопластичные ВМС
5) Продукты полимераналогичных превращений
21. При реакции поликонденсации формальдегида с фенолом не образуется:
1) Резол
2) Резит
3) Резина
4) Фенолформальдегидные смолы
5) Вода
22. При гидролизе поливинилацетата обрауется:
1) Виниловый спирт
2) Поливиниловый спирт
3) Окись этилена
4) Уксусный альдегид
5) Уксусный ангидрид
23. При полном сгорании полиэтилена образуются:
1) СО2 и Н2О
2) Н2О2
3) Н2 и О2
4) Сажа
5) Олигомеры
24. Реакция радикальной полимеризации осуществляется под действием:
1) Инициаторов радикальной полимеризации
2) Оснований Льюиса
3) Кислот Льюиса
4) Минеральных кислот
5) Металлорганических соединений
25. Полиамиды получаются при взаимодействии:
1) Двухосновных кислот и гликолей
2) Диаминов с альдегидами
3) Аминокислот с минеральными кислотами
4) Диаминов с двухосновными кислотами
5) Диаминов с азотистой кислотой
Тесты к разделу «Физикохимический анализ»
На рисунке показана фазовая диаграмма воды. Укажите на диаграмме точки, характеризующие равновесие жидкой и паровой фаз.

| 1) A 2) В и С 3) Е 4) С 5) О и Е |
На рис. приведена диаграмма состояния системы компонентов M и N. Укажите на диаграмме точки, отвечающие равновесию жидкого сплава и кристаллов химического соединения MN.
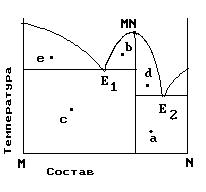
| 1) только c 2) b и d 3) a и b 4) e и a 5) c и d |
На рис. приведена диаграмма состояния системы А-В. Укажите на диаграмме область однородного расплава.
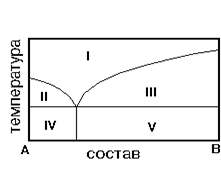
1) IV 2) I3) II 4) V 5) III