Рефрактометричний метод аналізу
Класифікація фізико-хімічних методів.
В залежності від використаних властивостей розрізняють наступні групи фізико-хімічних методів:
І. Оптичні методи, базуються на дослідженні оптичних властивостей системи, що аналізуються
1. Рефрактометричний метод,
2. Фотометричний метод,
3. Поляриметричний метод,
4. Люмінесцентний метод,
5. Спектральний метод,
6. Турбідиметричний метод,
7. Нефелометричний метод.
ІІ. Електрохімічні методи, базуються на дослідженні електрохімічних властивостей систем, що аналізуються
1. Електроліз,
2. Кондуктометричний метод,
3. Потенціометричний метод,
4. Полярографічні методи.
ІІІ. Методи аналізу розділення найважливіші:
- екстракція,
- іонний обмін,
- хроматографія.
I. Оптичні методи фізико-хімічного аналізу
В основі цих методів лежить взаємозв’язок між складом хімічної системи і будь-яким фізичним параметром її, що може змінюватись у процесі хімічної реакції, тобто у фізико-хімічних методах аналізу використовуються хімічні реакції, протікання яких супроводжується зміною фізичних властивостей (параметрів) речовини. До таких параметрів відносяться: оптична густина (“D”), показник заломлення (“n”), кут обертання площини поляризації(“-b”), інтенсивність розсіяного світла суспензією (“I роз”), інтенсивність послабленого світлового потоку суспензією (Iпосл).
Рефрактометричний метод аналізу
Метод рефрактометрії заснований на залежності речовин та їх розчинів заломлювати промінь світла під час переходу його з одного середовища в інше.
Заломлення світла оцінюється за величиною показника заломлення “n”, який дорівнює відношенню синуса кута падіння “a” променя світла до синуса кута його заломлення“b”:
n = 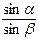 .
.
Величина показника заломлення ”n” залежить від складу індивідуальних компонентів системи, від концентрації окремих молекул, що по-різному можуть поляризуватися променем світла, від довжини хвилі падаючого світла, температури.
Показник заломлення характеризує мольну і питому рефракції. Залежність показника заломлення від густини речовини характеризується рівнянням:
¦(n) = r d,
де r – коефіцієнт пропорційності, який називається питомою рефракцією;
d – густина речовини, г/см3
Як видно з формули, не сам показник заломлення, а деяка функція від нього знаходиться в лінійній залежності від густини речовини d, г/см3. Функція показника заломлення характеризується відношенням:
¦(n) = 
 ,
,
можна записати, що  = r d,
= r d,
звідки: r = 
 см 3/г (формула питомої рефракції Лорентца).
см 3/г (формула питомої рефракції Лорентца).
Помножуючи величину питомої рефракції на мольну масу речовини, одержуємо мольну рефракцію R:
R = r M = 
 см3/моль.
см3/моль.
Величина мольної рефракції визначається інтенсивністю поляризації молекул речовини. Оскільки поляризація молекул показує сумарний процес поляризації атомів, які входять до складу молекули, то кількісне значення мольної рефракції повинно дорівнювати сумі атомних рефракцій. Таким чином, мольна рефракція має адитивні властивості.
Правило адитивності (сумарності) полягає в тому, що сума атомних рефракцій елементів, що входять до складу сполуки, дорівнює мольній рефракції даної сполуки; мольна рефракція суміші дорівнює сумі мольних рефракцій складових частин цієї суміші. Наприклад, мольна рефракція розчину дорівнює сумі мольних рефракцій розчинника та розчиненої речовини:
Rрозчину = Rрозчинника Nрозчинника + Rрозчиненої речовини Nрозчиненої речовини,
де Nрозчинника і Nрозчиненої речовини – мольні долі розчинника і розчиненої речовини.
Адитивність мольної рефракції використовують для визначення рефракції молекул і атомів. Наприклад, рефракція групи “СН2” може бути визначена за різницею рефракцій: С7Н16 – С6Н14:
RСН2 = RС7Н16 – RС6Н14
Атомну рефракцію вуглецю обчислюють за різницею RС = RСН2 – 2RН.
Застосування методу. Мольна рефракція широко використовується для фізико-хімічних розрахунків, встановлення будови речовини, ідентифікації органічних речовин.
Для визначення вмісту цукру, спирту в розчині за показником заломлення використовують лінійну залежність показника заломлення від вмісту цукру, спирту. Калібрувальний графік будують у координатах показник заломлення – концентрація.
n 
1.4
1.333
0 20 40 С,%
Рис.1.Калібрувальний графік для визначення цукру.
Метод рефрактометрії застосовують для визначення зв’язаної води в різноманітних продуктах, досліджують цим методом жири, томатні продукти, варення, джеми, деякі види консервів та інше.
Колориметрія
В основі фотометричного методу аналізу лежить вимірювання поглинання поліхроматичного випромінювання видимої частини спектру. Залежність інтенсивності світлопоглинання (оптичної густини) розчину від концентрації речовини і товщини поглинального шару відома під назвою закону Бугера-Ламберта-Бера – основного закону світлопоглинання.
Залежність ця виражається рівнянням:
 ,
,
де D – оптична густина;
I0 – інтенсивність падаючого світла;
It– інтенсивність світла, що пройшло через розчин;
ε – константа, коефіцієнт поглинання;
b – товщина поглинального шару, см;
С – концентрація розчину, моль/л.
Графічна залежність оптичної густини від концентрації виражається прямою (мал. 1):
 D
D
Dx
Сх С, (моль/л)
Рис.1. Залежність оптичної густини від концентрації розчину.
При фотоелектроколориметричному визначенні концентрації речовини застосовують такі методи:
Метод порівняння. Вимірюють оптичну густину досліджуваного (Dх) і стандартного (Dст) забарвлених розчинів при одній і тій же товщині шару.
Dст =εbСст і Dх = εbСх
звідки:  .
.
Метод калібрувального графіка. Вимірюють оптичні густини стандартних розчинів з відомою концентрацією і будують залежність у координатах D – С (рис. 1).
Метод добавок. Вимірюють оптичну густину Dх досліджуваного розчину. Потім до нього додають відому кількість стандартного розчину речовини (добавку), що визначається, і вимірюють оптичну густину Dх + а.
Згідно основного закону світлопоглинання, можна записати:
Dх = εbСх; Dх + а = εb (Сх + Са)
Звідси - Сх :  ,
,
де Са – концентрація добавки.
Застосування методу:
Метод широко використовують для кількісного визначення кольорових металів, цукрів, білків, спиртів, вітамінів, ферментів, гормонів, пластмас, барвників.
Поляриметрія
У відповідності з електромагнітною теорією світла коливання світлових хвиль у пучку природного світла здійснюється у всіх площинах, перпендикулярних до напрямку руху променя (поперечні коливання).
 | |||
 | |||
(а) неполяризоване світло; (б) поляризоване світло (1- площина поляризації; 2 – площина коливань
Якщо поперечні коливання світлових хвиль здійснюються тільки в одній площині, то такий промінь світла називається поляризованим. Площина, в якій здійснюється коливання променя, називається площиною коливання променя, а площина, перпендикулярна до неї, - площиною поляризації.
При проходженні поляризованого світла через оптично активне середовище може виникнути два ефекти:
1) обертання площини поляризації;
2) розклад плоскополяризованого променя на два компоненти, що обертаються в різні боки.
Оптичноактивні речовини, що обертають площину поляризації за годинниковою стрілкою, називаються право обертаючими (кут має знак (+)); речовини, які обертають площину поляризації проти годинникової стрілки, – ліво обертаючими (кут має знак (–)).
Речовини, здатні обертати площину поляризації світла, називаються оптично активними речовинами.
Оптична активність речовин обумовлюється двома факторами: особливостями структури кристалічної решітки речовини та особливостями будови її молекули.
До першого типу відносяться тверді речовини, наприклад, кристали кварцу, хлорату натрію та ін.
Речовини другого типу проявляють оптичну активність лише у розчиненому або газоподібному стані. До цієї категорії сполук відносяться, головним чином, органічні речовини, які містять у своїй молекулі асиметричні атоми вуглецю. Це глюкоза, винна кислота, морфін та ін. Оптично активні молекули не мають центра і площини симетрії.
Метод аналізу, який ґрунтується на вимірюванні кута обертання (β) площини поляризації променя світла, що пройшов через оптично активне середовище, називається поляриметричним.
Основною частиною приладу для поляриметричних вимірювань є поляризатор і аналізатор. Якщо вони встановлені взаємопаралельно, то промінь світла проходить крізь них, оскільки промені, які пройшли крізь поляризатор, мають площину коливань, перпендикулярну до площини пропускання променів аналізатором (А)
 |
А
тому якщо аналізатор повернути на 900 , то промені не можуть пройти крізь нього. Таке положення приладу називають установкою його на “темряву”(Б).
 |
Б
Якщо між ними поставити розчин оптично активної речовини, то в аналізаторі з’явиться світло (промінь світла, який виходить з розчину, коливається вже не в площині, перпендикулярній до площини аналізатора, а в деякій площині МN і може бути розкладений за правилом паралелограма на два промені OS i OR. OR коливається в площині пропускання променів аналізатором (В). Щоб знову досягти попереднього стану приладу, необхідно аналізатор повернути так, щоб площина його стала перпендикулярною до площини МN, тобто на кут обертання площини поляризації. Він залежить від товщини поглинального шару, концентрації розчину та індивідуальних властивостей оптично-активних речовин.
 |
 В
В
Це виражається рівнянням:

 β = ± α b C = ±(α b C1)/100,
β = ± α b C = ±(α b C1)/100,
де β – кут обертання площини поляризації;
α - питома обертання площини поляризації;
b – товщина шару, дм;
С – концентрація, г/100мл;
С1 – концентрація, г/мл.
Питоме обертання площини поляризації дорівнює куту обертання (у градусах) площини поляризації, яке викликає розчин, що містить 1 г/мл оптично активної речовини при товщині шару 10 дм, є мірою оптичної активності даної речовини.
Використовується у цукровій, кондитерській промисловості для визначення вмісту цукристих речовин. У масложировій промисловості його поєднують з рефрактометричним методом для ідентифікації олій. Деякі з них мають однакові показники заломлення, але різко відрізняються за значенням питомого обертання площини поляризації:
М'ятна олія: n – 1,486; а = -340
Кропова олія: n – 1,486; а = +1700
У фармацевтичному виробництві поляриметрію застосовують для ідентифікації лікарських препаратів. Так, камфора, вилучена з камфорного базиліка, дає в спирті правообертальний розчин з питомим обертанням +860, деякі сорти камфори, вилученої з полину – лівообертальний розчин (-8,60), синтетична камфора взагалі не обертає площину поляризації.
Для дослідницьких цілей поляриметричний метод використовують у мінерології міркохімії, а також пир вивченні кінетики процесів, у яких беруть участь оптично-активні речовини.