Экспериментальное определение тепловых эффектов химических реакций
Глава 1. Энергетика химических реакций
Врач в своей работе постоянно имеет дело с физическими и химическими процессами, протекающими в организме как здорового, так и больного человека. Эти процессы неразрывно связаны с изменениями общей энергетики живого организма, пополняемой за счет потребляемой пищи и солнечного излучения и расходуемой при теплообмене с окружающей средой и совершении работы.
Впервые взаимосвязь химических превращений и энергетических процессов в организме была продемонстрирована А. Лавуазье (1743 – 1794) и П. Лапласом (1749 – 1827), которые показали, что энергия, выделяемая в процессе жизнедеятельности, есть результат окисления продуктов питания кислородом вдыхаемого воздуха.
С развитием классической термодинамики в XIX – XX вв. появилась возможность рассчитывать энергетические превращения в биохимических процессах и предсказывать их направление.
Область науки, занимающаяся изучением трансформации энергии в живых организмах, называется биоэнергетикой. Эта наука, в частности, позволяет ответить на следующие вопросы:
1) Какова калорийность пищи?
2) Какое количество теплоты теряется при потоотделении?
3) Какую работу совершает организм в состоянии покоя (вентиляция лёгких) и при физической нагрузке (растяжение и сокращение мышц)?
Кроме того, знание термодинамических закономерностей процессов обмена веществ и энергии в организме человека может быть использовано для диагностики ряда заболеваний (онкологических, деструктивных, эмбриональных и др.), для которых термодинамические параметры изменяются в зависимости от течения процесса (нормальный или патологический).
Основы термодинамики
Термодинамика - это наука, которая изучает взаимные превращения теплоты и работы. Химическая термодинамика применяет термодинамические методы для решения химических задач, т.е. для теоретического описания различных видов химических или фазовых равновесий и свойств веществ в растворах.
Основная физическая величина, используемая в термодинамике, - это энергия. Весь математический аппарат термодинамики построен назаконе сохранения энергии:
Энергия не создаётся из ничего и не может превратиться в ничто; если в ходе процесса исчезает энергия определённого вида, то взамен появляется эквивалентное количество энергии другого вида.
Объект внимания термодинамики – внутренняя энергия.
Внутренняя энергия U системы - это суммарная энергия всех её составных частей, (в том числе молекул, атомов, электронов, ядер, внутриядерных частиц и т.д.)[1]. Она складывается из кинетической энергии их движения, потенциальной энергии их взаимодействия между собой, а также их собственной энергии, отвечающей массе покоя частиц: E = mc2 (см. теорию относительности А. Эйнштейна).
Т.к. окончательно строение материи неизвестно (и не будет известно никогда), то учесть все виды взаимодействия всех видов частиц невозможно, т.е. невозможно знать абсолютное значение U. Но термодинамика в этом знании и не нуждается, т.к. имеет дело с изменением энергии DU.
Внутренняя энергия, естественно, может изменяться. Упорядоченную макроскопическую форму изменения внутренней энергии называют работой А, неупорядоченную микрофизическую - теплотой Q.
Термодинамика изучает в качествеобъектатермодинамическую систему.
Термодинамическая система - это совокупность тел или веществ, выделенная из окружающего пространства реальными или мнимыми границами.
Выделенная из окружающей среды система может быть изучена термодинамическими методами только в том случае, если имеется возможность проследить за всеми процессами обмена между системой и окружающей средой.
По типу взаимодействия системы с окружающей средой различают:
открытые системы- возможен теплообмен и обмен массой;
закрытые системы - возможен теплообмен, но нет обмена массой;
изолированные системы - невозможен ни теплообмен, ни обмен массой.
Примерами открытой системы может служить любой живой организм, сломанный зуб, закрытой - запаянная ампула с веществом, вылеченный зуб, изолированной - наша Вселенная или даже термос[2].
Свойства термодинамической системы, а также явления, связанные с взаимными превращениями теплоты и работы, описывают при помощи термодинамических параметров.
Измеряемые термодинамические параметры - это давление p, объём V, температура T, количество вещества n и другие.
Неизмеряемые (вычисляемые) термодинамические параметры - это энергия U, энтальпия H, энтропия S и другие.
Состояние системы называют равновесным, если все параметры остаются постоянными во времени, и в системе отсутствуют потоки вещества и энергии. Если параметры системы постоянны во времени, но имеются потоки вещества и энергии, состояние называют стационарным.
Термодинамический процесс связан с изменением хотя бы одного термодинамического параметра. Постоянство определённого параметра в ходе процесса отмечают приставкой изо-:
изохорный процесс - при постоянном объёме;
изобарный процесс- при постоянном давлении;
изотермический процесс - при постоянной температуре
Процесс, протекающий без теплообмена с окружающей средой, называют адиабатическимилиадиабатным. К адиабатным обычно относят очень быстрые процессы, считая, что за малое время теплообмен просто не успевает произойти.
Процесс, протекающий под действием бесконечно малой разности внешних сил, называют равновесным или квазистатическим. В таком случае система проходит через ряд промежуточных равновесных состояний по аналогии с движением канатоходца.
Процесс называют обратимым, если переход системы из состояния 1 в состояние 2 и обратно возможен по одному и тому же пути и после возвращения в исходное состояние в окружающей среде не остается никаких макроскопических изменений.
Таковыми являются, например, процессы сжатия-расширения газа или зарядки-разрядки аккумулятора (теоретически). Все обратимые процессы являются равновесными.Но равновесный процесс необязательно является обратимым.
В необратимых процессах после возвращения в исходное состояние часть работы переходит в теплоту. К необратимым процессам относятся самопроизвольные, т.е. протекающие без постоянного воздействия на систему извне.
Классическая термодинамика изучает только свойства равновесных систем. В этой связи, в классической термодинамике используется ряд допущений. Прежде всего, это постулат о термодинамическом равновесии системы,согласно которому:
Любая система с течением времени придет к равновесному состоянию.
Ещё один постулат классической термодинамики - это постулат о существовании температуры:
Если системы А, B и C находятся между собой в состоянии термодинамического (теплового) равновесия, то TA = TB = TC.
Иными словами, в термодинамике температура определяется как обобщённая сила, отвечающая теплообмену.
Эти постулаты представляются достаточно очевидными, но они необходимы для построения строгого математического аппарата термодинамики.
Состояние системы принято описывать при помощи переменных, значения которых принимают вполне определённые значения для любого состояния системы, но при этом не зависят от способа достижения данного состояния[3].
Такие переменные называют функциями состояния.
Функциями состояния являются: объём V, давление p, внутренняя энергия U, энтальпия H, энтропия S, свободная энергия Гиббса (изобарно-изотермический потенциал) G и другие.
Работа A и теплота Q функциями состояния не являются, так как зависят от пути, по которому система переходит из одного состояния в другое.
Для макроскопических систем энергия не является непосредственно измеряемой величиной. Изменение внутренней энергии определяется из соотношения:
DU = U2 (конечное состояние) - U1 (начальное состояние)
Термодинамика позволяет вычислить изменение энергии на основе опытных данных. Для этого необходимо учесть теплообмен между системой и окружающей средой (количество теплоты) и измерить работу, совершаемую системой над окружающей средой (или средой над системой).
Соотношение между теплотой и работой установлено в I законе (начале) термодинамики, который представляет собой не что иное, как частную формулировку закона сохранения энергии:
Изменение внутренней энергии системы DU равно сумме количества теплоты Q, переданного системе, и работы А, совершённой окружающей средой над системой:
| DU = Q + A, | (1) |
Другая формулировка:
Изменение внутренней энергии системы DU равно разности количества теплоты Q, переданного системе, и работы А, совершённой системой против внешних сил:
| DU = Q - A. | (2) |
На основании I закона термодинамикиможно заключить, что при различных способах перехода макроскопической системы из одного состояния в другое, алгебраическая сумма Q + A остаётся неизменной, следовательно, система не может ни создавать, ни уничтожать энергию.
Этот вывод подтверждается многочисленными опытными данными.
Таким образом, величины DU, Q и A имеют одинаковую размерность - размерность энергии. В настоящее время в СИ единицей энергии является Джоуль (Дж) и производные от него мДж, кДжи т.д. В некоторых случаях используется внесистемная единица - калория (килокалория) кал (ккал),1 Дж = 0,239 кал.
Соотношение между внутренней энергией и работой зависит от условий протекания процесса. Так, в изохорном процессе: DV = 0, A = p×DV = 0.
Следовательно:
| Qv = DU. | (3) |
Таким образом, в изохорном процессе количество теплоты, полученное системой, целиком идет на увеличение внутренней энергии.
В изобарном процессе работа определяется как A = p×DV, и можно записать:
| Qp = DU + pDV = U2 - U1 + p(V2 - V1) = = (U2 + pV2) - (U1 + pV1) = H2 - H1 = DH. | (4) |
Величина
| U + pV º H | (5) |
называется энтальпиейсистемы.
ЭнтальпияH - термодинамическая функция состояния системы, применяемая для изобарных процессов. Она включает в себя внутреннюю энергию и работу по преодолению внешнего давления.
Абсолютное значение энтальпии ни рассчитать, ни измерить невозможно, но можно определить изменение энтальпии DН в результате протекания процесса:
DH = H2 (конечное состояние) - H1 (начальное состояние).
Таким образом, внутренняя энергия и энтальпия представляют собой взаимно дополняющие друг друга функции: первая отражает теплопередачу при постоянном объёме, вторая - при постоянном давлении.
1.2. Термохимические уравнения и расчёты
Все химические реакции сопровождаются выделением или поглощением теплоты. Раздел химической термодинамики, изучающий тепловые эффекты химических реакций, называется термохимией.
Теплотой реакции Q называется количество теплоты, поглощаемой из окружающей среды или выделяемой в окружающую среду в ходе превращения исходных веществ (реагентов) в продукты реакции при определённых температуре и давлении.
В термохимии, когда говорят о тепловом эффекте реакции, обычно имеют в виду DHр-я. Причём, Q и DHр-я – это одна и та же энергия, рассмотренная с разных позиций:
Q – c позиции внешнего наблюдателя химической системы;
DHр-я – с позиции самой химической системы.
Поэтому DHр-я = – Q.
Реакции, которые протекают с выделением теплоты, называются экзотермическими.Для таких реакций Q > 0, DН < 0.
Реакции, которые протекают с поглощением теплоты, называются эндотермическими:Q < 0, DН > 0.
Так как значения тепловых эффектов зависят от внешних условий (температуры, давления и др.), то для того, чтобы иметь возможность сравнивать тепловые эффекты различных реакций, термохимические измерения проводят при одинаковых условиях, а именно:
1) в реакции участвуют индивидуальные вещества в их наиболее устойчивых модификациях;
2) концентрации реагентов составляют 1 моль вещества на 1 кг растворителя;
3) температура равна 250С (298,15 K);
4) давление соответствует 1 атм (760 мм рт. ст.; 101325 Па).
Такие условия называют стандартными.
За стандартное состояние (обозначают верхним индексом 0) принято устойчивое состояние вещества (устойчивая модификация - для веществ в конденсированном состоянии; состояние идеального газа - для газов), в котором оно существует при давлении 101,3 кПа и данной температуре (обычно 298 K, но это требование не является обязательным).
Так, величина  (читается «дельта аш стандартное») – это значение стандартной энтальпии[4] реакции, измеренное при
(читается «дельта аш стандартное») – это значение стандартной энтальпии[4] реакции, измеренное при
p = 101,3 кПа и T = 298 K. Величина 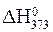 тоже является стандартной, несмотря на другую температуру.
тоже является стандартной, несмотря на другую температуру.
Стандартной энтальпией образования вещества (  ) называют изменение энтальпии реакции образования 1 моль данного вещества из соответствующих простых веществ, взятых в стандартном состоянии при стандартных условиях. Например:
) называют изменение энтальпии реакции образования 1 моль данного вещества из соответствующих простых веществ, взятых в стандартном состоянии при стандартных условиях. Например:
C(тв.) + О2(газ) = СО2(газ) + 394 кДж;  CO2 = -394 кДж/моль.
CO2 = -394 кДж/моль.
Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением. Термохимические уравнения составляют таким образом, чтобы исходное вещество было взято в количестве 1 моль, либо в качестве продукта образовывался 1 моль вещества, поэтому в таких уравнениях стехиометрические коэффициенты могут быть дробными, обозначая количества веществ.
Например:
обычное химическое уравнение:
2H2 + O2 = 2H2O;
термохимическое уравнение:
H2(газ) + 0,5O2(газ) = H2O(газ) + 242 кДж;
или:
H2(газ) + 0,5O2(газ) = H2O(газ);  H2O = -242 кДж/моль.
H2O = -242 кДж/моль.
Термохимические уравнения имеют и другие особенности:
‑ с ними можно выполнять алгебраические действия – складывать, умножать, записывать в обратном направлении и т.д. (с учётом теплового эффекта);
‑ тепловой эффект зависит от агрегатных состояний веществ, поэтому это состояние указывается: тв., крист., ж., г., пар.
Стандартные энтальпии образования простых веществ в их наиболее устойчивых состояниях равны нулю. Например:
 O2 = 0;
O2 = 0;  Сграфит = 0;
Сграфит = 0;
 O3 ¹ 0.
O3 ¹ 0.  Салмаз ¹ 0.
Салмаз ¹ 0.
Величины стандартных энтальпий образования веществ - справочный материал. Различному агрегатному состоянию одного и того же вещества соответствуют различные значения стандартных энтальпий образования.
Например:
 H2O(жидк.) = -286 кДж/моль;
H2O(жидк.) = -286 кДж/моль;
 H2O(газ) = -242 кДж/моль.
H2O(газ) = -242 кДж/моль.
Понятие «стандартная энтальпия образования» используют не только для обычных веществ, но и для ионов в растворе. В данном случае за нулевую отметку принимают стандартную энтальпию образования иона H+:
 H+(р-р) = 0.
H+(р-р) = 0.
Стандартной энтальпией сгораниявещества(  ) называет-ся стандартная энтальпия (изменение энтальпии) реакции окисления 1 моль данного вещества до продуктов предельного окисления (или простых веществ) при стандартных условиях. Например:
) называет-ся стандартная энтальпия (изменение энтальпии) реакции окисления 1 моль данного вещества до продуктов предельного окисления (или простых веществ) при стандартных условиях. Например:
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.) + 2810 кДж;
 С6H12O6 = -2810 кДж/моль.
С6H12O6 = -2810 кДж/моль.
У высших оксидов стандартные энтальпии сгорания равны нулю:
 СO2 = 0;
СO2 = 0;  Н2O = 0.
Н2O = 0.
В 1840 г. русским ученым Г.И. Гессом на основании экспериментальных данных был открыт закон о постоянстве сумм теплот для различных путей превращения исходных веществ в продукты реакции. В современной термохимии закон Гесса рассматривается как следствие I закона термодинамики, но при этом имеет отдельное название, так как был открыт раньше установления эквивалентности теплоты и работы.
В настоящее время закон Гесса формулируется так:
Изменение энтальпии реакции образования заданных продуктов из данных реагентов не зависит от числа и вида реакций, в результате которых образуются эти продукты, а зависит от природы и состояния исходных веществ и конечных продуктов
Схематично закон Гесса можно представить следующим образом (рис. 1), откуда видно:
DH = DH1 + DH2 + DH3 = DH4 + DH5

Рис. 1. Пути превращения исходных веществ в продукты реакции
Так, CO2 можно получить прямым взаимодействием углерода и кислорода:
C(тв.) + О2(газ) = СО2(газ);  = -394 кДж.
= -394 кДж.
Существует и другой путь:
С + 0,5O2 = CO;  = -110 кДж.
= -110 кДж.
СO + 0,5O2 = CO2;  = -284 кДж.
= -284 кДж.
Но при этом:
DH = DH1 + DH2 = -110 + (-284) = -394 кДж.
Для расчета энтальпий химических реакций используют следствия из закона Гесса.
I следствие:
Энтальпия реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учётом стехиометрических коэффициентов.
Для реакции:
aA + bB = cC + dD,
где A, B, C и D - вещества, a, b, c и d - стехиометрические коэффициенты в уравнении реакции математическое выражение I следствия из закона Гесса в общем виде выглядит следующим образом:

| (6) |
II следствие:
Энтальпия реакции равна сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учётом стехиометрических коэффициентов.
В данном случае математическое выражение запишется так:

| (7) |
Второе следствие из закона Гесса в основном используется для расчёта тепловых эффектов реакций с участием органических соединений, так как легко определять их теплоты сгорания в кислороде, и невозможно экспериментально установить их теплоты образования из простых веществ.
Таким образом, следствия из закона Гесса позволяют проводить расчёты энергетики химических реакций по справочным данным, не прибегая к эксперименту.
Экспериментальное определение тепловых эффектов химических реакций
Помимо теоретических (расчётных) методов определения тепловых эффектов химических реакций, широко применяются и методы экспериментальные.
Экспериментальное определение тепловых эффектов химических реакций обычно проводят при помощи калориметра, который представляет собой термически изолированный сосуд со встроенным термометром. Измеряемой величиной является температура. Расчёты тепловых эффектов проводят по формуле:
 , ,
| (8) |
где C - удельная теплоёмкость раствора;
m - масса раствора;
DT - повышение температуры в результате реакции;
n(  х) - число моль эквивалентов реагирующего вещества х.
х) - число моль эквивалентов реагирующего вещества х.
Каждый типреакции характеризуется своим, вполне определённым тепловым эффектом. Например, стандартная энтальпия нейтрализации– энтальпия реакции между кислотой и основанием, в которой образуется 1 моль воды при стандартных условиях:
 Н+р-р + ОН-р-р Н2Ож + 56,7 кДж;
Н+р-р + ОН-р-р Н2Ож + 56,7 кДж;
DHонейтр = -56,7 кДж/моль или -13,55 ккал/моль.
Существуют понятия: стандартная энтальпия гидрогенизации, стандартная энтальпия растворения, стандартная энтальпия атомизации и т.д.
Пример 1. Требуется определить тепловой эффект реакции нейтрализации.
Решение.
Независимо от того, какие были взяты кислота и основание, нейтрализация всегда сводится к ионно-молекулярному уравнению:
H+(р-р) + ОH-(р-р) = H2O(жидк.).
Таким образом, из закона Гесса следует, что стандартная энтальпия реакции нейтрализации является величиной постоянной.
Поместим в калориметр 25 мл соляной кислоты с C(  HCl) = 0,5 моль/л и определим начальную температуру. Затем быстро прильём 25 мл раствора гидроксида калия с C(
HCl) = 0,5 моль/л и определим начальную температуру. Затем быстро прильём 25 мл раствора гидроксида калия с C(  KOH) = 0,5 моль/л и снова измерим температуру. Температура повысилась на 3,50С. Это означает, что реакция нейтрализации является экзотермической. Теперь рассчитаем энтальпию нейтрализации (в нестандартных условиях опыта), используя формулу (8)[5]:
KOH) = 0,5 моль/л и снова измерим температуру. Температура повысилась на 3,50С. Это означает, что реакция нейтрализации является экзотермической. Теперь рассчитаем энтальпию нейтрализации (в нестандартных условиях опыта), используя формулу (8)[5]:

Процессы растворения также сопровождаются тепловыми эффектами. Энтальпией растворенияназывается изменение энтальпии при растворении 1 моль вещества в определённом растворителе с образованием бесконечно разбавленного раствора.
Пример 2. При растворении 3 г нитрата аммония в 1 л воды температура понизилась на 0,370С. Определить стандартную энтальпию растворения нитрата аммония.
Решение.
Так как температура раствора понизилась, то растворение нитрата аммония является эндотермическим процессом.
Количество NH4NO3 равно:
 ,
,
Если принять те же допущения, что и в примере 1, то получим:
 .
.