Література. 1. Ерстенюк А.М., Сиротинська І.Д., Мельник М.В., Романюк А.Л., Леочко Н.С
1. Ерстенюк А.М., Сиротинська І.Д., Мельник М.В., Романюк А.Л., Леочко Н.С. Хопта Н.С., Сав’як О.Л. Навчально-методичний посібник з хімії. Івано-Франківськ, 2012.
2. Клименко А.О., Павлюк В.М., Нечитайло Л.Я., Мельник М.В., Хопта Н.С., Коцаба М.В. Навчально-методичний посібник з фізичної та колоїдної хімії для студентів вищих медичних навчальних закладів. Івано-Франківськ, 2004.
3. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. ─ Вінниця: НОВА КНИГА, 2006.
Підготував: асистент Селепій Андрій Остапович
Обговорено і затверджено
на засіданні кафедри,
протокол №1 від 28.08.20012р.
Зав. Кафедрою біологічної та медичної хімії проф. А.М.Ерстенюк
Методична вказівка для студентів до семінарського заняття з хімії
ЗАНЯТТЯ №2
Тема: Будова атома. Склад атомних ядер. Будова електронних оболонок атомів хімічних елементів. Періодичний закон. Залежність властивостей елементів від періодичної зміни електронних структур атомів.
Актуальність теми: Суть всіх хімічних процесів полягає в перегруповуванні атомів, що входять до складу молекул різних речовин. В основі вивчення хімії лежить будова атомів хімічних елементів. Заряд ядра – основна характеристика хімічного елементу. Оскільки при хімічних реакціях ядра атомів не змінюються, то хімічні властивості речовин зумовлені тільки будовою електронних оболонок атомів. Тому для передбачення властивостей елемента важливо знати будову його електронних оболонок. Знання будови атомів є основою для вивчення хімії.
Відповідно до сучасних наукових уявлень про атом основою класифікації елементів і періодичності їх властивостей є заряд атомного ядра.
Навчальні цілі:
Знати: номенклатуру хімічних елементів, основні поняття і положення атомно-молекулярного вчення, будову атома, властивості елементарних частинок атома. Пояснювати властивості простих речовин елементів залежно від будови електронних оболонок їх атомів, робити позначення квантових чисел, розподіл електронів останнього електронного рівня елементу в залежності від номера групи,знати класифікацію хімічних елементів на метали і неметали,
Уміти: визначати заряд ядра атома, кількість електронів, протонів і нейтронів,заповнювати електронні комірки атома залежно від періоду, складати електронну формулу хімічного елемента, визначати валентні електрони. Визначати залежність властивостей елементів від періодичної зміни електронних структур їх атомів.
Самостійна позааудиторна робота
1. Заповнити пропуски в таблиці:
| Елемент | 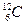
| 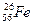
| ? | ? | ? |
| Число протонів | ? | ? | |||
| Число електронів | ? | ? | ? | ||
| Число нейтронів | ? | ? | ? | ||
| Атомна маса | ? | ? |
2. Написати електронні формули зовнішніх оболонок елементів: 14Si, 15P, 16S, 19К.
3. Написати йони Літію (Li), Алюмінію (Al), Хлору (Cl). Який з елементів:
а) віддає електрони; б) забирає електрони.
4. Елемент ІІ групи віддав 2 електрони. Чи завершений у нього електронний рівень?
5. Розділити речовини на метали та неметали: C, H2, O2, N2, S, Cu, Ca, Na, Sі, Fe:
| метали | неметали |
6. Електронна конфігурація елементу 1s2 2s2 2p6 3s1. Назвати атомний (порядковий) номер і групу, в яку входить цей елемент.
7. Елементи мають такі електронні формули: А) 1s2 2s2 2p4; Б) 1s2 2s2 2p6 3s2 3p1; В) 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Які це елементи? Написати їх латинські символи і назву.
8. У якому періоді Періодичної системи хімічних елементів знаходиться елемент з повністю або частково заповненими орбіталями 1s 2s 2p 3s 3p 3d 4s?
9. Написати електронну формулу для елементу із зарядом ядра Z = 12.
10. Скорочена електронна формула елементу зображена у вигляді: ...5p3. Який це елемент? Написати повну електронну формулу і набір квантових чисел для 8-го електрона на d-підрівні.
11. Графічно зобразити розподіл електронів останнього рівня по комірках для атомів I - III груп періодичної системи елементів.
Контрольні питання:
1. Як залежить будова атомних ядер від номера періоду і номера групи?
2. Що таке завершений електронний рівень?
3. Що таке ізотопи?
4. Що таке орбіталь? Які характеристики мають орбіталі?
5. Чи залежить будова атомних оболонок від номера періоду і номера групи?
6. Що таке квантові числа?
7. Що характеризує кожне квантове число (n, l, m, ms )?
8. Які елементи називаються s-, p-, d- і f-елементами?
9. Чи залежать неметалічні властивості елементів від значення електронегативності?
10. Сучасне формулювання періодичного закону. В чому його відмінність?
11. Які принципи лежать в основі періодичної системи?
12. Яка інформація про елемент знаходиться в комірці періодичної системи?
13. Як змінюються хімічні властивості елементів а) малих, б) великих періодів?
14. Які елементи знаходяться в головних (А) а які в побічних (Б) підгрупах?
15. Які елементи відносяться до: лужних, лужноземельних, благородних газів, халькогенів, галогенів?
Самостійна робота на занятті
1. Скільки протонів, нейтронів і електронів має атом елементу: Бору  , Оксигену
, Оксигену  , Барію
, Барію  ?
?
2. У атомі елементу Кальцію 20 протонів і 20 нейтронів. Який заряд несе йон кальцію з 18 електронами в електронній оболонці? Напишіть латинський символ цього йона.
3. Написати електронні формули зовнішніх оболонок елементів: 17Cl, 25Mn, 34Se, 52Te.
4. Написати повну електронну формулу елементу 19K. Записати набір квантових чисел для останнього (найвіддаленішого від ядра) електрона цього елементу.
3. Назвати елементи і вказати число неспарених електронів в атомах, що мають наступні електронні конфігурації:
А) 1s2 2s2 2p6 3s2 3p2; Б) 1s2 2s2 2p6 3s2 3p4;
В) 1s2 2s2 2p6 3s2 3p6 4s2 3d6; В) 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
4. Написати повні електронні формули і визначити порядкові номери елементів, що мають такі електронні формули зовнішніх електронних оболонок: А) 2s22p5, Б) 3s23p4, В) 3d14s2. Які це елементи?
5. Як залежать властивості елементів від кількості електронів і будови ядра атомів? Показати на прикладах елементів Fr і Li, F і Br.
6. Які з перелічених атомів і йонів мають електронні конфігурації, однакові з атомом 18Ar: Ca2+, Cl-, K, Na+, S2-, As3-, Al3+?
7. Дано два елементи - із зарядами ядер Z = 17 і Z = 18. Один з них - отруйний газ з різким запахом. Інший не отруйний, позбавлений запаху, не підтримує дихання. Написати електронні формули обох елементів. Який з них отруйний?
лІтературА
Основна:
1. Ерстенюк А.М., Сиротинська І.Д., Мельник М.В., Романюк А.Л., Леочко Н.С. Хопта Н.С., Сав’як О.Л. Навчально-методичний посібник з хімії. Івано-Франківськ, 2012
2. Глінка М.Л. Загальна хімія, Київ, «Вища школа»
3. Хомченко Г.П. Хімія для вступників до вузів, 2007
4. Луцевич Д.Д. Довідник з хімії, Львів, «Українські технології», 2005
Додаткова:
1. М.Д. Василева Цікава хімія, Київ, «Радянська школа», 1989
2. Бабич Л.В. Практикум по неорганической химии, Москва, «Просвещение», 1991
3. Г.П. Хомченко, І.Г. Хомченко, Задачі для вступників до вузів, Київ, «Вища школа», 1991
Джуа М. История Химии, Москва, «Мир», 1975
Підготувала: асистент кафедри Л.Р. Бабчук
Обговорено і затверджено
на засіданні кафедри
протокол №1 від 27.08.2014 р.
Зав. кафедрою біологічної та медичної хімії проф. А.М. Ерстенюк