Системы качественного анализа
Квалификация чистоты вещества. Окраска пламени. Системы качественного анализа. Закон действия масс с учетом постулата Гульдберга и Вааге. Задачи по теме
Анализируемые вещества и вещества, на базе которых готовится раствор для анализа всегда имеют определенную чистоту или квалификацию. Все получаемые и используемые для приготовления вещества имеют стандарты (ГОСТ, ОСТ (общероссийский), ТУ – технические условия).
Все вещества по ГОСТУ делятся на несколько классов:
Т – технический продукт (наиболее грязен)
Ч – чистое вещество (грязное);
ЧДА – чистое для анализа (более чистое);
Х.Ч. – химически чистое вещество (еще более чистое);
«О.Ч.» - особой чистоты.
Методы анализа могут быть сухими и мокрыми. Мокрые – когда анализ проводится в растворе. Например, определяется концентрация кислоты в растворе (титрование щелочью).
Сухой анализ – анализируют сухое вещество без растворения. Например, растирание взаимодействующих веществ в ступке, в результате меняется окраска вещества, можно качественно определить вещество.
СоС12 + 4NH4CNS Û (NH4)2[Co(CNS)4] + 2NH4C1
Голубой тетрародано кобальтат II диаммония
Часто присутствие тех или иных ионов можно обнаружить по изменению окраски пламени. Его окрашивают:
- соли Na – в желтый цвет,
- соли К – фиолетовый,
- соли Rb, Cs – розово – фиолетовый;
- соли Li, Sr – розово, карминово – красный,
- Са – кирпично – красный;
- Ва – зеленый,
- Сu – голубой,
- Rb, Sb, As – бледно – голубой.
По масштабам аналитического эксперимента методы анализа делят на:
| Название анализа | Масса, г | Объем, мл |
| макроанализ | от 1 до 10 | от 10 до 100 |
| полумикроанализ | от 0,05 до 0,5 г | от 2 до 10 |
| микроанализ | от 10-3 до 10-6 | 0,1 до 10-4(2,5 – 5 капли) |
| ультрамикроанализ | 10-6 до 10-9 | 10-4 до 10-6 |
| субмикроанализ (наноанализ) | 10-9 до 10-12 | 10-7 до 10-11 |
По другой классификации качественный анализ разделяют на 3 метода:
1) Сероводородный (сульфидный), когда оценивают отношение катионов к сероводороду. В основе лежит растворение сульфидов, хлоридов, карбонатов. Все катионы делят на 5 групп, анионы не классифицируются.
2) Кислотно – основной метод. Оценивают отношение катионов и анионов к соляной, серной, уксусной кислоте и щелочам. Все катионы делят на 6 групп, анионы – на 3 группы.
3) Аммиачно - фосфатный метод. Отношение катионов (5 групп) и анионов к раствору гидрофосфат аммония, насыщаемого аммиаком, катионы – к азотной кислоте.
Системы качественного анализа.
Методы качественного анализа, позволяющие определять в анализируемом веществе содержание отдельных элементов, называют элементными анализом, функциональных групп — функциональным анализом, индивидуальных химических соединений, характеризующихся определенным молекулярным весом, — молекулярным анализом.
Совокупность разнообразных химических, физических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом.
В основе анализа лежит конкретные, базовые реакции, к которым предъявляются определенные требования. При проведении анализа должно быть выделение газа или изменение окраски раствора. В случае проведения физико – химического анализа должны измениться физико – химические условия: тепло- электропроводность, рН, окраска раствора и т.д.
Чувствительность базовой реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора.
Воспроизводимость анализа определяется наличием ошибок и их величиной.
Чувствительность определяется несколькими критериями:
1) открываемый минимум – это наименьшее количество вещества (г, мкг), которое может быть обнаружено в 1 капле раствора (объем 0,01 – 0,03 мл).
2) предельное разведение (разбавление) характеризует максимальный объем раствора, в котором еще можно определить (открыть) 1 грамм обнаруживаемого вещества. Выражается 1:50000; 1:100000. Это значит, что объем раствора для обнаружения, содержащий 1 г вещества (иона) не может быть разбавлен больше 50000 мл. Обратная ему величина – предельная концентрация.
Вычисляется по формуле:
Vмин = mVпред/106
m – открываемый минимум, мкг;
Vпред – предельное разбавление
Vмин – минимальный объем раствора, требуемый для обнаружения иона.
3) критерий, указывающий минимальное число микрограммов вещества g в 1 мл раствора. Если g >10 мкг – малочувствительный анализ, 1< g<10 – средне чувствительный, 0,1<g<1 – высоко чувствительный, g <0,1 – очень чувствительный.
4) Скорость и глубина протекания реакции.
Т.е. реакция тем чувствительнее, чем ниже открываемый минимум, больше предельное разбавление.
К базовым реакциям предъявляют следующие требования:
1) реакции должны быть быстрыми;
2) реакции должны быть необратимыми, или необходимо создать условия, при которых реакцию можно условно считать необратимой:
СаСО3 = СаО + СО2
Такая реакция должна быстро заканчиваться.
Если же базовая реакция обратима, то равновесие должно достигаться быстро и быть существенно смещено вправо, т.е. в сторону продуктов. В противном случае ошибка анализа будет значительной.
Кинетические кривые таких реакций имеют вид:
А + В ® продукты
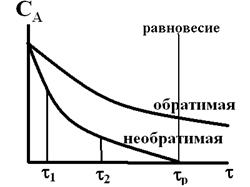
Если равновесие не наступает, то результат всегда бывает разным. Время окончания реакции должно быть небольшим, и равновесное время – тоже небольшим.
Качество базовой реакции оценивается через закон действия масс.
.