Закон действия масс как выражение константы равновесия химической реакции. Требования к скорости реакции и скорости достижения равновесия в аналитической химии. Задачи по теме
Закон действия масс выражается 1) через скорость химической реакции; 2) через уравнения для константы равновесия.
В основе 1 варианта лежит постулат Гульдберга и Вааге: Скорость химической реакции пропорциональна концентрациям реагирующих веществ. Рассмотрим необратимую реакцию:
Н2О(г) + СО(г) = СО2 + Н2 стехиометрическое уравнение.
Jпрям = -dССО./dt = k[Н2О][СО] – кинетическое уравнение
Для прямой реакции ставят знак минус, для обратной – плюс.
Если [Н2О]=[СО]= 1 моль/л, то Jпрям = k.
То есть константа скорости химической реакции есть скорость химической реакции при концентрации реагирующих веществ равных 1. С течением времени концентрация уменьшается, поэтому скорость прямой реакции уменьшается. Чем больше константа скорости химической реакции, тем быстрее протекает реакция.
Т.о. скорость химической реакции представляет собой изменение концентрации реагирующих веществ в единицу времени в единице объема. [J] = [моль/(л×сек)]. Размерность же концентрации любого реагирующего вещества [моль/л].
Н2О + СО = СО2 + Н2
J = k×[Н2О]×[СО]
[моль/(л×сек)] = [k] [моль/л] [моль/л]
Размерность константы скорости химической реакции: [k] = л/моль×с = л×моль-1×с-1.
Для реакции аА + bB ® продукты
Jпрям = k×САа×СBb (1)
[моль/(л×сек)] = [k] [мольа/ла] [мольb/лb]
[1/сек] = [k] [мольa-1/лa-1] [мольb/лb]
[k] = [ла+b-1/мольа-1мольbс]
[k] = [ла+b-1моль –(а+b-1) с-1]
для р-и 1:показатель степени а – порядок реакции по веществу А,
b – порядок реакции по веществу B,
Порядком реакции по веществу называется показатель степени, с которым концентрация реагирующего вещества входит в кинетическое уравнение. Порядок по веществу может быть равен 0 если:
1) вещество не участвует в реакции; 2) концентрация одного вещества настолько велика и превышает концентрацию 2 - го, что практически не меняется в процессе реакции, или ею можно пренебречь. Например, концентрация воды при гидролизе в растворе.
Порядок по веществу может быть дробным (многостадийные процессы) и даже отрицательным, что указывает на то, что вещество является замедлителем, ингибитором реакции.
Порядком реакции называют сумму показателей степеней, с которыми концентрации реагирующих веществ входят в кинетическое уравнение. Для уравнения 1:
n = а + b.
Если а + b = 1 – это реакции 1-го порядка, 2 – второго порядка, 3 – третьего. 4-го не бывает, это стадийные процессы, т.к. сразу 4-м нужным молекулам столкнуться и прореагировать невозможно.
Скорость реакции зависит от температуры. Зависимость характеризуется уравнением Аррениуса.
k = z exp(-Eа/RT)
R = 8,31, ехр = 2,72
Т – абсолютная температура (К), Z – предэкспоненциальный множитель, для каждой реакции он свой и считается, что он не зависит от температуры.
Еа – энергия активации, т.е. тот минимальный запас энергии, который должна иметь молекула (реагирующая частица) чтоб перейти в активное состояние для протекания реакции. Для необратимых реакций чем выше энергия активации, тем сильнее скорость процесса зависит от температуры.
Повышение температуры по-разному меняет скорости параллельных реакций, оно может увеличить скорость одной реакции (с большей энергией активации) по отношению к другой, поэтому можно избавиться от мешающей реакции либо навредить анализу.
Рассмотрим 2 вариант - закон действия масс через уравнения для константы равновесия.
В качестве базовой рассмотрим обратимую реакцию:
k1
аА + bB « cC + dD
k-1
Jпрям = k1×САа×СBb
Jобр = k-1×ССс×СDd
k-1 – константа скорости обратной реакции, чем быстрее достигается равновесие, тем лучше.
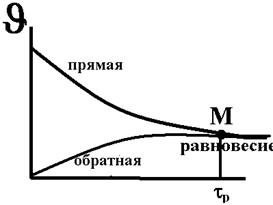
В точке М в определенное время Jпрям = Jобр и наступает равновесие.
Равновесие подчиняется правилу Ле-Шателье.
Для аналитической химии необходимо, чтобы равновесие было сдвинуто максимально вправо, а время достижения равновесия было как можно меньше, что уменьшает ошибку анализа и ускоряет процедуру проведения анализа.
Т.к. Jпрям = Jобр, то
k1×САа×СBb = k-1×ССс×СDd
k1/k-1 =ССс×СDd/САа×СBb = Кр – концентрационная константа равновесия. Размерность ее меняется в зависимости от природы реакции (порядков реакций по веществам).
аА + bB « cC + dD
k-1