Завдання 2. Одержання водню з кислот
Покладіть в одну пробірку кілька гранул цинку, а в другу - кілька шматочків заліза. Додайте в кожну пробірку по 1-2 см 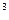 розведеної хлоридної кислоти і спостерігайте перебіг реакцій. Переконайтеся, що з пробірки виділяється чистий водень (див. дослід 1). Проробіть той самий дослід з розведеною сульфатною кислотою замість хлоридної. Напишіть рівняння реакцій.
розведеної хлоридної кислоти і спостерігайте перебіг реакцій. Переконайтеся, що з пробірки виділяється чистий водень (див. дослід 1). Проробіть той самий дослід з розведеною сульфатною кислотою замість хлоридної. Напишіть рівняння реакцій.
Завдання 3. Одержання водню з розчину лугу
Покладіть у пробірку кілька кусочків алюмінієвих ошурок, додайте розчину NаОН, закріпіть пробірку в затискачі штатива, закрийте її корком з відтягнутою трубкою і спостерігайте перебіг реакції. Спочатку реакція відбувається повільно, а потім досить бурхливо. Доведіть, що в результаті реакції виділяється водень. Напишіть рівняння реакції.
Завдання 4. Відновні властивості водню в момент виділення
Налийте в дві пробірки по 1-2 см 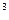 розведеної сульфатної кислоти і долийте декілька крапель розчину калію перманганату. Додайте в одну з пробірок кусочок цинку, а в другу - пропустіть водень, зануривши кінець газовідвідної трубки в розчин. Зверніть увагу на те, що обезбарвлення розчинів в обох пробірках відбувається з різною швидкістю. Напишіть рівняння реакції, знаючи, що манган відновлються до двовалентного.
розведеної сульфатної кислоти і долийте декілька крапель розчину калію перманганату. Додайте в одну з пробірок кусочок цинку, а в другу - пропустіть водень, зануривши кінець газовідвідної трубки в розчин. Зверніть увагу на те, що обезбарвлення розчинів в обох пробірках відбувається з різною швидкістю. Напишіть рівняння реакції, знаючи, що манган відновлються до двовалентного.
Завдання 5. Вивчення взаємодії лужних та лужноземельних
металів з водою
У три пробірки налийте 1-2 см 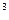 води і помістіть кусочки очищених: а)металічного натрію; б)металічного магнію; в)металічного кальцію. Спостерігайте виділення газу. Ті пробірки, де реакція протікає недостатньо інтенсивно, підігрійте. Після закінчення реакції реакційну суміш охолодіть і добавте декілька крапель фенолфталеїну. Що ви спостерігаєте? Напишіть рівняння реакції. Визначіть оксидник і відновник
води і помістіть кусочки очищених: а)металічного натрію; б)металічного магнію; в)металічного кальцію. Спостерігайте виділення газу. Ті пробірки, де реакція протікає недостатньо інтенсивно, підігрійте. Після закінчення реакції реакційну суміш охолодіть і добавте декілька крапель фенолфталеїну. Що ви спостерігаєте? Напишіть рівняння реакції. Визначіть оксидник і відновник
Завдання 6. Забарвлення полум'я йонами лужних та
лужноземельних металів
Внесіть дротинку з нержавіючої сталі з петлею на кінці в полум'я пальника і прожарте її до припинення забарвлення полум'я. Охолоджену дротинку змочіть у розчині відповідної солі або занурте в кристали цієї солі і внесіть у полум'я пальника. Відмітьте колір полум'я і занесіть його в таблицю. Дротинку прожарюйте, доки забарвлення не зникне, після чого проведіть дослід з наступною сіллю.
Таблиця
Колір полум'я, викликаний йонами лужних та лужноземельних металів.
| Йони лужних металів | Йони лужноземельних металів | ||
| Йон | Колір полум’я | Йон | Колір полум’я |
| Li+ | 
| ||

| 
| ||

| 
| ||

| 
| ||

| 
|
Зробіть відповідні висновки.
Завдання 7. Утворення та усунення карбонатної твердості води
У пробірку до половини її об'єму налийте вапняної води і опустіть в неї газовідвідну трубку від апарата Кіппа, зарядженого мармуром і хлоридною кислотою. Пропускайте в розчин несильний струмінь газу і слідкуйте, щоб розчин не викидало цим струменем із пробірки. Відмітьте появу осаду кальцію карбонату. Продовжуйте пропускати СО2 до повного розчинення осаду, який супроводжується утворенням кальцію гідрокарбонату Са(НСО3)2. Напишіть рівняння реакції. Як називається вода, що містить кальцію гідрокарбонат?
Отриманий розчин розділіть на дві пробірки:
· Половину отриманого розчину обережно нагрійте до кипіння і утворення осаду кальцію карбонату. Напишіть рівняння реакції розкладу Са(НСО3)2 при кип'ятінні.
· До другої половини розчину добавте декілька крапель розчину NаОН до утворення осаду СаСO3. Напишіть рівняння реакції.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
ЗАНЯТТЯ №40
ТЕМА: Підсумковий контроль модуля 2 «Неорганічна хімія».
АКТУАЛЬНІСТЬ: дана робота необхідна студентам для знання властивостей елементів головних та побічних підгруп періодичної системи Д.І.Менделєєва, для закріплення і засвоєння знань з пройдених тем.
НАВЧАЛЬНІ ЦІЛІ:З’ясувати значення елементів та сполук елементів головних та побічних підгруп періодичної системи Д.І.Менделєєва в медичній та фармацевтичній практиці. Перевірка засвоєння студентами знань із раніше вивчених тем.
ЗНАТИ: -фізичні та хімічні властивості елементів головних та побічних
підгруп періодичної системи Д.І.Менделєєва ;
-характерні ступені оксидації елементів головних та побічних підгруп
періодичної системи Д.І.Менделєєва;
-значення сполук елементів головних та побічних підгруп
періодичної системи Д.І.Менделєєва для медицини і фармації.
ВМІТИ:-записати характерні хімічні реакції елементів та сполук елементів
головних та побічних підгруп періодичної системи Д.І.Менделєєва;
-розв'язувати типові розрахункові задачі;
-застосовувати знання з пройдених тем на практиці.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Загальні закономірності зміни кислотно-основних та оксидаційно-відновних властивостей d-елементів при переході від нижчих до вищих ступенів оксидації.
2.Залежність оксидаційно-відновних властивостей сполук d-елементів від рН середовища (на прикладі Хрому та Мангану).
3.Загальна характеристика Молібдену і Вольфраму, здатність до утворення ізополі- та гетерополікислот.
4.Загальна характеристика елементів підгрупи Арсену. Бінарні сполуки з воднем, киснем, сіркою та іншими неметалами, їх одержання та кислотно-основні властивості.
5.Манган, положення в періодичній системі Д.І.Менделєєва. Характерні ступені оксидації. Природні сполуки.
6.Здатність d-елементів до комплексоутворення. Катіонні, аніонні та нейтральні комплекси. Хімічний зв’язок в комплексних сполуках.
7.Галогеніди металів. Їх застосування в фармації.
8.Роль металів в фізіологічних процесах, що відбуваються в живих організмах.
9.У якій масі води треба розчинити 5 г мідного купоросу CuSO4•5H2O, щоб 1 г приготовленого розчину містив 0,04 г безводної солі?
10.Визначте молярну масу еквівалента мангану в реакції з киснем, якщо утворюється: а) MnO2; б) Mn3O4.
11.Під час прожарювання 1 г оксиду металічного елемента в струмені водню виділилося 0,284 г води. Визначте молярні маси еквівалентів елемента та його оксиду.
12.Які координаційні числа характерні для Мангану, Технецію та Ренію в їхніх сполуках?
13.Напишіть рівняння реакцій, що можуть відбуватися між калію хроматом та : а) хлоридною кислотою; б) сульфатною кислотою. Вкажіть умови, за яких дані реакції є можливими.
14.Кислотно-основні властивості сполук Цинку.
15.Сульфіди арсену, їх характер, розчинення в лугах та сульфіді амонію.
16.Фізико-хімічні основи застосування сполук елементів побічних підгруп та підгрупи Арсену в фармації.
17.Хімічні властивості Арсену. Взаємодія з нітратною кислотою.
18.”Царська вода”, взаємодія з золотом і платиною.
19.Хрому гідроксид та надхромові кислоти.
20.Солі Феруму. Ферити і ферати, їх добування і застосування.
21.Оксигеновмісні сполуки Хрому, добування і характер оксидів та гідратних форм.
22.Хімічні властивості Кобальту та Ніколу.
23.Тіосолі Арсену та Стибію, їх одержання і властивості.
24.Валентні особливості d-елементів. Потенціали йонізації, спорідненність до електрону, відносна електронегативність, електродні потенціали, ряд напруг.
КОНТРОЛЬНІ ПИТАННЯ
1.Електронна структура атомів елементів побічних підгруп та підгрупи Арсену в нормальному та збудженому стані.
2.Хімічні властивості Мангану.
3.Оксигеновмісні сполуки Мангану. Характер оксидів та їх гідратних форм. Оксидаційно-відновні властивості.
4.Загальна характеристика d-елементів VI групи. Природні сполуки та методи добування.
5.Хімічні властивості Хрому та його сполук.
6.Кислотно-основна та оксидаційно-відновна характеристика сполук Феруму (II) та Феруму (III).
7.Комплексні сполуки Феруму з ціанід-, роданід-йонами, диметилгліоксимом, оксидом карбону (II), гемоглобіном.
8.Найважливіші сполуки Кобальту та Ніколу, здатність до комплексоутворення. Реакція Чугайова.
9.Найважливіші сполуки міді, срібла та золота, їх кислотно-основна та оксидаційно-відновна характеристика, здатність до комплексоутворення.
10.Особливості фізичних і хімічних властивостей ртуті та її сполук.
11.Хімізм токсичної дії сполук кадмію та меркурію.
12.Комплексна природа цинквмісних ферментів та хімізм їх дії.
13.Комплексні сполуки Цинку, їх застосування.
14.Хромати та дихромати. Їх оксидаційні властивості. Рівновага в розчині хромат- і дихромат-йонів.
15.Якісні реакції на катіони Fe2+ і Fe3+.
16.Арсенітна, арсенатна кислота і їх солі. Кислотні та оксидаційно-відновні властивості.
17.Солі Стибію та Бісмуту, їх гідроліз.
18.Арсин, його одержання і властивості. Застосування в хіміко-токсикологічних дослідженнях.
19.Хімічні властивості стибію та бісмуту. Оксиди Стибію, їх характер і відповідні кислоти. Сполуки Стибію з галогенами та сіркою. Характерні сполуки Бісмуту, їх властивості.
20.Найважливіші неорганічні препарати елементів побічних підгруп та підгрупи Арсену, які використовуються в медицині і фармації.
21.Чому від Феруму до Нікелю стійкість сполук із ступенем оксидації +3 зменшується, а їз ступенем оксидації +2 – збільшується?
22.На гідроксиди цинку та кадмію подіяли надлишком розчину сульфатної кислоти, лугу, аміаку. Які сполуки при цьому утворилися? Напишіть рівняння відповідних реакцій.
23.Які хімічні реакції використовують для видалення залишків металічної ртуті, що вилилася внаслідок необережного поводження з нею?
24.Охарактеризуйте розчинність сульфідів Цинку, Кадмію та Гідраргіуму в кислотах. Чи можна використати різне відношення сполук до кислот для розділення суміші порошків ZnS, CdS та HgS? Якщо так, то яким чином здійснити таке розділення?
САМОСТІЙНА РОБОТА НА ЗАНЯТТІ
Відповідати на питання викладача, які будуть задаватися студентам з теми "Підсумковий контроль модуля 2 «Неорганічна хімія». Розв'язування типових задач. Письмова робота.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
16.Яцимирський К.Б., Яцимирський В.К. Хімічний зв’язок. К.: Вища школа, 1993. –309 с.
17.Фримантл М. Химия в действии: В 2-х ч. / Пер. с англ. –М.: Мир, 1991. –Ч.1.-528 с.; Ч.2. –622 с.
18.Загальна та неорганічна хімія: Підруч. для студ. вищ. навч. закл. (Ч.2) // О.М.Степаненко, Л.Г.Рейтер, В.М.Ледовських, С.В.Іванов. –К.: Пед. Преса, 2000. -784 с.
19.Оганесян Э.Т. Неорганическая химия для фармацевтических вузов. –М.: Высшая школа, 1983. –523 с.
20.Перепелиця О.П. Властивості та екологічний вплив хімічних елементів: Довідник. –К.: Вентурі, 1997. –192 с.
ЗАНЯТТЯ №42
ТЕМА: Хімія елементів ІІБ підгрупи (Цинк, Кадмій, Меркурій).
Лабораторна робота №17.
АКТУАЛЬНІСТЬ: майбутні провізори повинні знати властивості елементів ІІБ підгрупи та їх біологічну роль для застосування в фармацевтичній практиці та в народному господарстві.
НАВЧАЛЬНІ ЦІЛІ:Вивчення хімічних властивостей елементів ІІБ підгрупи. Ознайомлення з застосуванням сполук елементів ІІБ підгрупи у народному господарстві та медицині.
ЗНАТИ:-фізичні та хімічні властивості елементів IІБ підгрупи;
-характерні ступені оксидації елементів IІБ підгрупи в
нормальному та збудженому стані;
-особливості хімічних властивостей сполук елементів IІБ підгрупи.
ВМІТИ:-записати характерні хімічні реакції елементів IІБ підгрупи;
-розраховувати значення потенціалу йонізації;
-показати здатність до комплексоутворення d-елементів IІ-ї підгрупи;
-розв'язувати типові розрахункові задачі;
-за допомогою хімічних реакцій характеризувати властивості d-
елементів IІ-ї групи.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Загальна характеристика елементів IІБ підгрупи. Найважливіші природні сполуки.
2.Методи одержання елементів IІБ підгрупи. Добування цинку. Охарактеризувати процеси за допомогою рівнянь реакцій.
3.Хімічні властивості простих речовин.
4.Оксигеновмісні сполуки елементів IІБ підгрупи, їх отримання непрямим шляхом.
5.Хімічні властивості оксидів елементів IІБ підгрупи, їх оксидаційно-відновні властивості.
6.Закінчити рівняння реакцій:
а) Zn + HNO3 (дуже розб.) →
б) HgCl2 + SnCl2 →
в) Zn + NaOH + H2O →
г) Hg + HNO3 (к.) →
д) Hg + HNO3 (р.) →
7.Вказати валентні можливості атомів елементів Zn, Cd, Hg, обгрунтувати можливість йонів проявляти координаційне число 4 при утворенні комплексних сполук.
8.Написати рівняння реакцій термічного розкладу нітратів цинку, кадмію і меркурію (II).
9.Як взаємодіє цинк з розчинами лугів, аміаку, хлориду амонію? Написати рівняння реакцій.
10.Розчин сулеми, який використовують в медицині, готують розчиненням 1 г солі в 2 кг води. Яка молярна концентрація та масова частка одержаного розчину, якщо густина дорівнює 1,01 г/см3.
11.Яка маса ферум (II) сульфату була в розчині, якщо при взаємодії цинку з розчином цієї солі маса металу зменшилася на 0,04 г?
12.Яку масу концентрованої сульфатної кислоти необхідно витратити для розчинення 50 г меркурію?
КОНТРОЛЬНІ ПИТАННЯ
1.Електронна структура атомів елементів IIБ підгрупи.
2.Хімічні властивості гідроксидів цинку, кадмію. Чому HgOH, Hg(OH)2 не існують у вільному стані?
3.Сполуки Цинку та їх здатність до комплексоутворення.
4.Взаємодія елементів IIБ підгрупи з водою, лугами та кислотами. Навести рівняння реакцій з сульфатною та нітратною кислотами різних концентрацій.
5.Кислотно-основна і оксидаційно-відновна характеристика сполук Цинку.
6.Комплексні сполуки Цинку. Комплексна природа цинквмісних ферментів та хімізм їх дії.
7.Біологічна та фізіологічна роль Цинку Меркурію.
8.Яку масу аргентуму нітрату треба взяти, щоб приготувати 10 г 2%-го розчину очних крапель? Чи буде цей розчин ізотонічним?
9.Яка із солей (AgCl чи AgBr) більш розчинна у воді? AgCl чи Ag2CrO4? У скільки разів?
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Виконання дослідів, описаних в даних методичних вказівках.
2.Обговорення результатів та оформлення висновків.
3.Оформлення та захист протоколу.
4.Відповіді на запитання, запропоновані викладачем, з використанням записів на дошці.
5.Розв'язування розрахункових задач, запропонованих викладачем.
Експериментальна частина
Завдання 1. Сполуки Цинку і Кадмію
1.1.Розчинення цинку і кадмію в кислотах і лугах
а) В чотири пробірки помістіть по 1 мікрошпателю цинкового пилу і додайте по 0,5 см3 розбавленого розчину: в першу – хлоридної, в другу – сульфатної, в третю – нітратної кислоти, в четверту – розчину лугу. Що спостерігається? Напишіть рівняння реакції. Повторіть дослід з концентрованими розчинами кислот і лугу. Напишіть рівняння реакцій.
б) Повторіть вказані досліди з металічним кадмієм. Напишіть рівняння реакцій.
1.2.Одержання гідроксидів цинку і кадмію та дослідження їх властивостей
У дві пробірки налийте по 3-4 краплі розчину солі Цинку, у дві інші – розчину солі Кадмію. До кожної пробірки додайте 1 краплю натрію гідроксиду і спостерігайте утворення білих драглистих осадів гідроксидів. Перевірте їх розчинність в розбавленій хлоридній кислоті і надлишку лугу. Які властивості проявляють гідроксиди обох металів? Напишіть рівняння реакцій.
1.3.Одержання комплексних сполук Цинку і Кадмію
Помістіть в одну пробірку 0,5 см3 розчину солі Цинку, в другу – солі Кадмію і додайте краплями розбавлений розчин аміаку до розчинення осадів.
Враховуючи, що характерним координаційним числом для обидвох йонів-комплексоутворювачів є 4, напишіть рівняння реакцій, рівняння дисоціації комплексів та вирази для констант нестійкості. Назвіть вказані комплексні сполуки. Знайдіть у довіднику значення констант нестійкості. Який комплексний йон більш стійкий і чому?
1.4.Відновлювальні властивості цинку
Помістіть у фарфоровий тигель два мікрошпателі цинкового пилу, 0,5 см3 розчину калію нітрату і 2-3 краплі концентрованого розчину натрію гідроксиду. Повільно нагрівайте на полум’ї пальника. Піднесіть папірець універсального індикатора і визначіть за запахом, який газ виділяється. Яка сіль Цинку утворюється? Напишіть рівняння реакції і визначіть коефіцієнти рівняння методом електронного балансу.
Одержання цинку оксиду
Покладіть у фарфоровий тигель декілька мікрошпателів цинкового пилу і нагрівайте на полум’ї до утворення білого порошку цинку оксиду. Одержаний порошок розділіть на дві пробірки і до одної додайте розбавлений розчин хлоридної кислоти, до другої – розчин лугу. Що спостерігається? Напишіть рівняння реакції.
1.6. Витіснення кадмію з його солей цинком
Занурте в стаканчик з розчином кадмію сульфату цинкову пластинку і спостерігайте виділення металічного кадмію у вигляді губчастої маси. Напишіть рівняння реакції.
1.7.Одержання і властивості кадмію карбонату
Змішайте у фарфоровій чашці по 25 см3 2н розчинів кадмію хлориду і амонію карбонату, а потім додайте такий самий об’єм розбавленого розчину аміаку, щоб осад кадмію карбонату повністю розчинився. Нагрійте одержаний розчин комплексної солі [Cd(NH3)4]CO3 на водяній ванні. Спостерігайте утворення білих блискучих кристалів кадмію карбонату. Злийте рідину з осаду, промийте методом декантації осад. Перевірте розчинність одержаного розчину у воді, кислотах і лугах.
Покладіть один мікрошпатель одержаного кадмію карбонату в фарфоровий тигель і прожарте. Що при цьому спостерігається? Кадмію карбонат розкладається при температурі близько 3500С. Напишіть рівняння реакцій.
1.8.Одержання і властивості сульфідів цинку і кадмію
В одну пробірку налийте 1-2 см3 розчину кадмію сульфату, а в другу – цинку хлориду. Додайте до обох пробірок надлишок розчину натрію сульфіду. Спостерігайте утворення осадів. Яке забарвлення мають осади в обох пробірках? Злийте рідину з осадів і дослідіть розчинність сульфідів у розбавлених та концентрованих хлоридній і сульфатній кислотах на холоді і при нагріванні. Що при цьому спостерігається? Напишіть рівняння реакцій.
Завдання 2. Меркурій. Ртуть
2.1.Гідроліз сполук меркурію (І)
Розчиніть кілька кристаликів нітрату меркурію (І) в 1-2 см3 дистильованої води. Спостерігайте утворення осаду основної солі (або помутніння розчину). Дослідіть розчин універсальним індикатором. Додайте кілька крапель розбавленої нітратної кислоти і спостерігайте розчинення осаду. Напишіть рівняння реакцій.
2.2.Взаємодія калію йодиду з солями меркурію (І)
До 1-2 см3розчину меркурію (І) нітрату додайте краплями розчину калію йодиду і спостерігайте утворення жовто-зеленого осаду меркурію (І) йодиду. Ця сполука нестійка і поступово розкладається на ртуть і меркурію (ІІ) йодид, яка в надлишку калію йодиду розчиняється внаслідок утворення комплексної сполуки. Напишіть рівняння реакцій.
2.3.Одержання меркурію (І) хлориду (каломелі)
До 1-2 см3 розчину натрію хлориду або хлоридної кислоти додайте краплями розчину меркурію (І) нітрату і спостерігайте утворення білого осаду каломелі. Напишіть рівняння реакції.
2.4.Одержання і властивості меркурію (ІІ) оксиду
До 1-2 см3 меркурію (ІІ) нітрату додайте 2-3 см3 розбавленого розчину лугу і спостерігайте утворення жовтого осаду меркурію (ІІ) оксиду. Розділіть одержаний осад з розчином у дві пробірки, додайте до одної розбавленої кислоти, до другої – надлишок розчину лугу. Що при цьому спостерігається? Напишіть рівняння реакцій.
2.5.Одержання і властивості аргентуму тетрайодомеркурату
До 1-2 см3 розчину меркурію (ІІ) нітрату додайте краплями розчину калію йодиду до розчинення осаду, що утворюється, а потім розчину аргентуму нітрату і спостерігайте утворення ясно-жовтого осаду комплексної солі (Ag2[HgI4]). Відфільтруйте осад, промийте його на фільтрі водою і висушіть між аркушами фільтрувального паперу. Покладіть невелику кількість одержаної комплексної сполуки в суху пробірку і підігрійте. Спостерігайте зміну яскраво-жовтого забарвлення солі на оранжево-червоне. При охолодженні сполуки забарвлення знову стає яскраво-жовтим. Комплексна сполука застосовується як теплочутлива фарба (термоіндикатор). Напишіть рівняння реакцій.
Оформити і зажистити протокол.
ЛІТЕРАТУРА
1.Державна Фармакопея України / Держ. підприємство “Науково-експертний фармакопейний центр.” –1-е вид. –Харків: РІРЕГ, 2001. –556 с.
2.Коровин Н.В. Общая химия. –М.: Высшая школа, 1998. –559 с.
3.Угай Я.А. Общая и неорганическая химия. –М.: Высшая школа, 1997. –527 с.
4.Конспект лекцій.
5.Практикум з загальної та неорганічної хімії: Посібник // Є.Я.Левітін, Р.Г.Клюєва, А.М.Бризицька та ін. –Х.: Основа, 1998. –119 с.
6.Неорганическая химия.: Учебное пособие для студ. фармац. спец. вузов (Практикум) // А.К.Сухомлинов, Н.В.Боровская, П.Я.Пустовар и др. –Киев: Высшая школа, 1983. –167 с.
7.Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. К.: Вища школа, 1991. –430 с.
8.Романова Н.В. Загальна та неорганічна хімія. К.: Вища школа, 1998. –480 с.
9.Ахметов Н.С. Общая и неорганическая химия.: Учебное пособие для студ. хим.-техн.спец. вузов. –М.: Высшая школа, 1998. –743 с.
10.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. –М.: Высшая школа, 1993. –592 с.
11.Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи загальної хімії / За ред. В.С.Телегуса: Підручник. –Львів: Світ, 2000. –424 с.
12.Скопенко В.В., Григор’єва В.В. Найважливіші класи неорганічних сполук. К.: Либідь, 1996. –151 с.
13.Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін. К.: Школяр, 1997. –48 с.
14.Корнілов М.Ю., Білодід О.І., Голуб О.А. Термінологічний посібник з хімії. –К.: ІЗМН, 1996. –256 с.
15.Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990. –352 с.
16.Яцимирський К.Б., Яцимирський В.К. Хімічний зв’язок. К.: Вища школа, 1993. –309 с.
17.Фримантл М. Химия в действии: В 2-х ч. / Пер. с англ. –М.: Мир, 1991. –Ч.1.-528 с.; Ч.2. –622 с.
18.Загальна та неорганічна хімія: Підруч. для студ. вищ. навч. закл. (Ч.2) // О.М.Степаненко, Л.Г.Рейтер, В.М.Ледовських, С.В.Іванов. –К.: Пед. Преса, 2000. -784 с.
19.Оганесян Э.Т. Неорганическая химия для фармацевтических вузов. –М.: Высшая школа, 1983. –523 с.
20.Перепелиця О.П. Властивості та екологічний вплив хімічних елементів: Довідник. –К.: Вентурі, 1997. –192 с.
ЗАНЯТТЯ №44
ТЕМА: Хімія елементів підгрупи Арсену.
Лабораторна робота №18.
АКТУАЛЬНІСТЬ:майбутні провізори повинні знати властивості елементів підгрупи Арсену та їх біологічну роль для застосування в наступній фармацевтичній практиці.
.
НАВЧАЛЬНІ ЦІЛІ: Вивчити хімічні властивості елементів підгрупи Арсену. Навчитися проводити хімічні досліди та складати рівняння хімічних реакцій, які характеризують властивості елементів підгрупи Арсену та їх сполук. Ознайомити студентів з біологічною роллю даних елементів та їх застосуванням в медичній практиці.
ЗНАТИ:-фізичні та хімічні властивості елементів підгрупи Арсену;
-характерні ступені оксидації елементів підгрупи Арсену в
нормальному та збудженому стані;
-особливості хімічних властивостей сполук елементів підгрупи
Арсену.
ВМІТИ:-записати характерні хімічні реакції елементів підгрупи Арсену;
-визначати Арсен за методом Марша;
-писати реакції послідовних перетворень молекул та йонів елементів
підгрупи Арсену;
-розв'язувати типові розрахункові задачі;
-за допомогою хімічних реакцій характеризувати властивості
елементів підгрупи Арсену.
САМОСТІЙНА ПОЗААУДИТОРНА РОБОТА
1.Загальна характеристика елементів підгрупи Арсену. Найважливіші природні сполуки.
2.Методи одержання елементів підгрупи Арсену. Охарактеризувати процеси за допомогою рівнянь реакцій.
3.Водневі сполуки Арсену, Стибію та Бісмуту в порівнянні з аміаком та фосфіном.
4.Хімічні властивості простих речовин підгрупи Арсену. Відношення до неметалів. Взаємодія з нітратною кислотою.
5.Арсин, його одержання і властивості. Застосування в хіміко-токсикологічних дослідженнях. Реакція Марша.
6.Стибін та бісмутин, одержання і властивості.
7.Сполуки Арсену (III), Стибію (III), Бісмуту (III) з киснем, їх добування і хімічні властивості.
8.Оксиди та гідроксиди елементів із ступенем оксидації +3, їх кислотно-основні та оксидаційно-відновні характеристики.
9.Закінчіть рівняння реакцій:
AsH3 + KMnO4 + H2SO4 →
NaBiO3 + Mn(NO3)2 + HNO3 →
As + HNO3 (к.) →
As2O3 + Sn + H2SO4 →
SbCl3 + HCl + Zn →
Sb2S3 + HNO3 (к.) →
AsH3 + NaClO →
As + H2SO4 (к.) →
Sb + Br2 + NaOH →
SbCl3 + Na2CO3 + H2O →
10.Які форми оксигеновмісних аніонів Арсену (V) та Стибію (V) відомі? Зіставте їх з фосфатними йонами, знайдіть причини подібності та відмінності. Як впливають умови на склад арсенат- та стибат-йонів?
11.Написати електронні формули атомів елементів As, Sb, Bi. Вказати їх валентні можливості.
12.У вигляді яких сполук Арсен, Стибій та Бісмут знаходяться в природі? Який загальний принцип добування цих елементів з мінералів? Написати відповідні реакції.
13.Як реагують арсен, стибій та бісмут з хлором, киснем? Написати відповідні рівняння реакцій.
14.Охарактеризуйте відношення арсену, стибію та бісмуту до хлоридної, сульфатної та нітратної кислот. Напишіть рівняння реакцій.
15.Як і чому змінюється кислотно-основний характер оксидів та гідроксидів тривалентних елементів при переході від Арсену до Бісмуту?
16.Як одержати тіоарсеніти та тіоарсенати? Що спостерігається при підкисленні розчинів цих солей? Написати рівняння реакцій.
17.Біологічна роль елементів підгрупи Арсену.
18.В яких умовах протікає реакція взаємодії натрію арсеніту з йодом? Чому?
19.Написати рівняння гідролізу стибію хлориду.
20.Хіміко-токсикологічне значення сполук Арсену.
КОНТРОЛЬНІ ПИТАННЯ
1.Електронна структура атомів елементів підгрупи Арсену в нормальному та збудженому стані.
2.Сполуки Арсену (V), Стибію (V), Бісмуту (V) з киснем, їх добування і хімічні властивості.
3.Відновна здатність сполук із ступенем оксидації +3 в ряду As-Sb-Bi.
4.Мета- та ортоарсенітні кислоти, їх хімічні властивості, взаємоперетворення.
5.Дисоціація гідроксиду арсену як амфотерного електроліту.
6.Арсенатна кислота, її добування та оксидаційні властивості.
7.Арсеніти та арсенати, їх кислотно-основні та оксидаційно- відновні властивості.
8.Якісна реакція на йон AsO43-.
9.Cолі катіонів Стибію та Бісмуту, їх гідроліз.
10.Сульфіди арсену, стибію та бісмуту, їх характер, розчинення в лугах та сульфіді амонію.
11.Одержання натрію бісмутату та його властивості як сильного оксидника.
12.Стибіатна кислота та її солі.
13.Застосування сполук Арсену, Стибію та Бісмуту в медицині та фармації.
14.Сполуки елементів підгрупи Арсену з галогенами. Утворення комплексних сполук та пентагалогенідів.
15.Яку масу натрію бісмутату можна одержати при оксидації хлором в лужному середовищі 4,66 г бісмуту (III) оксиду?
16.Знайдіть масову частку натрію арсенату у 0,5М розчині (ρ=1,07 г/см3).
17.Обчисліть процентний вміст: а) As в скородиті (FeAsO4•2H2O); б) Sb в кермезиті (3Sb2S3•Sb2O3).
18.Який об’єм 0,5М розчину йоду необхідно взяти для оксидації 450 см3 0,1н розчину натрію арсеніту?
19.Один із способів розділення сполук Арсену та Стибію грунтується на пропусканні сірководню крізь розчин трихлоридів у концентрованій хлоридній кислоті. Спочатку осаджується сульфід лише одного з елементів. Після відфільтровування осаду і розбавляння розчину осаджують сірководнем сульфід іншого елемента. Дайте інтерпретацію тому, що відбувається. Поясніть дію концентраційного фактора на ці перетворення.
20.Цинкову пластинку масою 19,5 г занурили у розчин солі бісмуту. Через деякий час її маса збільшилася до 26,6 г. Скільки грамів бісмуту виділилося? Чим доводиться нехтувати при розв’язанні задачі?
21.Наведіть приклади кількох реакцій, за допомогою яких можна добути натрій бісмутат. Охарактеризуйте перетворення солі під дією хлоридної, сульфатної та нітратної кислот. Напишіть рівняння реакцій.
22.Чому розчини SbCl3 та Bi(NO3)3 при розбавлянні водою стають каламутними? Як зробити їх знову прозорими, не відокремлюючи осадів?
23.Напишіть рівняння реакцій гідролізу трихлоридів арсену, стибію, бісмуту. Що спільного і що відмінного у перетвореннях цих сполук під дією води?
24.Охарактеризуйте термічну стійкість арсину, стибіну, бісмутину. Як використовується відповідна властивість сполук для визначення Арсену, Стибію, Бісмуту в різних речовинах?
САМОСТІЙНА АУДИТОРНА РОБОТА
1.Виконання дослідів, описаних в даних методичних вказівках.
2.Обговорення результатів та оформлення висновків.
3.Оформлення та захист протоколу.
4.Відповіді на запитання, запропоновані викладачем, з використанням записів на дошці.
5.Розв'язування розрахункових задач, запропонованих викладачем.
Експериментальна частина