КОНТРОЛЬ ЗА РАБОТОЙ АВТОКЛАВА 1 страница
Задание №1.
При работе с патологическим материалом и больными животными внимание ветеринарного специалиста должно быть сосредоточенно на двух основных моментах: предупредить заражение людей и не допустить распространения возбудителя инфекции. Существуют инфекционные болезни животных, которыми может заразиться человек (зооанотропонозы): сибирская язва, туберкулез, бруцеллез, туляремия, Ку-лихорадка, лептоспироз, листериоз, мелиоидоз, бешенство, болезнь Ауески, ящур, дерматомикозы (трихофития, микроспория), сап, сальмонеллезы, эктима, чума верблюдов (зоантропонозная чума), рожа свиней, орнитоз. Заражение человека этими болезнями может произойти при: клиническом осмотре животных и оказании им лечебной помощи; вскрытии трупов и взятии патологического материала для лабораторного исследования; проведения прививок и диагностических исследований; работе с патологическим материалом лаборатории; соприкосновении с необеззараженным сырьем животного происхождения (кожа, шерсть и т.п.) переработке мясных и молочных продуктов; употреблении в пищу инфицированных продуктов животного происхождения. В организм человека патогенные микробы проникают через кожу при нарушении ее целости, главным образом рук, а также через слизистые оболочки рта, носовой полости, дыхательных путей, глаз и пищеварительного тракта.
Чтобы предохранить себя и других от заражения инфекционной болезнью и не допустить ее распространения, нужно соблюдать следующие меры предосторожности:
1) люди, допускаемые к работе с патологическим материалом и больными животными, должны быть тщательно проинструктированы;
2) все работы с больными животными и патологическим материалом выполняют только в защитной одежде, включающей халат (с завязками на спине и рукавах), колпак или косынку, при необходимости – нарукавники, передники, резиновые перчатки, резиновые сапоги, очки и защитные марлевые маски. Людей с повреждениями на руках к этой работе, как правило, не допускают. При необходимости разрешают работать только в резиновых перчатках, раны на руках смазывают настойкой йода и затем коллодием. Перед надеванием проверяют целость резиновых перчаток;
3) оборудование лаборатории и рабочего места должны обеспечивать высокую производительность труда и его безопасность;
4) при работе с патологическим материалом нельзя курить, разговаривать, касаться лица руками, сморкаться, поправлять волосы, отвлекаться от работы. Следует избегать лишних передвижений. В лаборатории запрещается хранить и принимать пищу;
5) руки после работы погружают в сосуд с дезинфицирующей жидкостью (2%-ный раствор фенола) на 1 – 2 мин, затем тщательно моют водой с мылом;
6) использованные в работе пипетки, предметные и покровные стекла, куски ваты и т.п. тотчас помещают в сосуд с дезинфицирующей жидкостью (5%-ный раствор фенола; 3%-ный раствор лизола или креолина). Металлические предметы, бывшие в контакте с патологическим материалом, немедленно обеззараживают прокаливанием на пламени. Инструменты (ножницы, скальпели, пинцеты и др.) после употребления кипятят в стерилизаторе или кладут в закрытый сосуд для последующего автоклавирования. Если патологический материал попал на окружающие предметы, необходимо немедленно провести тщательную дезинфекцию, залив это место дезинфицирующим раствором, а затем, если можно, прожечь данное место с помощью тампона, смоченного спиртом;
7) весь патологический материал (культуры микробов, трупы животных и т.п.), не подлежащий дальнейшему исследованию, обеззараживают (автоклавируют, сжигают). Место работы с этим материалом должно быть тщательно продезинфицировано и очищено. Допускается только влажная уборка помещений. Особое внимание уделяют удалению пыли с предметов, находящихся в лаборатории. Для обеззараживания комнат, где работают с патологическим материалом, применяют бактерицидные лампы.
Меры против заражения при попадании патологического материала в организм человека: а) при ранениях инфицированным инструментом или при покусе животным не следует торопиться с остановкой кровотечения. Рану нужно прожечь настойкой йода и наложить 40-60%-ную спиртовую повязку; б) при попадании патологического материала в рот его немедленно выплевывают в чашку с дезинфицирующей жидкостью, а рот в течение нескольких минут прополаскивают слабым раствором йода (3 – 5 капель настойки йода на стакан воды) или перманганата калия; в) если патологический материал попал в глаз, его нельзя тереть; следует промыть глаз слабым раствором йода или перманганата калия.
Правила обращения с больными инфекционными болезнями животных. Ветеринарный специалист соприкасается с больными животными во время их исследования (при постановке диагноза), при оказании лечебной помощи, убое животных, вскрытии трупов, проведении эпизоотических мероприятий. Любая работа с больными и в особенности с подозрительными по заболеванию заразными болезнями животными проводится только в защитной одежде.
Исследование больного животного слагается из предварительного ознакомления, включающего регистрацию его , изучение документов и сбор анамнестических, в том числе эпизоотологических, данных, и собственно исследование, которое, в свою очередь, делится на общее исследование (внешний осмотр, исследование кожного покрова и видимых слизистых оболочек и лимфатических узлов, термометрия) и специальное исследование (исследование отдельных систем и органов). При необходимости берут кровь и другие материалы для лабораторного исследования. При исследовании больных и подозрительных по заболеванию животных необходимы чрезвычайная осторожность и продуманность действий. Прежде чем вплотную приступить к этому, надо собрать по возможности полный анамнез, провести предварительное наблюдение за животным и беглый клинический осмотр. Например, если кажется, что собака подавилась костью, прежде чем исследовать глотку, надо тщательно расспросить хозяина о поведении животного в последние дни, характере кормления, о возможных контактах с другими животными, особенно собаками, выяснить нет ли подобных признаков у собак или кошек, принадлежащим соседям. И только после всего этого, соблюдая все меры предосторожности, можно начинать исследовать животное (возможно бешенство!).
Осторожность нужно соблюдать и при оказании больным животным лечебной помощи (при отделении последа или родовспоможении можно заразиться бруцеллезом; ошибочное вскрытие сибиреязвенного карбункула повлечет за собой рассеивание возбудителя болезни и возможность заражения человека). Место, где проводилась работа с больным животным, дезинфицируют.
|
 |
Задание № 2.
М и к р о с к о п и е г о у с т р о й с т в о. Микроскоп – оптический прибор, с помощью которого рассматривают и изучают мельчайшие организмы и предметы, невидимые простым глазом. Микроскопы, производимые отечественной промышленностью для биологических исследований: биолам P-микроскоп биологический рабочий с моно- или бинокулярной насадками, увеличение от 50 до 1800 раз; биолам Д-микроскоп биологический дорожный; биолам С-микроскоп биологический студенческий; люмам Р- рабочий и люмам И-исследовательский люминесцентные микроскопы.
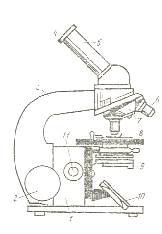
Каждый микроскоп имеет две основные системы: механическую и оптическую (рис.1). Механическая система микроскопа состоит из штатива, включающего ножку (1) и тубусодержатель (3) или колонку. К ней прикреплен тубус (5) с вращающимся барабаном-револьвером (7) на нижнем конце. Тубус передвигается макрометрическим винтом (2), для тонкой наводки служит микрометрический винт (11). К ножке прикреплен предметный столик (8), на который помещают исследуемый препарат, закрепляемый зажимами.
Оптическая система состоит из зеркала(10),конденсора(9) с ирисовой диафрагмой, объективов (6) и окуляра (4). Степень увеличения объективов указана на оправе:*8,*10, *20, *40, *60, *90. Различают два типа объективов: сухие и иммерсионные (масляные). При работе с иммерсионными объективами каплю масла (кедрового, вазелинового или касторового) наносят на мазок и с помощью макрометрического винта осторожно под контролем глаза погружают объектив масло, не прикасаясь к стеклу. Наблюдая в окуляр, медленно поднимают макровинтом тубус до появления изображения. Для тонкой наводки используют микрометрический винт. Окуляры отечественных микроскопов обозначаются 7*, 10*, 15*, 20*, т. е. цифрами, указывающими на степень их собственного увеличения. Умножив цифру на оправе объектива на цифру окуляра, получим число, показывающее, во сколько раз увеличивает микроскоп.
Перед работой с микроскопом надо установить освещение. При дневном свете пользуется плоским зеркалом, при искусственном – вогнутым. В качестве источников искусственного света используют лампы – осветители. Когда свет установлен, берут препарат, помещают на предметный столик и изучают сначала под малым, а затем под большим увеличением, используя для этого сухую или иммерсионную систему.
Задание № 3.
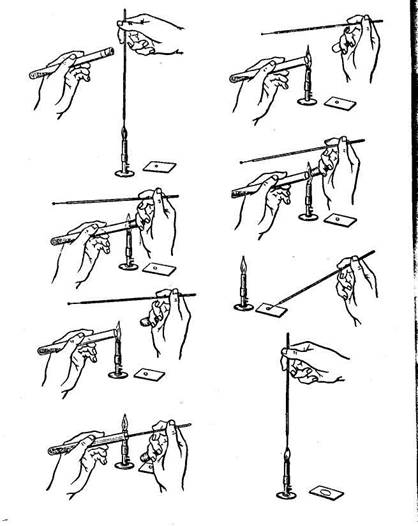
Изготовление мазков.Мазки из культур микробов и мазки-отпечатки из органов трупа готовят на чистых обезжиренных предметных стеклах. Непосредственно перед приготовлением мазка предметное стекло несколько раз проводят через пламя горелки. При изготовлении мазка из культуры микробов надо предохранить ее от загрязнения микробами из окружающей среды и не допустить инфицирование этой культурой окружающих предметов. Материал из пробирки с культурой берут прокаленной на пламени горелки бактериологической (платиновой) петлей или стерильной пастеровской пипеткой. Тонкий конец пипетки после прокаливания на пламени сгибают под прямым углом. Открывают пробирку над пламенем, вынимают пробирку и открытый конец пробирки также обжигают на пламени. Петлю прожигают еще раз и, остудив, вводят я пробирку, не касаясь ее краев, захватывают каплю культуры. При пользовании пипеткой тонкий конец ее обламывают и насасывают культуру, пользуясь при этом резиновой грушей (а не ртом). Пробирку в этот момент держат чуть в стороне от пламени горелки. Затем закрывают пробирку над пламенем пробкой, также проведенной через пламя горелки. Взятый материал наносят на предметное стекло и размазывают тонким слоем, петлю прокаливают и ставят в штатив, пипетку – в сосуд с дезраствором.
При изготовлении мазков из агаровых культур на предметное стекло предварительно наносят каплю стерильного физиологического раствора или бульона.
При изготовлении мазков-отпечатков из органов участок органа, откуда предполагается сделать отпечаток, прижигают шпателем или обжигают на пламени. Стерильными ножницами вырезают небольшой кусочек исследуемого органа и, захватив его пинцетом, прижимают поверхность разреза к предметному стеклу, делая таким образом несколько отпечатков.
Мазки с обратной стороны специальным карандашом по стеклу обводят и надписывают, указывая при этом номер или кличку животного и дату изготовления мазка. Приготовленные тем или иным способом мазки высушивают на воздухе и фиксируют физическим (3 – 4-кратным проведением над пламенем горелки) или химическим (спирт-ректификат в течение 15 – 20 мин; смесь спирта с эфиром поровну – 10 – 15; метиловый спирт – 5 мин; хлороформ – несколько секунд) способом.
|
Рис. Схема приготовления препарата-мазка
Окраска мазков. Ее проводят простым или сложным способами.
П р о с т о й с п о с о б: на фиксированный мазок наливают несколько капель раствора карболового фуксина Циля в разведении 1:10 или метиленовой синьки Леффлера. Затем краску смывают дистиллированной водой, мазок высушивают фильтровальной бумагой.
С л о ж н ы е с п о с о б ы. Окраска по Граму: на фиксированный мазок кладут кусочек фильтровальной бумаги и на него наливают раствор генцианвиолета. Через 2 мин бумагу удаляют, раствор сливают, на препарат наливают люголевский раствор. Спустя 1 мин его сливают и препарат в течение 30 с обрабатывают спиртом-ректификатом, затем промывают водой и окрашивают спиртоводным фуксином (для этого карболовый фуксин разводят 1:10 водой) в течение 2 мин. После этого препарат промывают водой и рассматривают под микроскопом.
Можно использовать заранее приготовленные и высушенные бумажки, пропитанные 1%-ным спиртовым раствором генцианвиолета. Их кладут на фиксированный мазок и смачивают водой; в остальном техника окраски та же.
Микрокартина: Грамположительные микробы темно-фиолетовые, грамотрицательные – розовые.
Окраска по Цилю – Нильсену. Применяют при микроскопической диагностике туберкулеза и паратуберкулеза. Фиксированный на пламени мазок покрывают фильтровальной бумажкой, наливают на нее карболовый фуксин и подогревают до появления паров, после чего нагревание прекращают и оставляют краску на препарате 2 – 3 мин. Затем пинцетом удаляют бумажку и промывают мазок водой. После этого обесцвечивают препарат 5%-ным водным раствором серной кислоты в течение 3 – 5 с, тщательно промывают водой и докрашивают в течение 3 – 5 мин метиленовой синькой Леффлера. Краску смывают водой, препарат высушивают.
Микрокартина: спирто-кислотоустойчивые микробы красные, остальные – синие.
Окраску по Козловскому применяют для микроскопической диагностики бруцеллеза. Фиксированный на пламени мазок окрашивают 2%-ным раствором сафранина (раствор готовят непосредственно перед употреблением) с интенсивным подогреванием (до появления паров). Промывают водой и окрашивают 1%-ным водным раствором малахитовой зелени в течение 1 мин. Затем промывают водой и высушивают.
Микрокартина: бруцеллы красные, остальные микробы зеленые.
О к р а с к а к а п с у л применяется при микроскопической диагностике сибирской язвы.
Способ Михина. Фиксированный мазок при подогревании окрашивают метиленовой синькой Леффлера в течение 2 – 3 мин до появления паров. Краску быстро смывают водой, мазок высушивают.
Микрокартина: капсулы светло-розовые, бациллы темно-синие.
О к р а с к а с п о р. Способ Пешкова. Фиксированный мазок окрашивают кипящей метиленовой синькой Леффлера в течение 20 с. После охлаждения мазок промывают водой и докрашивают 0,5%-ным водным раствором нейтральрота в течение 30 с, затем промывают водой и высушивают.
Микрокартина: споры синие, микробные тела розовые, ядра фиолетовые.
Отчёт
Задание №1
| Мероприятия | Меры предосторожности |
Задание №2
| Микроскоп | Техника микроскопии | |
| Механическая часть | Оптическая часть | |
Задание №3
| Метод окраски | Применяют для диагностики | Микрокартина |
Вывод:_________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата ____________________ Подпись преподавателя __________________________________
Лабораторная работа № 2.
Тема: Ознакомление с питательными средами.
Цель занятия: Изучение простых питательных сред, методика их приготовления.
Литература: И.А. Бакулов. Практикум по эпизоотологии с микробиологией. c.20-24
Задание № 1. Изучить простые питательные среды, методику их приготовления.
Задание № 2. Изучить методику определения PH (реакции) питательной среды.
Методика выполнения:
Задание № 1.
Простые питательные среды – мясопептонный бульон и агар – готовят на мясной воде.
Мясная вода. Мясо освобождают от костей, жира, пленок и сухожилий, пропускают через мясорубку, заливают 2- или 4-кратным количеством воды (по массе) и кипятят в течение 1 ч. Жидкость фильтруют через вату или полотно, затем через фильтровальную бумагу. Фильтрат измеряют и доливают до первоначального объема дистиллированной водой.
Другой способ – мясной фарш заливают 2- или 4-кратным количеством дистиллированной воды, тщательно перемешивают и оставляют на сутки в прохладном месте. На следующий день фарш отжимают, настой кипятят 30 мин и фильтруют.
Приготовленную мясную воду заливают по бутылкам и стерилизуют 30 – 40 мин в автоклаве при давлении 100 кПа (1атм).
Мясопептонный бульон (МПБ). К мясной воде добавляют 1% пептона, 0,5% химически чистой поваренной соли и кипятят до растворения пептона. Затем в горячем бульоне определяют рН и добавлением 10%-ного раствора углекислой соды или децинормального (0,1 н.) раствора едкого натра устанавливают рН 7,2 – 7,4. После этого бульон еще раз кипятят 15 –20 мин в автоклаве при давлении 100 кПа (1атм).
Мясопептонный агар (МПА). Мясопептонный бульон добавляют 2 – 3 % агар-агара и расплавляют его нагреванием в автоклаве или текучепаровом аппарате. В расплавленном агаре определяют рН и устанавливают его равным 7,2 – 7,4 добавлением 10%-ного раствора углекислой соды или децинормального раствора едкого натра. Для просветления среды добавляют на 1 литр расплавленного и охлажденного до 50*С агара белок одного куриного яйца или 10 мл кровяной сыворотки, после чего нагревают в автоклаве при температуре 105*С для свертывания, фильтруют в горячем виде через ватно-марлевый фильтр (в нагретом автоклаве), разливают по колбам и пробиркам, затем стерилизуют в автоклаве при давлении 100 кПа (1атм) в течение 30 мин.
Сухие питательные среды. В лабораторной практике широко используют готовые сухие питательные среды, выпускаемые промышленностью. Их растворяют в дистиллированной воде, разливают по пробиркам, колбам или бактериологическим чашкам и при необходимости стерилизуют в автоклаве или текучепаровом аппарате.
Розлив питательных сред. Среды по пробиркам и колбам разливают с помощью приспособления, состоящего из штатива и стеклянной воронки, на конце которой укреплена резиновая трубка со стеклянным наконечником. С этой же целью используют специальные дозирующие устройства – дозаторы.
Задание № 2.
Определение рН (реакции) питательной среды. Применяют 2 метода: колориметрический и электрометрический. Принцип определения рН к о л о р и м е т р и ч е с к и м с п о с о б о м (по Михаэлису) заключается в сравнении окраски среды после добавления в неё индикатора с окраской готовой шкалы запаянных пробирок с различными показателями рН (отличаются по цвету). Для определения рН применяют индикаторы нитрофенолового ряда. Так как питательные среды для выращивания микробов в большинстве случаев имеют слабощелочную реакцию, при определении рН пользуются индикаторами ряда метанитрофенола, которым определяют рН от 6,7 до 8,4. Растворы индикатора готовят на дистиллированной воде и хранят в бутылях с притертыми пробками. Сравнение окраски среды и стандарта проводят в компараторе. Меняя стандартные пробирки, подбирают такую, которая по окраске больше всего соответствует испытуемой среде. По обозначению на этикетке стандарта узнают рН.
Э л е к т р о м е т р и ч е с к и м м е т о д о м рН определяют с помощью специальных приборов, к числу которых относится лабораторный ионометр ЭВ-74. Он состоит из металлического корпуса, где находятся элементы измерительной схемы прибора, а также лабораторного датчика, в комплект которого входят специальные электроды. Их погружают в испытуемый раствор и по шкале прибора определяют рН.
При приготовлении питательных сред приходится производить подщелачивание, т.к. мясная вода из свежего мяса имеет рН 6,6 – 6,8. Обнаружив в пробе кислую реакцию берут новую пробную порцию среды, подщелачивают её точным количеством децинормального раствора едкого натра или 10%-ного раствора углекислой соды и снова проверяют. После установления нужной реакции высчитывают, какое количество щелочи необходимо для подщелачивания всей среды. Чтобы избежать ошибок, добавлять щелочь следует осторожно; сначала её берут в несколько меньшем количестве, затем ещё раз определяют реакцию среды, после чего добавляют оставшуюся часть раствора щелочи. При стерилизации сред под давлением рН может снижаться на 0,2 – 0,4. Поэтому после первого усреднения пробу рекомендуется кипятить 30 с, а затем после охлаждения снова определить и установить нужный рН. Для определения рН в твердых средах их надо растопить и развести теплой дистиллированной водой.
Отчёт
Задание №1
| Классификация | Название |
| по происхождению: | |
| по консистенции: | |
| по назначению: | |
| по составу: | |
Задание №2
| Классификация | Название |
| мясная вода: | |
| МПБ: | |
| МПА: | |
Задание №3
| Метод | Определение РН среды |
| колориметрический: | |
| электрометрический: | |
Вывод:_________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата ____________________ Подпись преподавателя __________________________________
Лабораторная работа № 3.
Тема: Ознакомление с лабораторной аппаратурой.
Цель занятия: Ознакомление с приборами и аппаратами применяемые в лабораторной
практике.
Литература: И.А. Бакулов. Практикум по эпизоотологии с микробиологией с.24 – 33.