Успехи атомистической гипотезы в химии привели к тому, что она стала использоваться в физике в качестве гипотезы, что теплота есть форма движения атомов
Клаузиус рассматривает теплоту как движение атомов и молекул. Для вывода количественных закономерностей Клаузиус также ссылается на теорию вероятностей и законы упругого удара, что позволяет ему получить основное уравнение молекулярно-кинетической теории газов.
Новым шагом в развитии молекулярно-кинетической теории газов явилась работа Джемса Клерка Максвелла (1831—1879) «Пояснение к динамической теории газов» (1860), в которой он дал первый вывод закона распределения скоростей газовых молекул, носящий его имя. Максвелл приходит также к выводу о равномерном распределении средней энергии по степеням свободы.
Вывод закона распределения скоростей газовых молекул усовершенствовал австрийский физик Людвиг Больцман (1844—1906), который также показал, что распределение скоростей Максвелла является единственно возможным стационарным распределением, и нашел функцию распределения для газа, находящегося в силовом поле, согласно которому с изменением высоты меняется только плотность газа, а его температура остается постоянной.
Больцман доказал знаменитую Н-теорему, согласно которой газ, первоначально находящийся в любом нестационарном состоянии, с течением времени сам собой переходит в стационарное состояние, которому соответствует распределение Максвелла-Больцмана.
Основная заслуга Больцмана перед наукой заключается в том, что он дал статистическое обоснование II началу термодинамики. Больцман доказал, что наиболее вероятным является такое состояние системы, в котором ее энтропия является наибольшей. Поэтому между термодинамической вероятностью всякого состояния (или статистическим весом W) и энтропией (S) существует связь, причем энтропия должна выражаться через логарифм вероятности. В 1906 г. Макс Планк записал формулу, выражающую идеи Больцмана в следующем виде
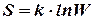
Коэффициент пропорциональности k был рассчитан Планком и назван им в честь Больцмана, а сама формула выгравирована на памятнике Больцману на кладбище в Вене.
Статистическое обоснование II начала термодинамики означало, что закон возрастания энтропии получил следующую интерпретацию: «Система стремится к наиболее вероятному состоянию». Значит, II начало перестает быть абсолютным законом природы и становится статистическим. Следовательно, процессы во Вселенной принципиально могут протекать в обе стороны, а значит, во Вселенной в целом невозможна тепловая смерть.
Таким образом, Максвелл и Больцман впервые осознали тот факт, что коллектив молекул не подчиняется детерминированным законам механики, а описывается вероятностными (или статистическими) закономерностями. Так родилась статистическая физика, которая станет идеологической основой современной физики. Однако в XIX веке в формировавшейся электромагнитной картине мира статистическим представлениям не было места.
Дальнейшее развитие молекулярно-кинетическая теория газов получила в теории голландского физика Ван-дер-Ваальса (1837-1923), который в 1873 г. разработал первую теорию реальных газов. Эта теория учитывала размеры молекул и силы, действующие между ними.
Уравнение состояния реального газа теоретически предсказывало наличие газообразного и жидкого состояний для всех веществ без исключения. Это снимало принципиальное различие между парами и газами, последние из которых, как казалось, нарушали единство мира и выглядели некими совершенными веществами, имеющими только газовую фазу.
Таким образом, после проведения работ по сжижению газов стало ясно, что никаких принципиальных различий между газами и парами не существует, а все вещества во Вселенной могут иметь газообразное, жидкое и твердое состояния.
К проблеме тепловой смерти Вселенной.
Как указывалось выше, все попытки решить проблему тепловой смерти Вселенной в рамках термодинамики оказались безуспешными. И только представления статистической физики позволили найти пути решения концепции тепловой смерти.
Закон возрастания энтропии можно рассматривать как закон необратимости времени, который определяет направление течения времени, по словам Эддингтона – «стрелу времени». Для изолированной реальной системы будущее всегда расположено в направлении возрастания энтропии.Рост энтропии отличает будущее от настоящего, а настоящее от прошлого. Таким образом, II начало термодинамики проводит четкую границу между движением как повторением и движением как необратимым диалектическим процессом.
Закон несохранения энтропии для реальных систем, приводящий к необратимости времени, противоречил законам механики Ньютона, где все процессы обратимы во времени. Это связано с тем, что законы механики являются абсолютно детерминированными (Лапласовский детерминизм), а II начало термодинамики по своей сущности является статистическим законом, который описывает системы с вероятностным принципом причинности.
Второе начало термодинамики указывает на то, что вследствие необратимого характера протекания процессов в термодинамических системах, они не могут быть управляемыми до конца.
Однако Максвеллом было высказана идея, что второе начало термодинамики в отличие от первого имеет свои границы применимости – оно не применимо к движению отдельной молекулы. Необратимость движения обнаруживается лишь в поведении огромного числа молекул.
Следующим шагом в этом направлении явилась флуктуационная гипотеза Больцмана, изложенная им в «Лекциях по теории газов» в 1877г.Больцман считал, что II начало термодинамики нельзя распространять на всю Вселенную. Хотя Вселенная вследствие своей бесконечности в пространстве и вечности во времени уже достигла состояния термодинамического равновесия, но учитывая статистический характер принципа возрастания энтропии, для небольших областей этой бесконечной Вселенной возможны макроскопические отклонения от состояния равновесия. Флуктуационная гипотеза Больцмана как раз и заключается в том, что мы живем внутри такой гигантской флуктуации, приведшей к локальному понижению энтропии. Рассасывание этой флуктуации и связанный с этим рост энтропии наблюдаемой части Вселенной не означает тепловой смерти, поскольку с неизбежностью должны возникать аналогичные флуктуации в других частях Вселенной. Поэтому, в результате таких флуктуаций исчезает необратимость тепловой смерти Вселенной, в отдельных частях которой наблюдается отклонение от положения теплового равновесия и эволюционное развитие материи.
Таким образом, идея эволюции, выдвинутая Дарвином в XIX веке применительно к живым организмам, была перенесена Больцманом в физику и распространена, в том числе, на неживую материю.
Так, эволюционная теория Дарвина—это путь естественного отбора спонтанных флуктуаций видов в сторону возникновения и возрастания сложности, что является необходимым условием биологической эволюции. Флуктуационная гипотеза Больцмана является необходимым условием эволюции Вселенной, тем активным началом, без которого невозможно бесконечное развитие материи и которое отрицает существование конца мира несмотря на П начало термодинамики, утверждающее необратимость возрастания энтропии, что приводит к забыванию начальных условий и разрушению порядка.
Скептическое отношение многих ученых к атомистической теории Больцмана, трудности с определением роли II начала термодинамики в системе естествознания, и, возможно, ряд других причин привели этого гениального ученого к трагическому концу. В 1906 году он покончил жизнь самоубийством.
Флуктуационная гипотеза Больцмана получила дальнейшее развитие в современной физике, физике XX века, в рамках которой сформировалось новое междисциплинарное направление — синергетика. Синергетика изучает проблемы самоорганизации в сложных системах, в том числе и проблемы эволюции Вселенной. Основоположником синергетики является И. Пригожин, который работал в области неравновесной термодинамики. Им было показано, что процессы, протекающие в различных явлениях природы, следует разделять на два класса. К первому классу относятся процессы, протекающие в замкнутых системах. Они развиваются в направлении возрастания энтропии и приводят к установлению равновесного состояния в системах. Ко второму классу относятся процессы, протекающие в открытых системах. В соответствующие моменты — моменты неустойчивости - в них могут возникать малые возмущения, флуктуации, способные разрастаться в макроструктуры. То есть, хаос и случайности могут выступать в качестве активного начала, приводящего к развитию новых самоорганизаций. Таким образом, в неравновесных открытых системах возможны эффекты, приводящие не к возрастанию энтропии и стремлению термодинамических систем к состоянию равновесного хаоса, а к «самопроизвольному» возникновению упорядоченных структур, к рождению порядка из хаоса.
Как было показано Пригожиным, самоорганизация в сложных системах, во-первых, свидетельствует о невозможности установления жесткого контроля за системой. То есть самоорганизующейся системе нельзя навязать путь развития. Управление такой системой может рассматриваться лишь как способствование собственным тенденциям развития системы, с учетом присущих ей элементов саморегуляции. Во-вторых, для самоорганизующихся систем существует несколько различных путей развития. Таким образом, синергетика указывает границы применимости II начала термодинамики и делает его элементом более широкой теории необратимых процессов.